藜麦蛋白对低钠盐体系中猪肉肌原纤维蛋白凝胶特性的影响
蒙志明 刘莹 席越阳 朱迎春

摘 要:分别将3%、6%、9%和12%藜麦蛋白添加到低钠盐(0.40 mol/L NaCl、0.10 mol/L KCl和0.05 mol/L CaCl2)猪肉肌原纤维蛋白(myofibrillar protein,MP)体系中,考察藜麦蛋白添加量对复合蛋白溶液/凝胶的理化性质、蛋白二级结构、化学作用力和微观结构的影响。结果表明:藜麦蛋白的添加提高了MP的凝胶强度、保水性和动态流变特性,这是因为藜麦蛋白提高了复合蛋白溶液的蛋白溶解度和ζ-电位绝对值,降低了蛋白粒径;复合蛋白体系中的化学作用力以二硫键和疏水作用为主,但是藜麦蛋白的添加提高了离子键和氢键含量;藜麦蛋白促进了无规则卷曲向β-折叠和α-螺旋转化,增加了凝胶的稳定性;扫描电镜显示,藜麦蛋白提高了复合凝胶的致密程度。综上,藜麦蛋白作为一种优质植物蛋白,可以增强MP的凝胶特性,特别是当藜麦蛋白添加量为6%~9%时,对低钠盐体系中MP凝胶性能的改善效果较好。
关键词:藜麦蛋白;低盐体系;肌原纤维蛋白;凝胶特性;蛋白结构
Abstract: In this study, the effects of adding different levels (3%, 6%, 9% and 12%) of quinoa protein on the physicochemical properties, secondary structure, chemical forces, and microstructure of pork myofibrillar protein (MP) in a low-sodium salt system (0.40 mol/L NaCl, 0.10 mol/L KCl and 0.05 mol/L CaCl2) were investigated. The results showed that the gel strength, water retention and dynamic rheological properties of MP were improved by adding quinoa protein, which increased the solubility and the absolute value of ζ-potential of MP, and reduced the particle size. Disulfide bonds and hydrophobic interactions were the dominant chemical forces in the mixed protein system, but the addition of quinine increased the amount of ionic and hydrogen bonds. Fourier transform infrared (FTIR) spectroscopy showed that quinoa protein promoted the transformation of random coils to β-sheets and α-helixes and enhanced the stability of the MP gel. Scanning electron microscopy (SEM) showed that the quinoa protein increased the compactness of the gel. Therefore, quinoa protein, as a high-quality plant protein, can enhance the gel properties of MP. In particular, adding 6%–9% of quinoa protein is most effective in improving the gel properties of MP.
Keywords: quinoa protein; low-sodium salt system; myofibrillar protein; gel properties; protein structure
DOI:10.7506/rlyj1001-8123-20230413-028
中圖分类号:TS251.5 文献标志码:A 文章编号:
引文格式:
蒙志明, 刘莹, 席越阳 等. 藜麦蛋白对低钠盐体系中猪肉肌原纤维蛋白凝胶特性的影响[J]. 肉类研究, 2023, 37(5): . DOI:10.7506/rlyj1001-8123-20230413-028. http://www.rlyj.net.cn
MENG Zhiming, LIU Ying, XI Yueyang, et al. Effect of quinoa protein on gel properties of pork myofibrillar protein in low-sodium salt system[J]. Meat Research, 2023, 37(5): . (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230413-028. http://www.rlyj.net.cn
肉制品在居民膳食结构中占有重要地位,但是在肉制品加工时由于加入的食盐含量较高,导致消费者摄入较多肉制品时有血压升高和罹患心脑血管疾病的风险[1]。因此,世界卫生组织近年来一直倡导消费低钠盐食品,实际生产中也常常利用氯化钾、氯化镁和氯化钙等替代部分氯化钠来生产低钠盐肉制品[2]。但是研究发现,低钠盐会使肉制品中的肌原纤维蛋白(myofibrillar protein,MP)凝胶特性变差,产品品质下降。因此肉制品低钠盐与MP凝胶性差的矛盾成为肉类工业领域亟需解决的一大难题[3-4]。报道显示,脂类、多糖、海洋酸类水解物、动植物蛋白质和酚类物质的加入均可以改善MP的凝胶特性[5]。Diazda等[6]发现,大豆球蛋白的添加使PSE(pale, soft, exudative)肉的肌球蛋白凝胶强度及保水性均得到提高,当肌球蛋白和大豆球蛋白的质量比为3︰1时形成的凝胶品质最好。Borderías等[7]研究发现,在鱼糜MP中加入8%和10%的豌豆分离蛋白,形成了良好的混合凝胶网络,增强了网状结构的构象柔性。
山西静乐县富产藜麦,被誉为“中国藜麦之乡”。与其他植物蛋白相比,藜麦蛋白是一种优质蛋白,营养价值高,氨基酸含量丰富且比例均衡[8],特别是富含人体必需的8 种氨基酸和婴幼儿必需的组氨酸。Ogungbenle[9]发现,藜麦的蛋白含量为13%,远高于大部分谷物。藜麦蛋白不含胆固醇,长期摄入也不会诱发慢性代谢疾病,比动物蛋白更有利于人体健康[10]。藜麦蛋白的溶解度高于一般谷物蛋白,并具有很好的稳定性,所以在加工时,藜麦蛋白可以较好地保持原有的特性和营养价值。同时,藜麦蛋白能够提高肉制品的冻融稳定性并用来制备Pickering乳液[11],Cen Kaiyue等[12]研究发现,藜麦蛋白添加量为5.0%~7.5%(以MP质量为基准)的Pickering乳液加入到MP中能增强分子间的相互作用,促进蛋白结构的稳定,改善凝胶性能。
前期实验优化得到MP体系中最佳低盐配方为0.40 mol/L NaCl、0.10 mol/L KCl和0.05 mol/L CaCl2,此配方可以替代1/3 NaCl来生产低盐肉制品[13]。但是优化得到的低盐肉制品的凝胶性能略有不足,如将藜麦蛋白与MP进行复配,不仅可以提高MP的弹性、硬度等凝胶性能,还引入了植物蛋白成分,使动植物营养更加丰富,可以进一步提高肉制品的营养价值和凝胶特性。本研究以前期实验为基础建立MP低盐体系,在该体系中添加不同量的藜麦蛋白,考察藜麦蛋白对MP溶液性质(蛋白粒径、ζ-电位、蛋白溶解度)和MP凝胶特性(凝胶强度、保水性、动态流变性)的影响,并通过化学作用力、二级结构和微观结构的测定探究藜麦蛋白改变MP凝胶特性的机理,为藜麦蛋白在凝胶型低盐肉制品中的应用提供理论基础和数据支持。
1 材料与方法
1.1 材料与试剂
新鲜纯种山西黑猪背最长肌(6 月龄公猪,宰后48 h) 双汇冷鲜肉专卖店;金龙鱼大豆油 晋中市太谷区家家利超市;藜麦蛋白粉(蛋白含量≥80%) 陕西九次方生物科技有限公司。
氯化钠、氯化钾、氯化钙、氯化镁、硫酸铜、氢氧化钠、酒石酸钾、盐酸、磷酸氢二钾、磷酸二氢钾、尿素、β-巯基乙醇、溴化钾、溴酚蓝、戊二醛、乙醇、焦磷酸钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(均为分析纯) 天津化学试剂一厂。
1.2 仪器与设备
5801R离心机 德国Eppendorf公司;HY-2调速多用振荡器 常州国华电器有限公司;BSA-124S-CW电子天平 上海精密科学仪器公司;PB-10 pH计 瑞士梅特勒-托利多仪器有限公司;FM-200高剪切均质乳化仪 上海弗鲁克流体机械制造有限公司;UV-1100可见分光光度计 上海美谱达仪器有限公司;HH-S4电热恒温水浴锅 北京科伟永兴仪器有限责任公司;Nicolet iS5红外光谱仪 美国赛默飞世尔科技公司;TENSOR27傅里叶变换红外光谱仪 德国布鲁克分析仪器公司;SM-7500F冷场发射扫描电子显微镜 日本电子株式会社;CM-5分光测色仪 日本Konica Minolta公司;Zetasizer Nano ZS90电位仪 英国Malvern公司;TA.XT Plus质构仪 英国Stable Micro Systems有限公司。
1.3 方法
1.3.1 实验设计
在低钠盐模式下(0.4 mol/L NaCl、0.1 mol/L KCl和0.1 mol/L CaCl2,pH 6.2的磷酸盐缓冲液)将MP配制成质量浓度为40 mg/mL的蛋白溶液,将3%、6%、9%和12%(以MP质量为基准)的藜麦蛋白添加到配制好的MP溶液中混合均匀,对复合蛋白溶液的指标(蛋白粒径、ζ-电位、蛋白溶解度、流变学特性)进行测定,同时制备热诱导凝胶,测定凝胶强度、保水性、白度(W)、化学作用力、蛋白质二级结构等指标,并利用电子显微镜对凝胶的微观结构进行观察。
1.3.2 MP的提取
参考Zhou Lei等[14]的方法并进行适当修改。将选好的猪背最长肌切碎后称取6 g放入100 mL离心管中,加入4 倍体积(V/m)的缓冲液Ⅰ(0.1 mol/L NaCl、10 mmol/L Na2HPO4、2 mmol/L MgCl2、pH 7.0),用高速匀浆机B档(13 000 r/min)匀浆30 s,离心(2 000×g、15 min、2 ℃)弃去上清液。再用缓冲液Ⅰ重复上述操作2 次,之后用8 倍体积的缓冲液Ⅱ(0.1 mmol/L NaCl)将处理后的沉淀高速匀浆,离心(2 000×g、15 min、2 ℃)弃去上清液,重复操作2 次,第3次匀浆之后使用2 层纱布过滤掉可见的结缔组织丝状物,調节溶液pH值为6.2,离心(2 000×g、15 min、2 ℃)处理得到沉淀MP。MP需在4 ℃条件下保存,48 h内使用。MP中的蛋白浓度通过双缩脲方法进行测定。
1.3.3 MP及混合蛋白溶液中蛋白溶解度测定
参考Benjakul等[15]的方法并略作修改。配制5 mg/mL MP溶液,用1,4-哌嗪二乙磺酸(1,4-piperazinediethane sulfonic,PIPES)缓冲液(0.6 mol/L NaCl、0.02 mol/L MgCl2、0.01 mol/L PIPES、0.01 mol/L Na4P2O7,pH 6.2)定容至10 mL,然后在2 ℃条件下放置4 h,每隔20 min振荡1 次,4 h后将样品置于离心机中离心(2 ℃、5 000×g、15 min),取上清液用双缩脲法测定蛋白含量。
MP及混合蛋白溶液中蛋白溶解度按式(1)计算。
式中:ρ1为上清液中的蛋白质量浓度/(g/mL);ρ2为所配制溶液中的蛋白质量浓度/(g/mL)。
1.3.4 MP及混合蛋白溶液中蛋白粒径和ζ-电位测定
参考Shen Lan等[16]的方法并略作修改。分别取配制好的1 mL 2 mg/mL蛋白溶液放入Zeta电位仪测定蛋白粒径分布和ζ-电位,温度设置为25 ℃。
1.3.5 流变学特性测定
参考Zhao Yinyu等[17]的方法并略作修改。用流变仪测定样品的动态流变学特性,采用50 mm平板测试,将样品均匀涂布于测试平台,排除气泡。测试参数:频率0.1 Hz,应变2%,上下狭缝宽度1 mm,起始温度30 ℃,升温速率2 ℃/min,终止温度90 ℃。测定过程中溶液与空气接触处加一层硅油密封,防止加热过程中水分挥发流失。
1.3.6 复合MP凝胶的制备
参考Lin Duanquan等[18]的方法略作修改。使用磷酸盐缓冲液将MP配制成质量浓度为40 mg/mL的蛋白溶液,将3%、6%、9%和12%(以MP质量为基准)的藜麦蛋白添加到配制好的MP溶液中,搅拌均匀,以不添加藜麦蛋白的MP溶液为对照组。所得到的溶液采用二次加热法,先在40 ℃水浴条件下加热30 min,再于80 ℃水浴中加热30 min,之后快速放入冰水中冷却30 min,最后将得到的凝胶放入4 ℃条件下平衡24 h。
1.3.7 复合MP凝胶保水性测定
参考Sánchez-González等[19]的方法并略作修改。将凝胶放于离心管中,称凝胶样品与离心管质量,将样品置于离心机中离心(5 000 r/min、15 min),称量离心管与样品的质量,样品的保水性按式(2)计算。
式中:m0为离心管质量/g;m1为离心后离心管与样品质量/g;m2为凝胶样品与离心管质量/g。
1.3.8 复合MP凝胶强度测定
参考Zhou Lei等[20]的方法并略作修改,测定参数:10 mm探头,测前速率2 mm/s,测试速率2 mm/s,测后速率2 mm/s,下压深度5 mm,测试前距离40 mm,触发力4 g。
1.3.9 复合MP凝胶色泽测定
用色差仪测量复合MP凝胶不同位置的色差,记录亮度值(L*)、红绿值(a*)和黄蓝值(b*),分别计算W,取其平均值。W按式(3)计算。
1.3.10 复合MP凝胶化学作用力测定
参考Jiang Jiang等[21]的方法并略作修改。称取2 g制备好的凝胶样品于50 mL离心管中,加入18 mL溶解液高速匀浆30 s形成均匀的混合溶液。将混合溶液在80 ℃加热30 min,冷却至室温,然后5 000 r/min离心15 min,测定上清液的蛋白质含量。
不同溶解液分别为:0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L尿素(SC)、0.6 mol/L NaCl+8 mol/L尿素(SD)、0.6 mol/L NaCl+8 mol/L尿素+0.05 mol/L β-巯基乙醇(SE)。不同化学作用力分别用不同组间上清液蛋白质量浓度之差表示:离子键表示为SB与SA组之差,氢键表示为SC与SB组之差,疏水作用力表示为SD与SC组之差,二硫键表示为SE与SD组之差。
1.3.11 复合MP凝胶二级结构测定
参考Nian Linyu等[22]的方法并略作修改。称取10 mg冻干的MP凝胶粉末样品,加入1 g溴化钾,研磨成均匀的粉末状,之后用压片机将样品压成透明片状。使用傅里叶变换红外光谱仪扫描测量,波长范围为400~4 000 cm-1。利用Peakfit 4.12處理,计算其二级结构的相对含量。
1.3.12 复合MP凝胶微观结构观察
参考Guo Yalong等[23]的方法并略作修改。将制备好的凝胶样品切成2 mm×2 mm×1 mm的形状,用体积分数2.5%的戊二醛溶液4 ℃条件下固定12 h,用0.1 mol/L磷酸盐缓冲溶液(pH 7.2)洗3 次,每次15 min,然后依次用体积分数50%、70%、80%、90%和100%乙醇溶液脱水15 min,样品进行冷冻干燥。将冷冻干燥后的样品放在样品台上,样品表面喷金,扫描电子显微镜下观察样品微观结构。
1.4 数据处理
实验均重复3 次,结果以平均值±标准差表示。通过Microsoft Excel 2010软件计算平均值及标准差,Statistix 8.1软件(美国Statistical Analysis System公司)进行数据显著性差异分析(显著水平为P<0.05),使用Origin 2021软件(美国OriginLab公司)绘图。
2 结果与分析
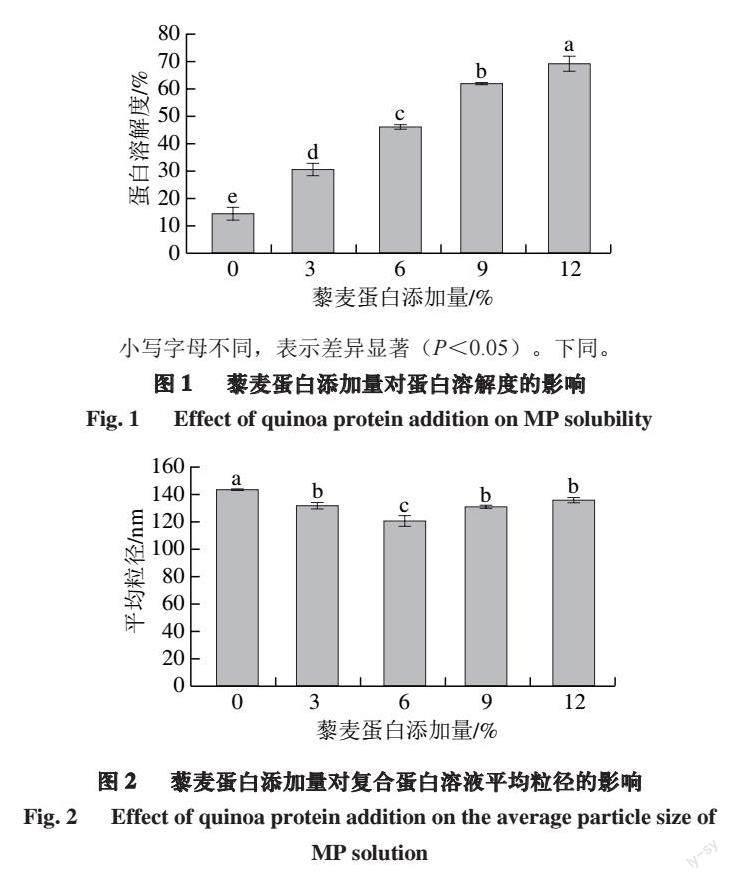
2.1 藜麦蛋白添加量对蛋白溶解度的影响
蛋白溶解度是蛋白非常重要的理化特性之一,直接影响蛋白的稳定、乳化、凝胶等功能性质,蛋白质的功能特性只有在蛋白质处于较高溶解状态下才能表现[24]。由图1可知,对照组的蛋白溶解度为14.09%,随着藜麦蛋白的添加,蛋白溶解度呈显著上升的趋势(P<0.05)。当藜麦蛋白添加量为12%,蛋白溶解度升至最高值69.41%。藜麦蛋白为水溶性蛋白,主要由清蛋白和球蛋白组成,醇溶蛋白和谷蛋白含量较低,故溶解性比一般谷物蛋白的溶解性要高[25],所以随着藜麦蛋白添加量的增多,复合溶液的蛋白溶解度显著增大(P<0.05)。
2.2 藜麦蛋白添加量对复合蛋白溶液粒径的影响
复合蛋白溶液中分散相中的微粒大小和粒径分布会影响溶液的稳定性和功能特性,是评价蛋白質聚集程度的重要指标[26]。由图2可知,对照组的平均粒径为143.97 nm,藜麦蛋白的添加降低了复合蛋白溶液的平均粒径。这是由于藜麦蛋白是植物蛋白,本身具有较小的粒径,加入之后可以降低复合溶液的平均粒径,从而使MP溶液体系分散更加均匀,特别是当藜麦蛋白添加量为6%时,复合蛋白溶液平均粒径达到最小值121.17 nm。但是当藜麦蛋白添加量大于6%时,复合蛋白溶液平均粒径呈现增大的趋势,这可能是因为添加过量的藜麦蛋白提高了蛋白浓度,高浓度的蛋白分子碰撞几率变大,促进蛋白聚集,从而增大了蛋白粒径[27]。
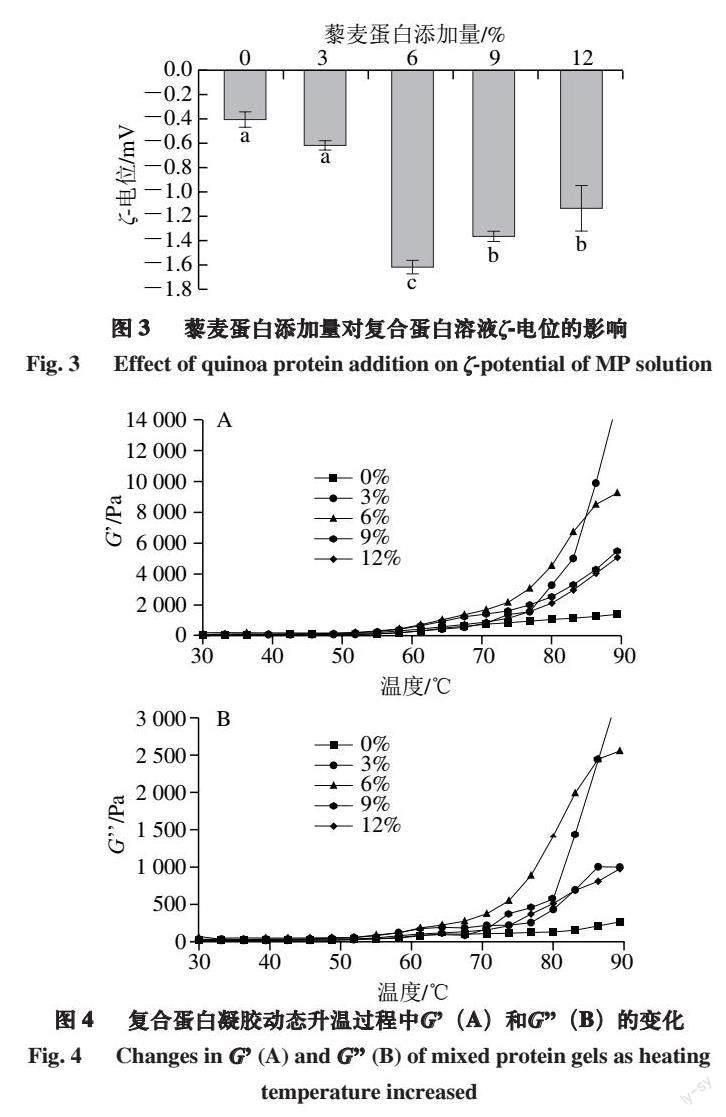
2.3 藜麦蛋白添加量对复合蛋白溶液ζ-电位的影响
一般来说,ζ-电位代表蛋白质表面的电荷,可以描述蛋白质之间的静电相互作用。当ζ-电位的绝对值较高时,有利于蛋白质分散,当ζ-电位的绝对值较低时,蛋白质会发生聚集[28]。由图3可知,所有组ζ-电位值均为负值,说明体系的颗粒表面带有负电荷。对照组ζ-电位绝对值为0.411 mV,藜麦蛋白添加组的ζ-电位绝对值则提高到0.623~1.623 mV,这可能是由于藜麦蛋白中谷氨酸和天冬氨酸所携带的羧基基团增加了体系中的负电荷数量。Shen Yanting等[29]的研究也表明,藜麦分离蛋白可以改变电荷分布。特别是藜麦蛋白添加量为6%时,ζ-电位绝对值达到最大且比对照组增加1.212 mV,这时混合体系中负电荷数量达到最大值,由于同性电荷相互排斥,使得颗粒之间不易发生相互靠近,蛋白质发生絮凝的几率减小,进而增加了溶液的物理稳定性。藜麦蛋白添加量大于6%时,ζ-电位绝对值下降,这可能是因为过量的藜麦蛋白聚集产生的静电屏蔽作用[30]。
2.4 藜麦蛋白添加量对复合凝胶动态流变特性的影响
储能模量(G)可以用来反映MP复合凝胶形成过程中的凝胶强度,一般G越大,弹性越好,也就越有利于凝胶的形成。损耗模量(G)也称为黏性模量,反映样品的黏性特征[31]。由图4可知,G和G的变化趋势基本一致。在50 ℃以前,G和G基本保持不变,这一阶段是蛋白溶液受热形成凝胶的初始阶段,主要由肌球蛋白的运动和聚集产生,因为运动较弱,不足以使G和G发生改变[32]。50~70 ℃,G和G缓慢上升。当加热温度高于70 ℃时,G和G呈现出较为明显的上升趋势。50 ℃是肌球蛋白的变性温度[33],当加热温度超过50 ℃时,肌球蛋白部分结构展开,蛋白之间发生相互作用,开始形成凝胶网络结构。当加热温度超过70 ℃时,蛋白受热变性,结构发生变化,促进了疏水键、二硫键等化学键的形成,使得G和G迅速增大,G和G的提高有利于加强蛋白质的凝胶网络结构,从而促进MP内部三维凝胶基质的形成[34]。添加藜麦蛋白后复合蛋白溶液的G和G均大于对照组,且当藜麦蛋白添加量为6%时,G和G均达到最大值。这是因为在热诱导凝胶过程中,藜麦蛋白变性使结构展开,增强了与MP之间的交联程度,形成的凝胶网状结构更充分[35],从而产生更大的黏弹性。
2.5 藜麦蛋白添加量对复合凝胶保水性的影响
凝胶保水性是指凝胶受到外力作用时能保持原有水分和添加水分的能力,可以反映蛋白质与水之间的相互作用,是评价凝胶品质的重要指标[36]。由图5可知,对照组凝胶的保水性为57.57%,添加藜麦蛋白后,复合凝胶的保水性升高至65.98%~70.51%,这可能是因为藜麦蛋白自身具有较好的吸湿性,且藜麦蛋白与MP发生交联形成稳定的网状结构,使更多的水分子可以进入到凝胶的三维空间结构中,因此导致复合凝胶的保水性增加[37]。徐祖东等[38]也报道藜麦可以增加鲷鱼鱼糜凝胶的持水力。当藜麦蛋白添加量为3%~9%时,复合凝胶的保水性随藜麦蛋白添加量的增加而增加,并在添加量为9%时达到峰值70.51%,但是当藜麦蛋白添加量为12%时,复合凝胶保水性略有下降。这可能是因为过量的藜麦蛋白使得蛋白质分子间发生过度交联,蛋白质发生聚沉,导致水合能力下降[39]。
2.6 藜麦蛋白添加量对复合蛋白凝胶强度的影响
凝胶强度是破断力和破断距离的乘积,是MP凝胶的重要参数,关系到肉制品的品质[40]。由图6可知,对照组凝胶强度为6.936 2 g·mm,添加3%~12%藜麦蛋白时,复合凝胶强度显著高于对照组(P<0.05),且在藜麦蛋白添加量为9%时凝胶强度达到最大值13.596 6 g·mm,与对照组相比,凝胶强度增加96.02%。凝胶强度提高的原因可以从两方面解释:一是藜麦蛋白本身具有较好的凝胶性,且它的凝胶强度高于其他植物蛋白[25],因此在香肠的生产中也常常利用这种性质来提升产品的质构特性;二是在二段加热处理过程中,藜麦蛋白与MP分子产生交联,形成了更为稳定的三维凝胶网状结构,从而改善了MP的凝胶特性[41]。Alakhrash等[42]也报道了燕麦蛋白等植物蛋白可以提高MP的凝胶强度。
2.7 藜麥蛋白添加量对复合凝胶W的影响
W是评价凝胶类肉制品色泽的指标。由图7可知,对照组的W为71.64,添加藜麦蛋白后,复合凝胶的W下降为65.63~69.25。复合凝胶W降低是因为藜麦蛋白自身呈黄褐色,添加到猪肉MP中使得制成的凝胶W下降。但是整体来看,除藜麦蛋白添加量为3%和12%外,6%和9%的添加量使复合凝胶的W维持在68.74~69.25,与对照组W相差较小,在可接受的范围内。
2.8 藜麦蛋白添加量对复合凝胶化学作用力的影响
凝胶是蛋白质经过热处理使结构充分展开导致内部的巯基和疏水基团暴露,从而促进氢键和二硫键等化学作用力的产生而形成的。由图8可知,对照组中离子键、氢键、疏水相互作用和二硫键含量分别为0.301 9、0.220 3、3.247 4、1.909 3 g/L,MP凝胶的形成是通过离子键、氢键、疏水相互作用和二硫键等化学作用力共同维持的,其中疏水相互作用和二硫键含量最高,为主导作用力。翟璐等[43]研究也认为,疏水相互作用和二硫键是维持鱼糜凝胶网状结构的主要作用力。添加藜麦蛋白后,复合凝胶化学作用力发生变化,其中离子键和氢键的含量增加且与藜麦蛋白添加量呈正相关,当藜麦蛋白添加量为12%时,氢键(0.677 2 g/L)和离子键含量(0.922 0 g/L)达到最高值。通过氢键和离子键作用使藜麦蛋白-MP的结合更加紧密,从而使复合蛋白具有较好的凝胶性。Song Mengkun等[44]的研究证实了小麦蛋白和荞麦蛋白之间通过氢键使多肽链的排列更加紧密。Niu Haili等[45]研究也认为,大豆蛋白等植物蛋白可以为周围水分子提供更多的氢键结合位点,从而使复合蛋白中的氢键含量增多,蛋白质之间的交联程度增大,复合蛋白的保水性增强。Gao Xia等[46]认为,离子键虽然不是蛋白质折叠的主要化学作用力,但是在蛋白质的稳定性方面起到了重要作用。藜麦蛋白中含有丰富的赖氨酸等极性氨基酸[25],与加热过程中MP内部暴露的功能基团形成离子键,随着藜麦蛋白含量的增多,离子键含量持续增加[47]。
复合MP凝胶体系中疏水相互作用力和二硫键的变化与离子键和氢键有所不同。当藜麦蛋白添加量为3%时,疏水相互作用和二硫键含量上升,这可能是因为藜麦蛋白富含半胱氨酸[48],在加热过程中,藜麦蛋白受热导致结构打开,致使半胱氨酸侧链中的疏水键和巯基更多地暴露在环境中,促进了疏水作用力和二硫键的形成[49]。但是当藜麦蛋白添加量大于3%时,二者含量低于对照组。
2.9 藜麦蛋白添加量对复合凝胶蛋白质二级结构的影响
二级结构是蛋白质形成空间结构的基础,利用傅里叶红外光谱研究蛋白质的二级结构变化,发现蛋白质二级结构呈现在1 600~1 700 cm-1的范围内,其中1 600~1 640、1 640~1 650、1 650~1 660、1 660~1 700 cm-1分别归属于β-折叠、无规则卷曲、α-螺旋和β-转角结构[50]。由傅里叶变换红外图谱计算出各组蛋白中二级结构相对含量的变化。
由表1可知,对照组的β-折叠、无规则卷曲、α-螺旋和β-转角结构相对含量分别为32.54%、24.53%、21.19%、21.74%。与对照组相比,添加藜麦蛋白后蛋白质的二级结构虽无显著变化(P<0.05),但仍旧表现为β-折叠和α-螺旋相对含量增多,无规则卷曲和β-转角相对含量下降,这说明藜麦蛋白的添加会促使无规则卷曲结构向β-折叠和α-螺旋结构转化。通常认为α-螺旋与β-折叠是属于相对有序的空间结构,而β-转角和无规则卷曲被认为是相对无序的空间结构[51]。β-折叠和α-螺旋结构的增多有利于高温诱导蛋白质相互交联,从而提升凝胶强度[52]。藜麦蛋白添加量为3%~9%时,复合凝胶中β-折叠和α-螺旋相对含量均大于对照组,因此凝胶强度得到加强,这与文中凝胶强度的测定结果相一致。Li Yan等[53]的研究也表明,β-折叠和α-螺旋含量的增多会使MP凝胶强度增强。
2.10 复合凝胶扫描电镜图
由图9可知,对照组微观结构较为粗糙,出现大小不一的孔隙。藜麦蛋白的添加使复合凝胶整体结构变得致密,粗糙度降低,呈现较为光滑的表面,这说明藜麦蛋白提高了凝胶强度,改善了MP凝胶的网状结构。凝胶受热过程中,MP变性导致水分流失,形成了对照组中可观察到的孔隙。而藜麦蛋白与MP混合以后,经过受热作用形成网状凝胶,藜麦蛋白填充在MP受热形成的三维网格结构中[54],并依靠氢键和离子键等的作用进一步提高对凝胶中水分子的吸附能力,不仅增加了保水性,使水分不易流出,同时也使凝胶结构变得更加致密、平滑。
3 结 论
本研究在低盐MP溶液体系中分别添加3%、6%、9%和12%的藜麦蛋白,考察藜麦蛋白对MP凝胶特性的影响,研究发现,在MP中添加的藜麦蛋白和MP产生相互作用,增加了复合体系中的氢键和离子键,使复合溶液的蛋白溶解度和ζ-电位绝对值增加,蛋白粒径下降,促使无规则卷曲向β-折叠和α-螺旋转化,蛋白结构更为稳定,从而提高了MP复合凝胶的保水性、凝胶强度和流变特性。综上,本研究通过钠盐替代和藜麦蛋白的添加可以在降低钠盐含量的基础上同时保证凝胶类肉制品有较好凝胶特性,为高品质凝胶类肉制品的生产提供了参考依据。但是本研究仅在藜麦蛋白和MP复合溶液/凝胶体系中研究了低钠盐模式下藜麦蛋白与MP之间的相互作用,关于加工方式对复合蛋白体系凝胶特性的影响及分子水平上二者相互作用的机制有待进一步研究。
参考文献:
[1] 李诗义, 诸晓旭, 陈从贵, 等. 肉和肉制品的营养价值及致癌风险研究进展[J]. 肉类研究, 2015, 29(12): 41-47. DOI:10.15922/j.cnki.rlyj.2015.12.008.
[2] ALINO M, GRAU R, BAIGTS D, et al. Influence of sodium replacement on the salting kinetics of pork loin[J]. Journal of Food Engineering, 2009, 95(4): 551-557. DOI:10.1016/j.jfoodeng.2009.06.016.
[3] 陈旭, 陈惠敏, 伍久林, 等. 基于人体必需金属盐替代的低钠盐肌原纤维蛋白凝胶特性和作用机理[J]. 食品科学, 2023, 44(6): 25-33. DOI:10.7506/spkx1002-6630-20220914-117.
[4] 李可, 王艳秋, 张怡雪, 等. 低钠条件下超声处理对鸡肉肌原纤维蛋白的乳液稳定性影响[J/OL]. 食品科学: 1-14[2023-01-18]. http://kns.cnki.net/kcms/detail/11.2206.TS.20220613.1241.135.html.
[5] MI Hong, SU Qing, CHEN Jingxin, et al. Starch-fatty acid complexes improve the gel properties and enhance the fatty acid content of Nemipterus virgatus surimi under high-temperature treatment[J]. Food Chemistry, 2021, 362: 130253. DOI:10.1016/j.foodchem.2021.130253.
[6] DIAZDA J L, RODRGUEZ-ROMER A, HEMNDEZ-SANTOYO A, et al. Effects of soy glycinin addition on the conformation and gel strength of two pork myosin types[J]. Journal of Food Science, 2003, 68(9): 2724-2729. DOI:10.1111/j.1365-2621.2003.tb05795.x.
[7] BORDER?AS A J, TOVAR C A, DOM?NGUEZ-TIM?N F, et al. Characterization of healthier mixed surimi gels obtained through partial substitution of myofibrillar proteins by pea protein isolates[J]. Food Hydrocolloids, 2020, 107: 105976. DOI:10.1016/j.foodhyd.2020.105976.
[8] QIN Xinsheng, LUO Zhigang, PENG Xichun. Fabrication and characterization of quinoa protein nanoparticle-stabilized food-grade Pickering emulsions with ultrasound treatment: interfacial adsorption/arrangement properties[J]. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4449-4457. DOI:10.1021/acs.jafc.8b00225.
[9] OGUNGBENLE H N. Nutritional evaluation and functional properties of quinoa, flour[J]. International Journal of Food Sciences and Nutrition, 2009, 54(2): 153-158. DOI:10.1080/0963748031000084106.
[10] 朱瑩莹, 安双双, 王雷, 等. 不同热处理对藜麦蛋白质营养品质的影响[J]. 中国粮油学报, 2022, 37(6): 75-82.
[11] ZHU Y Q, MCCLEMENTS D J, ZHOU W, et al.. Influence of ionic strength and thermal pretreatment on the freeze-thaw stability of Pickering emulsion gels[J]. Food Chemistry, 2020, 303: 125401. DOI:10.1016/j.foodchem.2019.125401.
[12] CEN Kaiyue, XI Yu, GAO Chengcheng, et al. Effects of quinoa protein Pickering emulsion on the properties, structure and intermolecular interactions of myofibrillar protein gel[J]. Food Chemistry, 2022, 394: 133456. DOI:10.1016/j.foodhyd.2022.133456.
[13] HU Jingrong, FENG Cuiping, ZHUYingchun, et al. Effect of partial substitution of NaCl by KCl, CaCl2, and MgCl2 on properties of mixed gelation from myofibrillar protein and Flammulina velutipes protein[J]. Journal of Food Processing and Preservation, 2022, 46(5): e16525. DOI:10.1111/jfpp.16525.
[14] ZHOU Lei, ZHANG Jian, LORENZO J M, et al. Effects of ultrasound emulsification on the properties of pork myofibrillar protein-fat mixed gel[J]. Food Chemistry, 2021, 345: 128751. DOI:10.1016/j.foodchem.2020.128751.
[15] BENJAKUL S, BAHER F. Physicochmical and enzymatic changes of Cod muscle proteins subjected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150. DOI:10.1002/1097-0010(200006)80:83.0.CO;2-C.
[16] SHEN Lan, TANG Chuanhe. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118. DOI:10.1016/j.foodres.2012.03.006.
[17] ZHAO Yinyu, ZHOU Guanghong, ZHANG Wangang. Effects of regenerated cellulose fiber on the characteristics of myofibrillar protein gels[J]. Carbohydrate Polymers, 2019, 209: 276-281. DOI:10.1016/j.carbpol.2019.01.042.
[18] LIN Duanquan, ZHANG Longtao, LI Runjing, et al. Effect of plant protein mixtures on the microstructure and rheological properties of myofibrillar protein gel derived from red sea bream (Pagrosomus major)[J]. Food Hydrocolloids, 2019, 96: 537-545. DOI:10.1016/j.foodhyd.2019.05.043.
[19] S?NCHEZ-GONZ?LEZ I, CARMONA P, MORENO P, et al. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J]. Food Chemistry, 2008, 106(1): 56-64. DOI:10.1016/j.foodchem.2007.05.067.
[20] ZHOU Lei, FENG Xiao, YANG Yuling, et al. Effects of high-speed shear homogenization on properties and structure of the chicken myofibrillar protein and low-fat mixed gel[J]. LWT-Food Science and Technology, 2019, 110: 19-24. DOI:10.1016/j.lwt.2019.04.061.
[21] JIANG Jiang, XIONG Youling. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2013, 93(3): 469-476. DOI:10.1016/j.meatsci.2012.11.002.
[22] NIAN Linyu, CAO Ailing, CAI Luyun, et al. Effect of vacuum impregnation of red sea bream (Pagrosomus major) with herring AFP combined with CS@Fe3O4 nanoparticles during freeze-thaw cycles[J]. Food Chemistry, 2019, 291: 139-148. DOI:10.1016/j.foodchem.2019.04.017.
[23] GUO Yalong, HU Hui, WANG Qiang, et al. A novel process for peanut tofu gel: its texture, microstructure and protein behavioral changes affected by processing conditions[J]. LWT-Food Science and Technology, 2018, 96: 140-146. DOI:10.1016/j.lwt.2018.05.020.
[24] 吴佳, 赵鸾, 魏娜, 等. 动态高压微射流处理对低盐肌原纤维蛋白溶解度和结构的影响[J]. 食品与发酵工业, 2022, 48(11): 129-135.
[25] 吉静筠, 李洪岩, 王静. 藜麦蛋白功能特性研究进展[J]. 中国食品学报, 2021, 21(11): 368-376. DOI:10.16429/j.1009-7848.2021.11.040.
[26] SA?LAM D, VENEMA P, DE VRIES R, et al. Concentrated whey protein particle dispersions: heat stability and rheological properties[J]. Food Hydrocolloids, 2013, 30(1): 100-109. DOI:10.1016/j.foodhyd.2012.05.005.
[27] WOLZ M, KULOZIK U. Thermal denaturation kinetics of whey proteins at high protein concentrations[J]. International Dairy Journal, 2015, 49: 95-101. DOI:10.1016/j.idairyj.2015.05.008.
[28] ADJONU R, DORAN G, TORLEY P, et al. Whey protein peptides as components of nanoemulsions: a review of emulsifying and biological functionalities[J]. Journal of Food Engineering, 2014, 122: 15-27. DOI:10.1016/j.jfoodeng.2013.08.034.
[29] SHEN Yanting, TANG Xiao, LI Yonghui. Drying methods affect physicochemical and functional properties of quinoa protein isolate[J]. Food Chemistry, 2020, 339(10): 127823. DOI:10.1016/j.foodchem.2020.127823.
[30] QIN Xinsheng, LUO Zhigang, PENG Xichun, et al. Fabrication and characterization of quinoa protein nanoparticle-stabilized food-grade pickering emulsions with ultrasound treatment: effect of ionic strength on the freeze-thaw stability[J]. Journal of Agricultural and Food Chemistry, 2018, 66(31): 8363-8370. DOI:10.1021/acs.jafc.8b02407.
[31] 劉旺, 冯美琴, 孙健, 等. 超高压条件下亚麻籽胶对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2019, 40(7): 101-107. DOI:10.7506/spkx1002-6630-20181130-348.
[32] KIM H W, LEE Y J, KIM Y H B. Effects of membrane-filtered soy hull pectin and pre-emulsified fiber/oil on chemical and technological properties of low fat and low salt meat emulsions[J]. Journal of Food Science and Technology, 2016, 53(6): 2580-2588. DOI:10.1007/s13197-016-2221-0.
[33] 王立健, 罗程, 潘雪峰, 等. 纤维素替代淀粉对肌原纤维蛋白凝胶特性的影响[J]. 中国农业科学, 2022, 55(11): 2227-2238.
[34] WU Fan, SHI Xxiaojie, ZOU Henan, et al. Effects of high-pressure homogenization on physicochemical, rheological and emulsifying properties of myofibrillar protein[J]. Journal of Food Engineering, 2019, 263: 272-279. DOI:10.1016/j.jfoodeng.2019.07.009.
[35] ZHUANG Xinbo, JIANG Xiping, HAN Minyi, et al. Influence of sugarcane dietary fiber on water states and microstructure of myofibrillar, protein gels[J]. Food Hydrocolloids, 2016, 57: 253-261. DOI:10.1016/j.foodhyd.2016.01.029.
[36] 杨明柳, 周迎芹, 方旭波, 等. 谷氨酰胺转氨酶对鳜鱼鱼糜凝胶的品质影响[J]. 食品科学, 2021, 42(12): 37-44. DOI:10.7506/spkx1002-6630-20201009-055.
[37] 夏秀芳, 李芳菲, 田佳藝, 等. 低温冻藏对肌原纤维蛋白凝胶特性的影响[J]. 中国食品学报, 2019, 19(1): 163-170. DOI:10.16429/j.1009-7848.2019.01.022.
[38] 徐祖东, 陈康, 涂丹, 等. 藜麦对鲷鱼鱼糜凝胶性能及挥发性风味的影响[J]. 中国食品学报, 2020, 20(2): 212-220. DOI:10.16429/j.1009-7848.2020.02.026.
[39] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70. DOI:10.1016/j.foodchem.2008.07.039.
[40] WALAYAT N, XIONG Zhouyi, XIONG Hanguo, et al. The effect of egg white protein and β-cyclodextrin mixture on structural and functional properties of silver carp myofibrillar proteins during frozen storage[J]. LWT-Food Science and Technology, 2021, 135: 109975. DOI:10.1016/j.lwt.2020.109975.
[41] LI Yan, WANG Qiumin, GUO Liping, et al. Effects of ultrafine comminution treatment on gelling properties of myofibrillar proteins from chicken breast[J]. Food Hydrocolloids, 2019, 97: 105199. DOI:10.1016/j.foodhyd.2019.105199.
[42] ALAKHRASH F, ANYANWU U, TAHERGORABI R. Physicochemical properties of Alaska pollock (Theragra chalcograma) surimi gels with oat bran[J]. LWT-Food Science and Technology, 2016, 66(3): 41-47. DOI:10.1016/j.lwt.2015.10.015.
[43] 翟璐, 陈康, 金仁耀, 等. 乙酯型鱼油对鱼糜制品理化特性和风味的影响[J]. 中国食品学报, 2022, 22(3): 159-168. DOI:10.16429/j.1009-7848.2022.03.019.
[44] SONG Mengkun, GUO Xiaona, ZHU Kexue. Insights into heat-induced molecular-level interactions between wheat and common buckwheat proteins[J]. Food Chemistry, 2023, 404: 134730. DOI:10.1016/j.foodchem.2022.134730.
[45] NIU Haili, XIA Xiufang, WANG Chao, et al. Thermal stability and gel quality of myofibrillar protein as affected by soy protein isolates subjected to an acidic pH and mild heating[J]. Food Chemistry, 2017, 242: 188195. DOI:10.1016/j.foodchem.2017.09.055.
[46] GAO Xia, XIE Yaru, YIN Tao, et al. Effect of high intensity ultrasound on gelation properties of silver carp surimi with different salt contents[J]. Ultrasonics Sonochemistry, 2021, 70: 105326. DOI:10.1016/j.ultsonch.2020.105326.
[47] CHEN Jingxin, DENG Tingyue, WANG Cong, et al. Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J]. Journal of the Science of Food and Agriculture, 2020, 100(5): 2252-2260. DOI:10.1002/jsfa.10254.
[48] 朱莹莹, 安双双, 王雷, 等. 不同热处理对藜麦蛋白质营养品质的影响[J]. 中国粮油学报, 2022, 37(6): 75-82.
[49] LU Weiwei, WU Di, WANG Limei, et al. Insoluble dietary fibers from Lentinus edodes stipes improve the gel properties of pork myofibrillar protein: a water distribution, microstructure and intermolecular interactions study[J]. Food Chemistry, 2023, 411: 135386. DOI:10.1016/j.foodchem.2023.135386.
[50] XU Yujuan, DONG Ming, TANG Changbo, et al. Glycation-induced structural modification of myofibrillar protein and its relation to emulsifying properties[J]. LWT-Food Science and Technology, 2020, 117: 108664. DOI:10.1016/j.lwt.2019.108664.
[51] 陶健, 蒋炜丽, 丁太春, 等. 基于水平衰减全反射傅里叶变换红外光谱的食品中反式脂肪酸的测定[J]. 中国食品学报, 2011, 11(8): 154-158. DOI:10.16429/j.1009-7848.2011.08.006.
[52] 张志衡, 陈振家, 李玉娥, 等. 不同酸浆添加量制备的豆腐凝胶特性比较[J]. 现代食品科技, 2022, 38(4): 161-170. DOI:10.13982/j.mfst.1673-9078.2022.4.0924.
[53] LI Yan, WANG Qiumin, GUO Liping, et al. Effects of ultrafine comminution treatment on gelling properties of myofibrillar proteins from chicken breast[J]. Food Hydrocolloids, 2019, 97: 105199. DOI:10.1016/j.foodhyd.2019.105199.
[54] SCHMITT C, TURGEON S L. Protein/polysaccharide complexes and coacervates in food systems[J]. Advances in Colloid and Interface Science, 2011, 167(1/2): 63-70. DOI:10.1016/j.cis.2010.10.001.

