毛蕊异黄酮通过调节线粒体通路抑制胃癌AGS细胞的增殖、迁移和侵袭
李倩慧, 平仙娥
(上海市嘉定区安亭医院,上海 201805)
胃癌在世界范围内被列为第5位最常见的癌症和第3 位最致命的疾病[1]。尽管过去几十年在胃癌治疗方面取得了重大进展,但胃癌患者的存活率仍然很低[2-5]。中药在治疗癌症方面取得了很大进展[6-9]。黄芪为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.)Bge. var.mongholicus(Bge.)Hsiao 或膜荚黄芪Astragalus membranaceus(Fisch.)Bge.的干燥根,味甘,性微温,归肺、脾经,具有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌的功效,用于气虚乏力、食少便溏、中气下陷、久泻脱肛、便血崩漏、表虚自汗、气虚水肿、内热消渴、血虚萎黄、痹痛麻木、痈疽难溃、久溃不敛等病症。黄芪已被证明在治疗胃癌方面具有一定的疗效[10]。毛蕊异黄酮(calycosin,Caly)是黄芪干燥根中的一种脂溶性成分,具有抗氧化、抗炎和抗癌特性[11-12]。既往研究报道,毛蕊异黄酮对结直肠癌[13]、胰腺癌[14]、肝癌[15]等具有抑制作用。有研究发现,毛蕊异黄酮可诱导胃癌细胞系AGS凋亡[16]。基于此,本研究旨在探索毛蕊异黄酮对胃癌细胞AGS 增殖、迁移和侵袭的调控机制,以期为临床上胃癌的治疗提供新的思路,现将研究结果报道如下。
1 材料与方法
1.1 细胞人胃癌细胞系AGS,购自美国ATCC中心。
1.2 药物、试剂与仪器毛蕊异黄酮(分子量284.26,分子式为C16H12O5),美国MedChemExpress公司生产,批号为20575-57-9,使用DMSO 作为溶剂;MHY1485 哺乳动物[雷帕霉素靶蛋白(mTOR)激活剂],美国MedChemExpress 公司生产。DMEM 培养基(美国Gibco公司);四甲基偶氮唑盐(MTT)液(美国Sigma 公司);JC-1 荧光探针(美国Abcam公司);Beclin-1(1∶2 000,52 kDa),LC3Ⅰ、LC3Ⅱ(1∶2 000,16、14 kDa),p-mTOR(1∶2 000,289 kDa),GAPDH(1∶500,37 kDa)等抗体及辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1∶5 000)(美国Abcam公司)。Transwell小室(美国Thermo Fisher Scientific 公司);TE-2000 荧光显微镜(日本Nikon公司)。
1.3 细胞培养及处理AGS 细胞以含10%胎牛血清(FBS)和1%抗生素溶液的DMEM 培养基,于5%CO237 ℃培养箱中培养,2 ~3 d 后更换1 次营养培养基,使用胰蛋白酶-EDTA 溶液进行细胞传代以获得75%~80%的融合度。
1.4 细胞分组细胞分组如下:AGS 组(空白对照组),未进行任何处理,正常培养的AGS 细胞;AGS+Caly组(实验治疗组),将50 μmol/L毛蕊异黄酮[16]加入培养基,孵育24 h;AGS+DMSO 组(阴性对照组),使用相同剂量的DMSO 加入细胞培养基,孵育24 h;AGS+Caly+MHY1485组(MHY1485处理组),将50 μmol/L 毛蕊异黄酮及5 μmol/L MHY1485[17]加入细胞培养基,孵育24 h; AGS+Caly+DMSO组(MHY1485阴性对照组),将50 μmol/L毛蕊异黄酮及相同剂量的DMSO 加入细胞培养基,孵育24 h。
1.5 观察指标与方法
1.5.1 MTT分析 将人胃癌AGS细胞均匀接种于96 孔培养板中,每孔细胞数为3 000 ~4 000 个。将各组AGS 细胞分别培养24、48、72 h 后,每孔加20 μL MTT 液继续于37 ℃5%CO2培养箱中孵育4 h,终止培养,弃去培养液。每孔再加入DMSO 150 μL,轻匀摇动10 min,促进结晶溶解。在酶联免疫检测仪上于495 nm 波长处测定各孔的吸光度(OD)值,分析细胞增殖能力。
1.5.2 Transwell 迁移及侵袭实验 Transwell 小室放入24 孔板中,下室加入500 μL 含20%FBS 的培养基。胰酶消化处于对数生长期的细胞,PBS或无血清的培养基洗3次后,重悬细胞,计数,并将细胞浓度调为2×105个/μL,吹打混匀后取500 μL 加入Transwell 小室的上室。注意小室上下室之间不要有气泡。把24 孔板放入细胞培养箱中继续培养。20 h后,取出Transwell小室,吸干上室液PBS洗一遍,移到预先加入约800 μL 甲醇或多聚甲醛的孔中,室温固定30 min。30 min后,用PBS清洗2 遍小室,加入800 μL 结晶紫染液室温避光染色15 ~30 min。染完色后,用双蒸水轻轻洗涤浸泡数次,直至把染色液的颜色洗去。吸弃上室液体,用湿棉棒小心擦干净上室底部膜表面上的细胞。显微镜下拍照,在20倍镜下随机选择10个视野拍照并计数每张照片中的细胞,取平均数来做统计分析。侵袭实验中需预先用基质胶包被小室上室,其余步骤同迁移实验。
1.5.3 线粒体膜电位(MMP)测定 使用JC-1 荧光探针测量细胞的MMP。将细胞与5 μmol/L JC-1于37 ℃暗室中孵育30 min,PBS 洗涤后,应用荧光显微镜检测细胞图像。
1.5.4 Western Blot法检测细胞Beclin-1、LC3Ⅰ、LC3Ⅱ、p-mTOR 表达 待测细胞以预冷的PBS 缓冲液冲洗3 次后加入RIPA 裂解液中裂解,以12 000g离心10 min,吸取上清用BCA法测定蛋白浓度。电泳先用60 V,待进入分离胶后改用120 V。电泳结束后,用电转移法将蛋白质转移到聚偏氟乙烯(PVDF)膜上。取PVDF 膜,5%脱脂牛奶-TBST 封闭,室温下孵育1 ~2 h。封闭结束后,将膜置于孵育盒中,分别加入一抗Beclin-1、LC3Ⅰ、LC3Ⅱ、p-mTOR和GAPDH,4 ℃孵育过夜,TBST洗3 次,每次10 min;加入HRP 标记的山羊抗兔IgG,室温孵育1 h,TBST洗3次,每次10 min。进行化学发光,X 光片压片、显影、定影,数据分析。内参为GAPDH。
1.6 统计方法采用SPSS 21.0(IBM,Armonk,NY,USA)软件和GraphPad Prism 8.0.1(La Jolla,CA,USA)软件进行数据统计学分析及作图。计量结果以均数±标准差(x±s)表示,2组之间的比较采用独立样本t检验,多组之间的比较采用单因素方差(One-way analysis of variance)检验,事后检验采用Tukey’s多重比较检验进行组间差异分析。以P<0.05为差异有统计学意义。
2 结果
2.1 毛蕊异黄酮抑制AGS 细胞增殖、迁移和侵袭本研究中选取50 μmol/L 毛蕊异黄酮对AGS细胞进行处理。MTT 法检测细胞增殖,结果显示,毛蕊异黄酮具有显著下调AGS 细胞增殖能力(P<0.01)。见图1-A。Transwell 实验结果显示,毛蕊异黄酮显著下调AGS 细胞迁移细胞数、侵袭细胞数(P<0.01 或P<0.001)。见图1-B。以上结果表明,毛蕊异黄酮可抑制AGS 细胞增殖、迁移和侵袭。
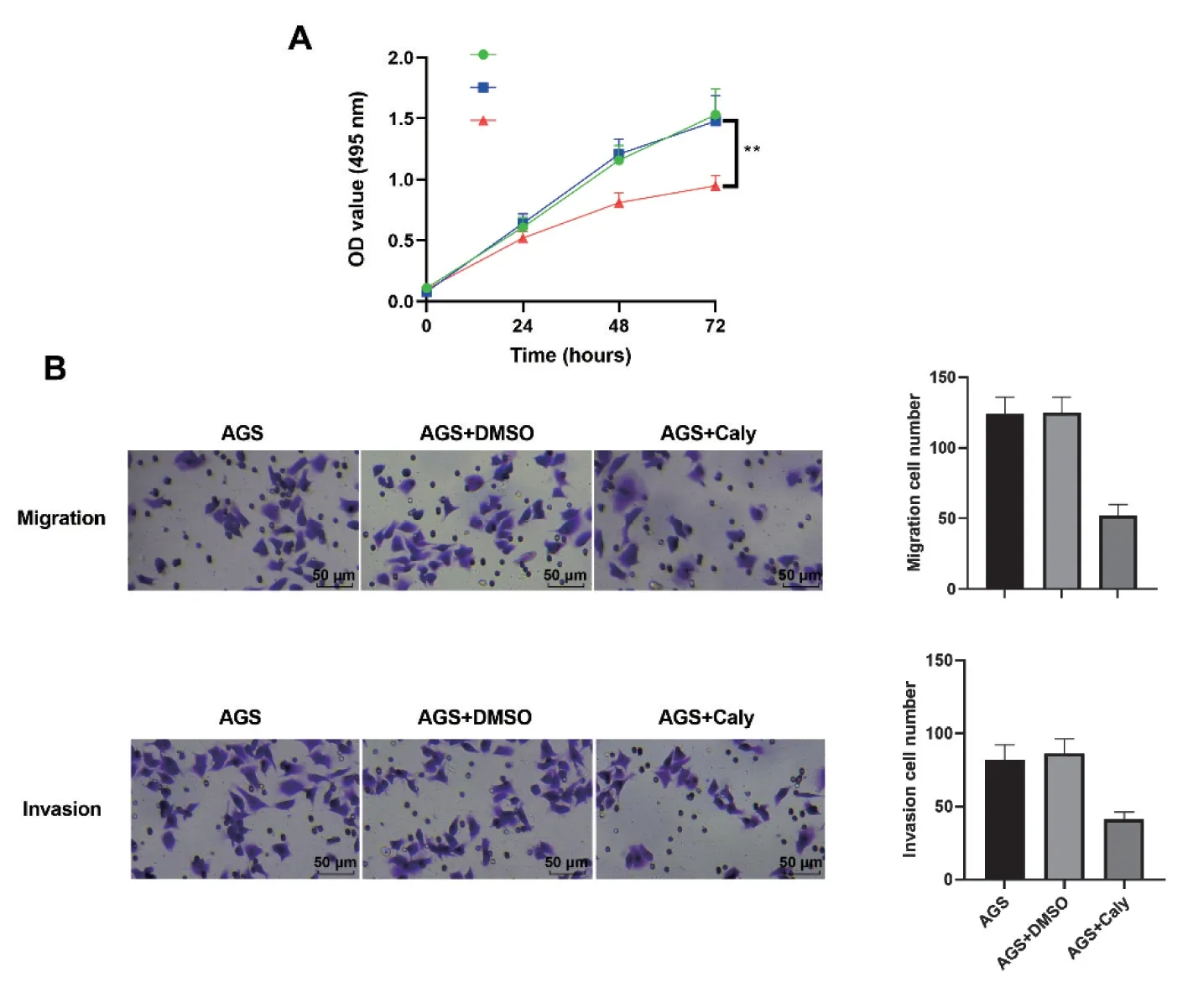
图1 毛蕊异黄酮(Caly)抑制AGS细胞增殖、迁移和侵袭Figure 1 Calycosin inhibited proliferation,migration and invasion of AGS cells
2.2 毛蕊异黄酮改善AGS细胞线粒体功能线粒体功能和结构的稳定性直接影响肿瘤细胞的能量供应[18]。采用JC-1 法检测线粒体膜电位(MMP),结果可见,JC-1 红色荧光强度在毛蕊异黄酮的处理后显著上升,而绿色荧光强度显著下降,同时显示毛蕊异黄酮能显著提升AGS 细胞线粒体膜电位(P<0.001)。见图2。表明毛蕊异黄酮可改善AGS细胞线粒体功能。
2.3 毛蕊异黄酮诱导AGS细胞自噬通过Western Blot 法检测自噬相关蛋白LC3-Ⅰ、LC3-Ⅱ、Beclin-1的结果显示,毛蕊异黄酮能显著提升AGS细胞LC3-Ⅱ/LC3-Ⅰ比值及Beclin-1 表达水平(均P<0.01)。见图3。表明毛蕊异黄酮可诱导AGS 细胞自噬。
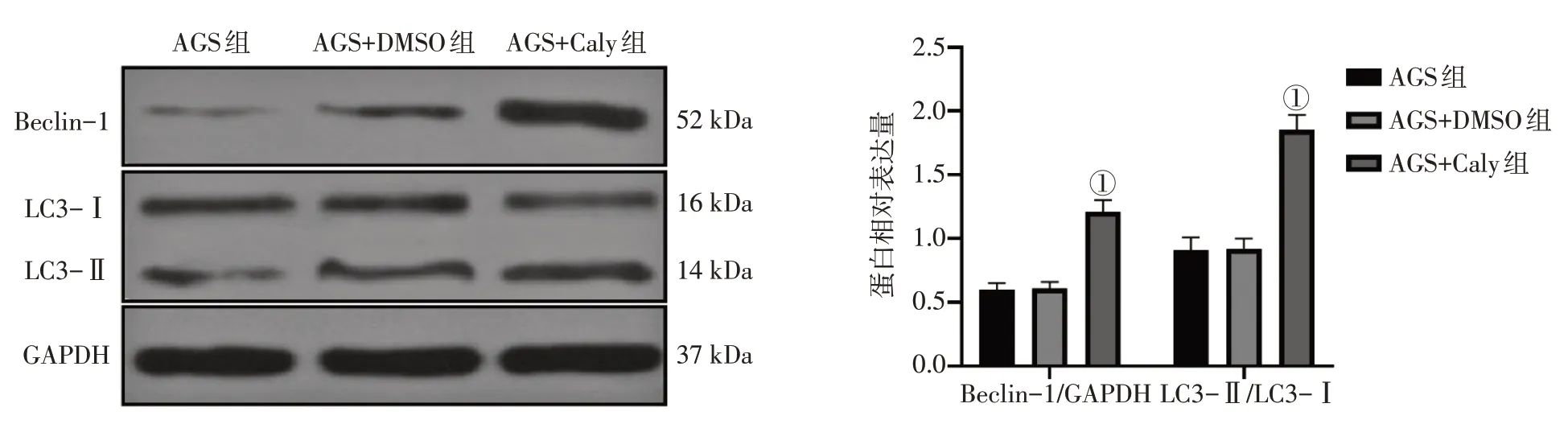
图3 毛蕊异黄酮(Caly)诱导AGS细胞自噬Figure 3 Calycosin induced autophagy in AGS cells
2.4 毛蕊异黄酮通过抑制mTOR 通路抑制AGS细胞的增殖、迁移和侵袭采用Western Blot 分析表明,与对照条件相比,毛蕊异黄酮处理显著降低AGS 细胞mTOR 的磷酸化表达水平(P<0.001),而添加MHY1485(mTOR 激活剂)使毛蕊异黄酮处理的AGS 细胞p-mTOR 磷酸化表达水平显著上升(P<0.01)。见图4-A。此外,通过Western Blot 发现,添加mTOR激活剂显著下调了毛蕊异黄酮处理的AGS 细胞自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值及Beclin-1表达水平,显著升高了毛蕊异黄酮处理的AGS 细胞增殖能力与迁移细胞数、侵袭细胞数(P<0.05 或P<0.01)。见图4-B ~D。以上结果提示,mTOR信号通路参与了毛蕊异黄酮诱导的自噬发生,毛蕊异黄酮通过抑制mTOR 通路抑制AGS细胞增殖、迁移和侵袭。

图4 毛蕊异黄酮(Caly)通过抑制mTOR通路抑制AGS细胞的增殖、迁移和侵袭Figure 4 Calycosin inhibited AGS cell proliferation,migration and invasion through inhibition of mTOR pathway
3 讨论
细胞凋亡在癌症治疗中发挥着重要作用[19-20]。近年来,自噬作为一种与细胞凋亡密切相关但又截然不同的2型程序性细胞死亡途径,已成为肿瘤研究的热点[14]。自噬在肿瘤发生和癌症进展中起双重作用,可能会增强或抑制癌症的治疗效果[21-22]。自噬是一个严格调控的过程,它去除细胞溶质成分或受损的细胞器,该过程始于自噬体的双膜囊泡的形成[23],随后,自噬体融合并将其货物运送到溶酶体进行降解和回收。自噬最初被认为是一个随机过程,现在则被认为是一种由压力或环境变化特别激活的适应性反应[24]。
自噬作为正常细胞中的肿瘤抑制机制,这一过程的失调(即Beclin-1及LC3蛋白的失调)可导致恶性转化和癌变[25-26]。本研究采用Western Blot 分析发现,毛蕊异黄酮可显著提升自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ及Beclin-1 的表达水平,促进AGS 细胞中LC3-Ⅰ向LC3-Ⅱ转化,诱导AGS细胞自噬。
线粒体被认为是自噬的重要调节剂,有助于自噬的促生存功能,例如兴奋、对毒素和其他压力源的适应性反应[27]。本研究对线粒体膜电位(MMP)进行检测,结果显示,毛蕊异黄酮能显著提升线粒体膜电位,表明毛蕊异黄酮可改善AGS细胞线粒体功能,进而促进AGS细胞自噬。
自噬受2个主要营养感应途径控制:mTOR 和AMPK 信号传导[28]。mTOR 通常在肿瘤细胞中表达上调以抑制自噬[29]。一旦被激活,mTOR 通过下游效应子的磷酸化调节线粒体功能。本研究结果显示,毛蕊异黄酮可以促进AGS 细胞自噬,抑制pmTOR 的表达,进而降低胃癌细胞的增殖、迁移、侵袭程度,而添加mTOR激活剂逆转了这些作用效果提示毛蕊异黄酮可通过抑制mTOR通路发挥抗胃癌作用磷酸化进而抑制自噬。
综上所述,本研究在细胞层面探究了毛蕊异黄酮的抗胃癌机制,发现毛蕊异黄酮可通过抑制mTOR 活化并促进自噬发生,进而抑制胃癌细胞AGS的增殖、迁移和侵袭。

