Sirt1促进炎症牙周膜干细胞成骨分化的机制
孔祥伟,尹 伟,王晨辰,张 林,程义成
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)在牙周组织再生修复中发挥重要作用[1]。然而,炎症PDLSCs的再生功能受损,给牙周炎患者使用自体PDLSCs治疗带来困难[2-3]。细菌感染和慢性炎症会导致细胞发生表观遗传修饰的改变,从而导致再生能力的下降。去乙酰化酶1(Sirtuin 1,Sirt1)在多细胞有机体中广泛存在,通过将组蛋白去乙酰化,参与多种生命过程[4]。Sirt1也是骨密度的重要调节因子[5]。但Sirt1对炎症PDLSCs成骨分化的影响及其机制尚未见相关研究报道。该研究在炎症PDLSCs成骨诱导过程中使用Sirt1激动剂白芦藜醇上调细胞中的Sirt1,观察Sirt1对炎症PDLSCs成骨分化的影响;同时,检测叉头框蛋白O(forkhead box O protein,FoxO)和核内转录调节因子κB(nuclear factor-κb,NF-κB)的表达,明确Sirt1调控炎症PDLSCs的分子机制可以为恢复疾病状态下干细胞的再生能力提供理论依据。
1 材料与方法
1.1 主要试剂与仪器DMEM 培养基、胎牛血清、青霉素、链霉素、PBS(美国Gibco公司);I型胶原酶、胰蛋白酶、β-甘油磷酸钠、地塞米松、LPS(美国Sigma公司);白芦藜醇(美国Selleckchemicals公司);谷氨酰胺、TRIzol Reagent(美国Invitrogen公司);BCIP/NBT碱性磷酸酶染色试剂盒、RIPA细胞裂解液、Bradford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);逆转录试剂盒、实时荧光定量PCR试剂盒(日本Takara公司);Sirt1抗体、Runx2抗体(美国Cell Signaling公司);乙酰化NF-κB抗体、乙酰化FoxO1抗体、FoxO1抗体(美国Abcam公司);β-actin抗体(江苏康为世纪生物技术有限公司);ECL发光试剂盒(美国Pierce公司);7500型快速实时荧光定量PCR仪(德国Applied Biosystems公司);倒置相差显微镜(日本Olympus公司);JS-860A自动凝胶成像仪(上海培清科技有限公司)。
1.2 正常与炎症PDLSCs的分离和培养正常PDLSCs来自于健康个体,年龄20~35(28.00±3.53)岁;炎症PDLSCs来自于慢性牙周炎患者,年龄31~40(35.00±4.27)岁。两种组织均来自于因正畸需要而拔除的、无龋坏的前磨牙。用无菌手术刀片刮取牙齿根中1/3的牙周膜组织,接种至6孔板内,每隔3 d更换培养液,直至有细胞从组织块边缘爬出。细胞生长达80%汇合时胰酶消化传代。取第3~5代细胞用于本实验研究。
1.3 成骨诱导分化取炎症PDLSCs制备细胞悬液,以2×104/孔的密度接种于6孔板中,在细胞达到70%汇合后,将培养液更换为成骨诱导液(含5%胎牛血清的 DMEM,地塞米松0.1 mol/L,β-甘油磷酸钠0.01 mol/L,维生素C 5×10-5mol/L),每隔3 d换液。倒置相差显微镜下观察,细胞呈复层生长并出现圆形结节。实验分为4组,① 对照组:炎症PDLSCs;② 白芦藜醇组:炎症PDLSCs+白芦藜醇;③ 成骨诱导组:炎症PDLSCs+成骨诱导;④ 成骨诱导+白芦藜醇组:炎症PDLSCs+成骨诱导+白芦藜醇。
1.4 ALP染色吸弃培养液,PBS洗涤,4%多聚甲醛固定1 h,PBS洗涤后,每孔加入1 ml BCIP/NBT工作液,室温避光放置30 min,吸弃工作液,PBS洗涤,显微镜下拍照。
1.5 实时定量PCR检测收集培养的炎症PDLSCs,加入TRIzol Reagent裂解细胞,提取总RNA。反转录操作步骤按照反转录试剂盒的说明书进行。进行反转录反应后,将得到的cDNA模板按照SYBR®Premix Ex TaqTM II(TaKaRa Code:DRR081)操作说明书加入检测体系,使用ABI 7500实时定量仪进行Real-time PCR反应。检测ALP、Runx2、OCN和Osx的表达,β-actin为内参。引物序列由上海生物工程公司设计合成,见表1。

表1 引物序列
1.6 Western blot检测使用RIPA裂解液提取细胞蛋白。使用Bradford蛋白浓度测定试剂盒测定蛋白浓度。按照4 ∶1的比例加入5×loading buffer,100 ℃、5 min水煮变性。将蛋白样本用1×loading buffer调整到同一体积。进行聚丙烯酰胺凝胶电泳,电泳停止后切胶、转膜。5%牛血清白蛋白室温封闭2 h。封一抗,4 ℃过夜。复温1 h后洗膜液冲洗3次,放入二抗,室温孵育1 h。ECL发光液A ∶B=1 ∶1混合,注意避光,均匀滴加在膜上,放入JS-860A自动凝胶成像仪曝光。用QuantityOne软件分析各条带的灰度值,以β-actin为参照,计算相对灰度值。

2 结果
2.1 Sirt1在正常PDLSCs和炎症PDLSCs中的表达通过有限稀释法获取人正常和炎症组织来源的PDLSCs,Western blot检测两种PDLSCs中去乙酰化酶Sirt1的表达情况。Western blot结果显示,在正常PDLSCs中Sirt1的蛋白表达水平较高,而在炎症PDLSCs中Sirt1的表达受到抑制,差异有统计学意义(t=5.237,P<0.01)。见图1。
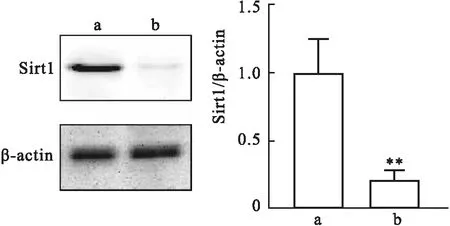
图1 Western blot检测Sirt1在正常PDLSCs和炎症PDLSCs中的表达
2.2 白芦藜醇对炎症PDLSCs成骨分化的影响在培养的炎症PDLSCs中加入Sirt1激动剂白芦藜醇,实时定量PCR和Western blot检测Sirt1的表达。结果表明,白芦藜醇可增加炎症PDLSCs中Sirt1的表达。将炎症PDLSCs进行成骨诱导,同时使用白芦藜醇上调炎症PDLSCs中的Sirt1,诱导3 d后实时定量PCR检测BSP、Runx2、OCN和Osx mRNA的表达,诱导7 d后进行ALP染色。实时定量PCR结果显示,与成骨诱导组比较,在成骨诱导时加入白芦藜醇可增加BSP(t=14.045,P<0.01)、Runx2(t=3.349,P<0.01)、OCN(t=7.218,P<0.01)和Osx (t=4.544,P<0.01)mRNA的表达。ALP染色结果表明,成骨诱导+白芦藜醇组的ALP染色较成骨诱导组增强(t=11.513,P<0.01),说明白芦藜醇可增强炎症PDLSCs的成骨分化。见图2、表2。
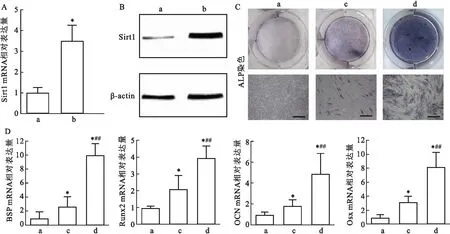
图2 实时定量PCR和Western blot检测白芦藜醇对炎症PDLSCs中Sirt1表达的影响
表2 实时定量PCR检测BSP、Runx2、OCN和Osx mRNA相对表达量
2.3 Sirt1对炎症PDLSCs成骨诱导过程中FoxO1和NF-κB表达的影响将炎症PDLSCs进行成骨诱导,同时使用白芦藜醇上调炎症PDLSCs中的Sirt1,成骨诱导7 d,Western blot检测Sirt1、乙酰化NF-κB、乙酰化FoxO1、FoxO1和Runx2的表达。结果显示:与对照组比较,炎症PDLSCs成骨诱导后FoxO1(t=8.737,P<0.01)和Runx2(t=6.152,P<0.01)的表达增强;在成骨诱导+白芦藜醇组中,炎症PDLSCs中Sirt1(F=71.260,P<0.01)的表达较对照组和成骨诱导组上调,同时FoxO1(t=5.912,P<0.01)和Runx2(t=6.277,P<0.01)的表达较成骨诱导组进一步增加,而乙酰化NF-κB(F=184.033,P<0.01)和乙酰化FoxO1(F=301.454,P<0.01)的表达较对照组和成骨诱导组明显降低。见图3。
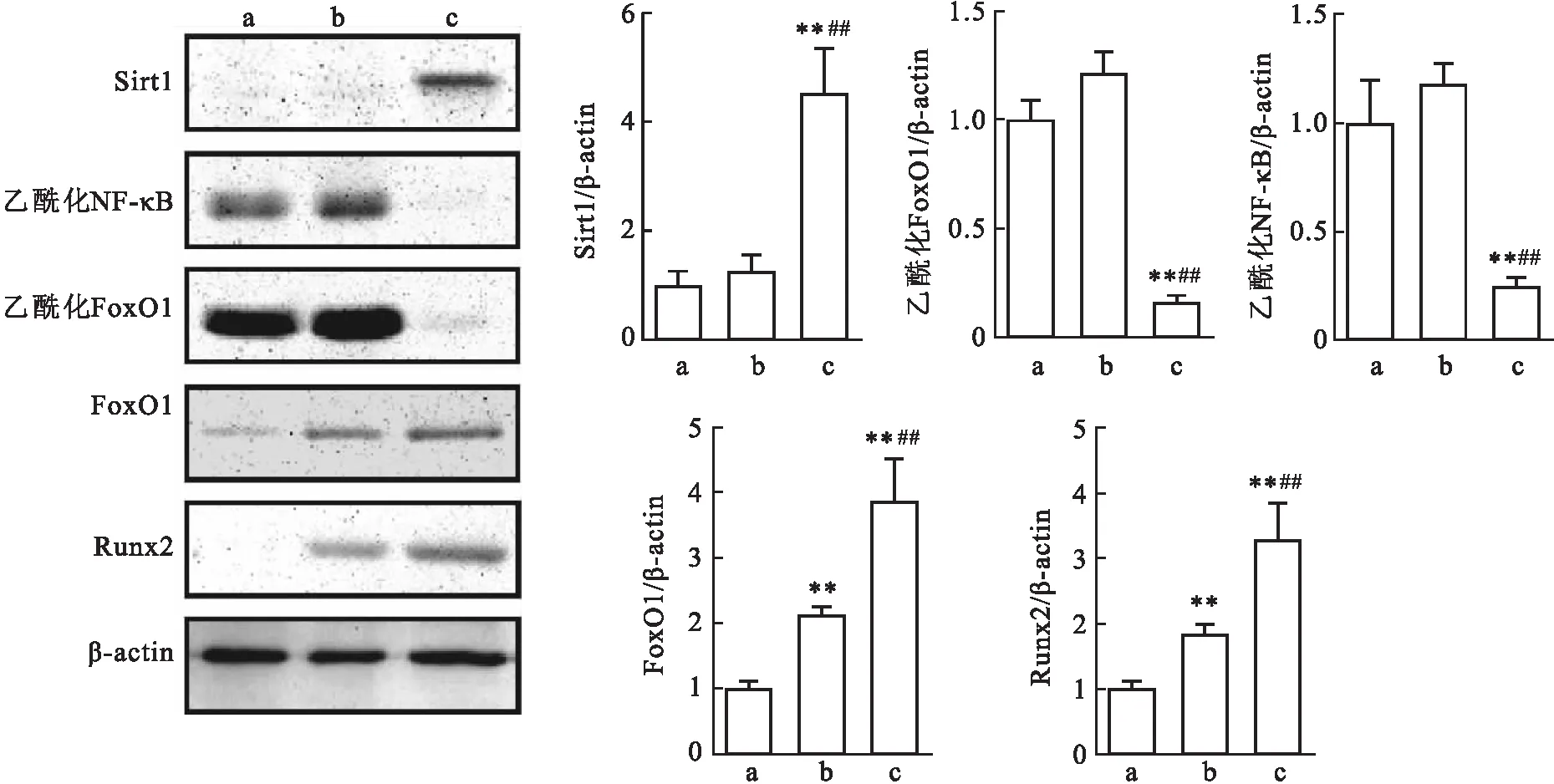
图3 Western blot检测炎症PDLSCs中Sirt1、乙酰化NF-κB、乙酰化FoxO1、FoxO1和Runx2的表达
3 讨论
表观遗传学是指在基因的核苷酸序列不发生改变的情况下,由于体内、外环境因素的影响,基因表达了可遗传的变化[6]。近年来研究发现,人体多种疾病的发生、发展都与表观遗传密切相关。类风湿关节炎患者的间充质干细胞表现出较低的增殖能力,并且数量会随着年龄的增加而减少[7]。系统性红斑狼疮患者的骨髓间充质干细胞则表现出成骨能力的下降[8]。课题组在前期的实验中[9]观察到炎症PDLSCs在脱离炎症环境后,经过长期的体外培养和传代,仍然存在成骨功能的缺陷,这可能是由于在长期的慢性炎症微环境中PDLSCs发生了表观遗传的改变。
表观遗传现象包括 DNA甲基化,组蛋白甲基化、乙酰化和泛素化等。其中,组蛋白乙酰化作用主要由两种功能相反的酶——组蛋白乙酰转移酶(histone acetyltransferases,HATs)和组蛋白去乙酰化酶(histone deacetylases,HDACs)来完成。HATs通过对组蛋白产生乙酰化作用,导致特定位点的染色质解螺旋,从而起到转录活化的作用;而HDACs可将组蛋白尾部的乙酰基去除,起转录抑制的作用[10]。Sirt1是一种在细胞中广泛存在的去乙酰化酶,可通过去乙酰化作用,维持细胞内环境的稳态,调控基因的表达,参与细胞的增殖、分化、衰老、凋亡和炎症等生命活动过程[11]。Sirt1通过对多种转录后调节因子的去乙酰化,如p53、FOXO、NF-κB以及过氧化物酶体增殖体激活受体γ等,调控细胞周期,参与DNA双链修复以及基因沉默等过程,与众多疾病相关[11]。本研究比较了正常及炎症组织来源的PDLSCs中Sirt1的表达,发现在正常PDLSCs中Sirt1的蛋白表达水平较高,而在炎症PDLSCs中Sirt1的表达受到抑制。有研究[12]报道,在动脉粥样硬化小鼠主动脉中Sirt1的表达受到抑制,与miR-29c的表达上调有关。同样,LPS诱导的外周血单核细胞中Sirt1的表达下调,可能与miR-217的高表达有关[13]。由此推测,炎症PDLSCs中Sirt1的表达下调可能与干细胞微环境的改变有关。本研究使用Sirt1激动剂白芦藜醇上调炎症PDLSCs中的Sirt1,结果发现白芦藜醇可以有效促进炎症PDLSCs的成骨分化,说明Sirt1在炎症PDLSCs成骨分化的过程中起到了积极的作用。
目前已知受到Sirt1调控的分子包括NF-κB、FoxO1等转录因子。NF-κB的乙酰化是其发挥转录活性、激活炎症反应的必要条件。Chen et al[14]研究表明,TNF-α激活NF-κB后,PDLSCs成骨分化受到抑制。本研究发现,在炎症PDLSCs中Sirt1的表达较低而乙酰化NF-κB的表达较高;在加入白芦藜醇上调Sirt1后,乙酰化NF-κB的表达下降,成骨相关蛋白Runx2的表达增多,说明乙酰化NF-κB在炎症PDLSCs的成骨分化中起负向调控作用。FoxO1是调控成骨的重要因子。在成骨细胞中FoxO1可对抗骨骼内的氧化应激反应,维持成骨细胞的正常增殖;在破骨细胞中FoxO1可促进成骨细胞前体向成骨细胞分化,对破骨细胞有抑制作用[15]。FoxO1的乙酰化能够促进其磷酸化,从而进一步发生泛素化降解。本研究发现,炎症PDLSCs成骨诱导后FoxO1的表达较对照组增强,在加入白芦藜醇上调Sirt1后FoxO1的表达进一步增强,与成骨相关蛋白Runx2的表达趋势一致,而乙酰化FoxO1的表达与FoxO1相反。以上结果表明,Sirt1可以上调炎症PDLSCs中FoxO1的表达,同时下调乙酰乙酰化FoxO1的表达,促进炎症PDLSCs的成骨分化。
综上所述,去乙酰化酶Sirt1可能通过去乙酰化NF-κB和FoxO1,从而促进炎症PDLSCs的成骨分化,明确Sirt1调控炎症PDLSCs成骨分化的分子机制可以为恢复干细胞的再生能力提供理论依据,为恢复牙周炎中牙周膜干细胞的再生能力提供新的靶点。

