多囊卵巢综合征患者胰岛素抵抗与血清中脑星形胶质细胞源性神经营养因子水平的关系
俞淑君,魏兆莲
多囊卵巢综合征(polycystic ovary syndrome,PCOS)多发生于育龄期女性,是一种常见的生殖内分泌疾病和代谢紊乱疾病,以无排卵或少排卵、高雄激素血症、卵巢多囊样改变为主要特征,多表现为月经稀发、不孕、多毛、痤疮等,通常还伴有许多代谢异常,如胰岛素抵抗、2型糖尿病、肥胖和心血管疾病等[1]。越来越多的研究[2-3]表明PCOS及胰岛素抵抗的发生与全身性慢性低度炎症相关。中脑星形胶质细胞源性神经营养因子(mesencephalic astrocyte-derived neurotrophic factor,MANF)是新型神经营养因子家族的成员之一,是一种内质网应激诱导表达蛋白,它在体内多种器官和组织中广泛表达。多项研究[4-5]表明MANF不仅可以抑制内质网应激介导的细胞凋亡,还可通过抑制NF-κB通路的激活对抗炎症损伤。此外,MANF在代谢性疾病中的保护作用也被广泛报道,MANF可通过促进胰岛β细胞的增殖,抑制其凋亡,在糖尿病的发生及进展中发挥重要的保护作用[4-6]。鉴于胰岛素抵抗是PCOS常见的代谢异常,该研究对PCOS患者胰岛素抵抗与血清MANF水平的关系作一探讨。
1 材料与方法
1.1 资料来源招募2020年11月—2021年12月就诊于安徽医科大学第一附属医院的120例PCOS患者作为实验组,40例健康女性作为对照组。实验组纳入标准:① 20~35岁的女性;② 符合2003年PCOS鹿特丹诊断标准[7];③ 就诊前3个月未使用任何影响体内激素和炎症因子的药物,包括雌孕激素、抗生素、免疫抑制剂等。对照组纳入标准:① 20~35岁的女性;② 非PCOS患者;③ 就诊前3个月未使用任何影响体内激素和炎症因子的药物,包括雌孕激素、抗生素、免疫抑制剂等。排除标准:① 年龄<20岁或>35岁;② 合并子宫肌瘤、子宫内膜异位症、子宫腺肌病、盆腔炎、卵巢囊肿、卵巢肿瘤等妇科疾病及手术史;③ 合并肝脏、肾脏、心血管、内分泌、造血系统等原发病及精神性疾病;④ 就诊前3个月使用了影响体内激素和炎症因子的药物,包括雌孕激素、抗生素、免疫抑制剂等。稳态模型评估胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR)=空腹血糖(fasting blood glucose,FBG)×空腹胰岛素(fasting insulin,FINS)/22.5,HOMA-IR≥2.69认为存在胰岛素抵抗。根据HOMA-IR将实验组分为胰岛素抵抗患者61例及非胰岛素抵抗患者59例。实验组研究对象的年龄为20~35(28.18±3.51)岁,对照组研究对象的年龄为23~34(29.18±3.04)岁,差异无统计学意义。所有参与本研究的受试者均知情同意,此项研究已通过安徽医科大学第一附属医院伦理委员会的审查,可正常开展。
1.2 方法
1.2.1性激素检测 月经规律和月经紊乱的研究对象分别在月经经期第2天或随机日早晨空腹采集5 ml静脉血,通过全自动化学发光仪测定血清中的黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)、雌二醇(estradiol,E2)、睾酮(testosterone,T)、雄烯二酮(androstenedione,A2)、硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEA-S)和性激素结合蛋白(sex hormone binding globulin,SHBG)水平。
1.2.2FBG和FINS检测 月经规律和月经紊乱的研究对象分别在月经经期第2天或随机日早晨空腹采集5 ml 静脉血,通过全自动生化分析仪测定血清中的FBS水平,通过全自动电化学发光仪测定血清中的FINS水平。
1.2.3血清MANF检测 月经规律和月经紊乱的研究对象分别在月经经期第2天或随机日早晨空腹采集5 ml 静脉血,在3 000 r/min的转速下离心10 min,离心后收集上层血清,于-80 ℃条件下保存。通过酶联免疫吸附试验对所采集样本进行血清MANF水平的检测。
1.3 研究指标比较实验组与对照组血清中的性激素、FBS、FINS及MANF水平的差异,比较实验组中胰岛素抵抗患者及非胰岛素抵抗患者血清MANF水平的差异,并对血清MANF水平与HOMA-IR之间的相关性进行分析。

2 结果
2.1 两组性激素水平比较与对照组比较,实验组PCOS患者血清中的LH、T、A2和DHEA-S水平均显著升高,血清中的FSH和SHBG水平显著降低,差异有统计学意义(P<0.05)。对照组与实验组血清中的E2水平比较差异无统计学意义(P>0.05)。见表1。
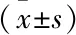
表1 两组性激素水平比较
2.2 两组FBG、FINS水平比较与对照组比较,实验组PCOS患者血清中的FBG、FINS水平和HOMA-IR水平均显著升高,差异有统计学意义(P<0.05)。见表2。
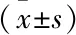
表2 两组FBG、FINS及HOMA-IR水平比较
2.3 两组血清MANF水平比较对照组的血清MANF水平为(415.13±105.00)×10-6mg/L,实验组的血清MANF水平为(295.48±78.27)×10-6mg/L。与对照组比较,实验组中PCOS患者的血清MANF水平显著降低,差异有统计学意义(P<0.05)。
2.4 实验组中胰岛素抵抗患者与非胰岛素抵抗患者的血清MANF水平比较实验组中胰岛素抵抗患者61例,血清MANF水平为(270.28±61.92)×10-6mg/L;非胰岛素抵抗患者59例,血清MANF水平为(321.54±85.12)×10-6mg/L。胰岛素抵抗患者的血清MANF水平显著低于非胰岛素抵抗患者,差异有统计学意义(P<0.05)。
2.5 实验组中血清MANF水平与HOMA-IR的相关性实验组中PCOS患者的血清MANF水平和HOMA-IR呈负相关(rs=-0.642,P<0.05)。
3 讨论
PCOS是一种常见的生殖内分泌紊乱的临床疾病,常伴有多种代谢障碍,多篇研究报道PCOS的发病病因复杂,具体机制尚不明确,遗传、神经内分泌、环境及心理等多种因素共同参与PCOS的发生及发展过程[8]。研究[9]显示,PCOS是一种全身性慢性低度炎症。PCOS患者外周血及卵巢组织中的炎症因子水平均显著上调,如白细胞介素(interleukin-1 beta,IL)-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等。在这种慢性低度炎症环境的刺激下,卵巢和肾上腺合成和分泌的雄激素显著增多,活性显著增强,并且肝脏合成的性激素结合球蛋白明显减少,导致血清中游离睾酮的水平明显上升,从而形成高雄激素血症。反之,升高的雄激素可促进NF-κB等信号通路的激活进一步诱导相关炎症因子的表达进而加重全身和卵巢等组织局部的炎症反应[10]。
胰岛素抵抗常伴发于PCOS是PCOS发生及进展的重要机制之一。胰岛素抵抗是一种机体对胰岛素敏感性下降的病理状态。当肝脏和骨骼肌等组织中的细胞对胰岛素的敏感性降低时,胰岛素促进这些细胞摄取并利用葡萄糖的能力降低,进而刺激机体代偿性合成并分泌胰岛素,以维持机体的代谢平衡。已有研究证实[11-12]IRS-1/PI3K/AKT信号通路是重要的胰岛素信号传导通路之一。当游离的胰岛素与细胞表面受体结合后,胰岛素受体底物被活化,可激活下游PI3K/AKT信号通路,促进组织细胞吸收和利用葡萄糖。有研究[11]显示,炎症反应会抑制IRS-1/PI3K/AKT信号通路的激活。在慢性低度炎症环境下,IL-1β、IL-6、TNF-α和C反应蛋白等多种促炎因子的水平显著升高,这使得IRS-1的丝氨酸磷酸化水平明显升高,酪氨酸磷酸化水平明显降低,继而引起IRS-1相关的PI3K活性下降,导致胰岛素信号通路的传导受阻,最终出现胰岛素抵抗和2型糖尿病等代谢异常[11]。另有研究[12]结果表明,多种药物如葛根素、染料木黄酮等,可通过抑制NF-κB信号通路的激活,下调其下游促炎因子的表达,从而有效抑制IRS-1的丝氨酸磷酸化,促进胰岛素信号通路的传导,最终使胰岛素抵抗得到缓解。
MANF是一种分泌型小分子蛋白质,可在体内广泛表达,对于神经元和非神经元细胞都具有一定的保护作用[5,13]。有研究[14]表明,MANF可以通过抑制细胞内内质网应激的过度激活,进而抑制细胞的凋亡。MANF还可以结合NF-κB通路的关键亚基p65,抑制其下游靶基因的转录激活,从而发挥对抗炎症的作用。此外,MANF可在多种代谢性疾病中发挥关键的保护作用。MANF可通过抑制肝细胞的凋亡,促进脂肪分解相关基因的表达[15]。MANF还可以抑制胰岛β细胞的凋亡,促进其功能的恢复,进而对抗糖尿病的发生及病程进展[4,6]。
所以课题组推测,MANF可能是通过抑制NF-κB信号通路的激活以调节炎症反应,进而影响IRS-1/PI3K/AKT胰岛素信号通路的传导,最终参与PCOS患者胰岛素抵抗的发生和进展过程。本研究通过比较PCOS患者及健康女性血清中性激素、FBS、FINS及MANF的水平,发现PCOS患者表现出明显的内分泌紊乱及胰岛素抵抗等异常(P<0.05)。PCOS患者血清中的MANF水平较健康女性明显下降(P<0.05)。重要的是,与未患有胰岛素抵抗的PCOS患者比较,患有胰岛素抵抗的PCOS患者血清中的MANF水平显著下降(P<0.05),并且实验组PCOS患者血清中的MANF水平与HOMA-IR呈负相关(P<0.05)。
综上所述,MANF可能参与了PCOS患者胰岛素抵抗发生及进展的过程,其发挥作用的具体机制还需要进一步深入研究,以期为临床上PCOS的诊断和治疗提供新的思路。

