天麻素通过Notch 信号通路调控激活的BV2 小胶质细胞的研究
杨雪珂,张晓丽娜,钟正,赵永强,李顺达,李晓文,袁云
1.昆明医科大学基础医学院人体解剖与组织胚胎学系,昆明 650500;2.三峡大学第一临床医学院,宜昌 443002;3.宜昌市中心人民医院,宜昌 443008;4.昆明医科大学第一附属医院疼痛科,昆明 650032;5.华中科技大学同济医学院附属同济医院,武汉 430030
小胶质细胞是中枢神经系统(central nervous system,CNS)的巨噬细胞,在大脑中分布广泛。作为CNS 的免疫细胞,小胶质细胞参与脑内免疫防御和维持CNS 内环境稳定[1]。大脑发生任何异常的变化如缺血缺氧及创伤性脑损伤等,会导致小胶质细胞激活[2,3],激活的小胶质细胞释放过量的炎性因子和细胞毒性因子,介导炎症反应,从而加重神经元损伤。Notch 信号通路可调控神经系统细胞结构和功能的动态变化。研究证明,Notch 信号通路参与缺血缺氧性脑损伤后小胶质细胞激活,新生儿缺血缺氧脑损伤模型鼠中Notch 信号通路相关蛋白Notch-1、Notch 受体结构域(intracellular Notch receptor domain,NICD)、转录因子重组结合蛋白抑制子(recombining binding protein suppressor of hairless,RBP-JK)、转移因子发卡和split-1 增强子(transcription factor hairy and enhancer of split-1,Hes-1)表达增加,小胶质细胞炎性因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达也增加。抑制Notch 信号通路,可显著抑制小胶质细胞激活及减少其炎性因子释放[4]。因此,Notch 信号通路在缺血缺氧性脑损伤中介导小胶质细胞激活具有重要作用。天麻素(C13H18O7)是从天麻中提取的一种有效单体成分,在急性缺血性脑损伤和慢性神经退行性疾病的干预和治疗中具有极大潜力[5]。研究发现,天麻素作用于蛛网膜下腔出血模型鼠,能减少大鼠神经元坏死,提高神经功能评分,并降低炎性因子的表达[6]。天麻素能抑制新生大鼠缺血缺氧性脑损伤后小胶质细胞激活及NADPH 氧化酶2 表达,进而发挥神经保护作用[7]。本研究通过天麻素干预治疗小胶质细胞Notch 信号通路以及通路下游各组成部分的表达变化,天麻素调控Notch 信号通路调节小胶质细胞激活的机制,为治疗缺血缺氧性脑损伤提供潜在治疗靶点和理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 天麻素、Cy3 偶联的山羊抗兔IgG、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的lectin(lycopersicon esculentum)和含DAPI 的封片剂购自德国Sigma 公司;兔抗Notch-1 多克隆抗体、兔抗NICD 多克隆抗体、兔抗RBP-JK 单克隆抗体购自英国Abcam 公司;鼠抗Hes-1 单克隆抗体购自美国Santa Cruz 公司;PVDF 膜购自美国Millipore 公司;高糖培养基和无糖培养基购自上海逍鹏公司;ECL 化学发光检测试剂购自合肥白鲨公司。
1.1.2 主要仪器 电泳仪购自北京凯元公司,半干转膜仪和化学发光成像系统购自美国Bio Rad 公司,细胞缺氧小室购自美国Bilups-rothenberg 公司。
1.2 方法
1.2.1 细胞培养 小鼠源性BV2 小胶质细胞系由新加坡国立大学解剖系林荣安教授馈赠,采用含有10%胎牛血清的DMEM 高糖培养基在5% CO2、37 ℃的细胞培养箱中进行培养。
1.2.2 细胞分组及处理 待细胞处于对数生长期且细胞密度达80%时,将细胞从培养瓶中消化并计数,接种于6 孔板中,每孔细胞数量为1.5×105个。将细胞随机分为Control 组、氧糖剥夺OGD 组和天麻素+氧糖剥夺G+OGD 组。将G+OGD 组中含10%胎牛血清的高糖培养基更换成不含胎牛血清的高糖培养基,提前1 h 给浓度为0.34 mmol/L 的天麻素。然后将OGD组和G+OGD 组中的培养基更换成预先缺氧的无糖培养基,缺氧(95% N2和5% CO2)2 h 后取出进行后续步骤。对Control 组不进行任何处理。
1.2.3 Western blot 将上述处理后的细胞取出,弃去培养基,用0.1 mol/L 的PBS 洗涤两遍,6 孔板中加入细胞裂解液,于4 ℃冰上静置15 min,用细胞刮刀从6孔板壁上将细胞均匀刮下。将细胞和裂解液收集到离心管中,4 ℃冰箱中静置。将离心管放置于4 ℃的高速低温离心机中,14,000 r/min 离心15 min 后取上清,用蛋白浓度检测试剂盒检测各组细胞蛋白浓度,取30 μg 蛋白进行SDS-PAGE 蛋白电泳,采用半干转膜仪22 V/70 min,将蛋白转移至PVDF 膜上,经5%脱脂牛奶封闭2 h,分别加入一抗(兔抗Notch-1 多克隆抗体1:2000;兔抗NICD 多克隆抗体1:1000;兔抗RBP-JK 单克隆抗体1:1000;鼠抗Hes-1 单克隆抗体1:1000)于4 ℃冰箱孵育过夜。用HRP 标记的山羊抗兔二抗(1:5000)、山羊抗鼠二抗(1:5000)于室温孵育1 h 后洗涤,用ECL 试剂于暗房内显影,并标记保存条带,用Image J 软件进行结果统计。
1.2.4 免疫荧光双标染色 将BV2 细胞制备细胞爬片,PBS 清洗两遍。用含4%的多聚甲醛固定细胞20 min,PBS 清洗两遍后加入5%山羊血清封闭1 h。分别加入一抗(兔抗Notch-1 多克隆抗体1:200;兔抗NICD 多克隆抗体1:200;兔抗RBP-JK 单克隆抗体1:200;鼠抗Hes-1 单克隆抗体1:200),置于4 ℃冰箱孵育过夜。次日PBS 洗涤3 遍,加入对应Cy3 标记的山羊抗兔IgG(1:200)、Cy3 标记的山羊抗鼠IgG(1:200)和FITC 标记的lectin(1:300)于室温孵育1 h,PBS 清洗3 遍后用含有DAPI 的封片剂进行封片。荧光显微镜下采集图像,用Image J 进行结果统计。
1.3 统计学分析
采用Graphapd prism 6.0 统计软件进行统计,单因素方差(one-way ANOVA)进行组间比较,P<0.05 时具有统计学意义。
2 结果
2.1 天麻素抑制OGD 诱导激活的BV2 细胞Notch 信号通路相关蛋白表达
Western blot 结果显示,与Control 组相比,OGD 诱导激活的小胶质细胞Notch 信号通路(Notch-1、NICD、RBP-JK 和Hes-1)蛋白表达升高,天麻素干预可明显降低Notch-1、NICD、RBP-JK 和Hes-1 的蛋白表达(P<0.05,图1)。
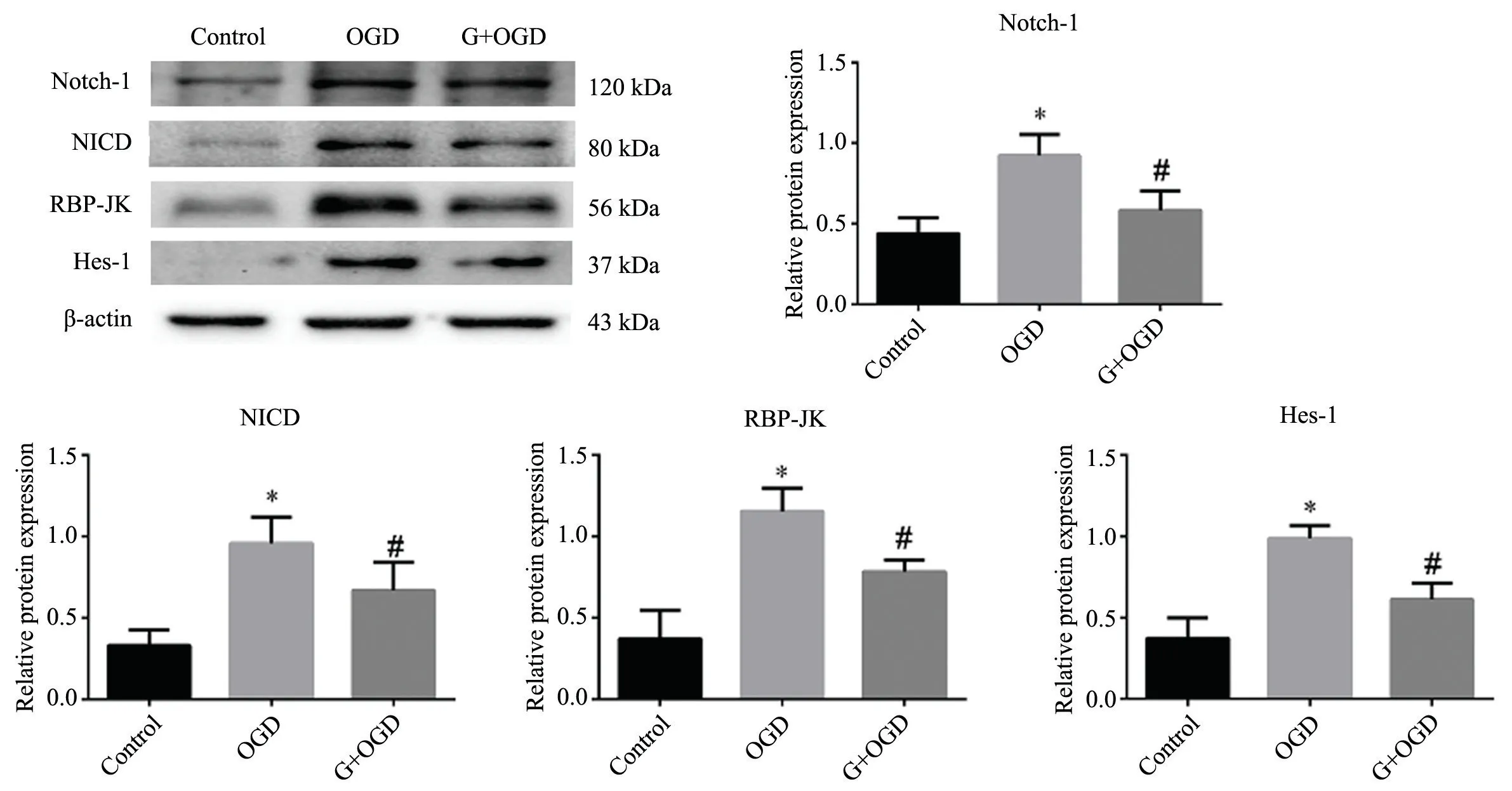
图1 天麻素对BV2 细胞Notch 信号通路相关蛋白表达影响 *P<0.05,与Control 组比较# P<0.05,与OGD 组比较Fig.1 Effect of gastrodin on the protein expression of Notch signaling pathways *P<0.05 vs control group;#P<0.05 vs OGD group
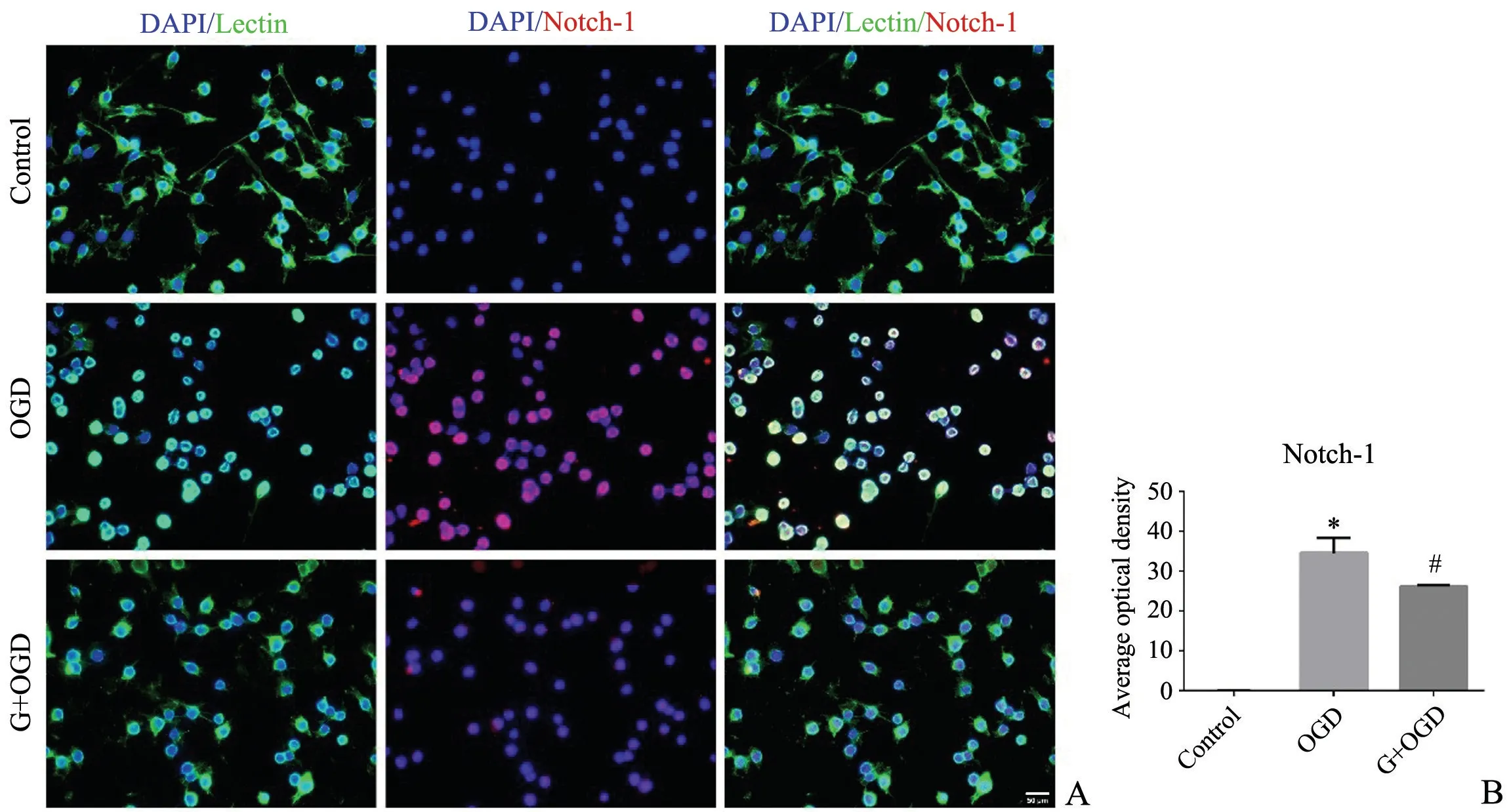
图2 Notch-1 在激活的BV2 细胞的表达A:免疫荧光染色图(标尺=50 μm)B:平均荧光强度* P<0.05,与Control 组比较# P<0.05,与OGD 组比较Fig.2 The expression of Notch-1 in activated BV2 cellsA: Figure of immunofluorescence staining(Bar=50 μm); B:Average fluorescence density of Notch-1;*P<0.05 vs control group;#P<0.05 vs OGD group
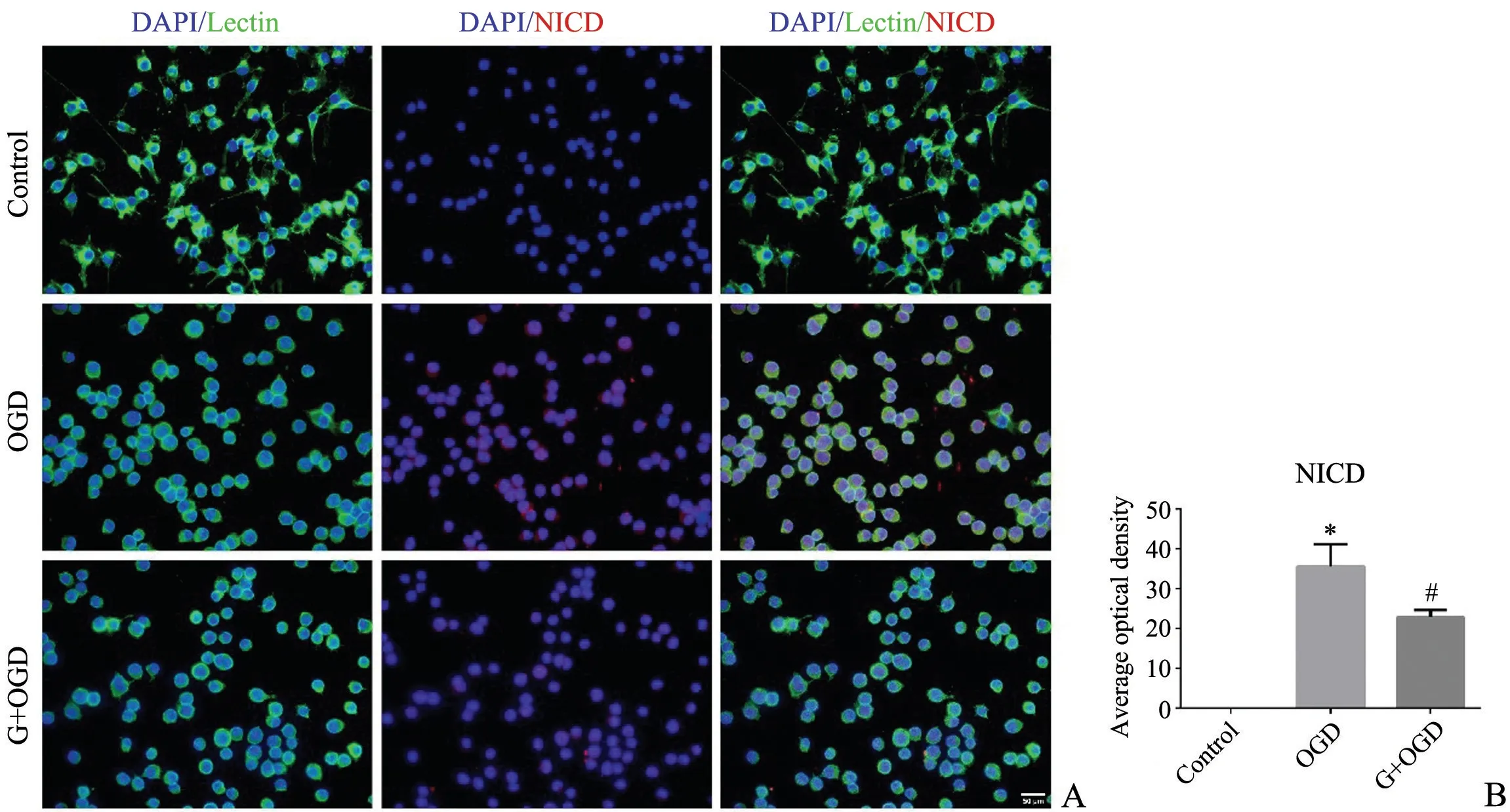
图3 NICD 在激活的BV2 细胞的表达A:免疫荧光染色图(标尺=50 μm)B:平均荧光强度* P<0.05,与Control 组比较# P<0.05,与OGD 组比较Fig.3 The expression of NICD in activated BV2 cellsA: Immunofluorescence staining (Bar=50 μm); B:Average fluorescence density of NICD;*P<0.05 vs control group;#P<0.05 vs OGD group

图4 RBP-JK 在激活的BV2 细胞的表达A:免疫荧光染色图(标尺=50 μm)B:平均荧光强度* P<0.05,与Control 组比较# P<0.05,与OGD 组比较Fig.4 The expression of RBP-JK in activated BV2 cellsA: Immunofluorescence staining (Bar=50 μm); B:Average fluorescence density of RBP-JK;*P<0.05 vs control group;#P<0.05 vs OGD group
2.2 天麻素降低OGD 诱导激活的BV2 细胞Notch 信号通路相关蛋白表达
免疫荧光双标染色结果显示,OGD 激活的小胶质细胞体积增大,细胞突起减少,Notch-1、NICD、RBP-JK 和Hes-1 表达明显增强。天麻素干预后显著降低了Notch-1、NICD、RBP-JK 和Hes-1 的表达(P<0.05,图2-5)。
3 讨论
缺血缺氧性脑损伤造成CNS 胶质细胞损伤并激活,小胶质细胞的激活是神经炎症的标志之一。激活的小胶质细胞朝向病变区域快速反应,伴随着一系列炎性细胞因子和细胞毒性因子的释放如一氧化氮(NO)、TNF-α、白细胞介 素-1β(IL-1β)、活性氧(reactive oxygen species,ROS)、环氧合酶-2(cyclooxygenase-2,COX-2)和基质金属蛋白 酶(matrix metalloproteinase,MMPs)等[8],诱导神经元死亡,导致脑组织损伤程度加重。因此抑制小胶质细胞的过度激活及其介导的炎症反应可能是减缓缺血缺氧性脑损伤后神经系统疾病发展的有效治疗策略。
天麻素是一种天麻中提取的酚性糖苷,能较好地缓解失眠、神经衰弱以及抑郁等精神症状,改善学习与记忆能力[9]。目前已证实天麻素在缺血缺氧性脑损伤中具有神经保护作用。缺血缺氧性脑损伤大鼠神经元胞体萎缩、轴突变短,伴随数量减少、乳酸脱氢酶释放增加和细胞活力下降,天麻素干预后,改善了其神经元形态,减少神经元坏死和乳酸脱氢酶释放[10]。课题组的前期结果也显示天麻素可抑制新生大鼠缺血缺氧性脑损伤后胼胝体内小胶质细胞激活,降低NADPH 氧化酶2 的表达发挥抗氧化作用[7]。
Notch 信号通路调节多种生物胚胎时期和出生后不同组织和细胞类型的动态平衡以及发育和分化。哺乳动物有4 个Notch 受体(Notch 1-4)参与将特定的细胞外信号传递到细胞核。Notch 信号通路配体与其受体相结合,崩解素和金属蛋白酶分离出大部分切口细胞外领 域(Notch extracellular domain,NECD),NICD 被γ 分泌酶复合物切割从细胞膜释放,随后从细胞质易位到细胞核中,与RBP-JK 进一步调节下游靶基因Hes-1 和Hes-5 等[11]。课题组前期研究发现,阻断 Notch 信号通路后能显著减少脂多糖(lipopolysaccharide,LPS)诱导的小胶质细胞激活及炎性细胞因子TNF-α 表达,体内结果也证明天麻素干预能显著减少缺血缺氧性脑损伤后小胶质细胞激活及炎性细胞因子的释放[4]。因此抑制Notch 通路可能对抑制小胶质细胞的激活具有重要意义。
课题组前期研究显示新生大鼠缺血缺氧性脑损伤后可见大脑胼胝体区和皮质中去乙酰化酶3(Sirtuins3,Sirt3)表达增加。与模型组相比,天麻素治疗后进一步促进Sirt3 和营养因子如胰岛素样生长因子-1 和脑源性神经营养因子的表达增加,减少炎性因子释放,发挥抗氧化应激和神经保护作用[12]。由于小胶质细胞在该疾病中为主要的炎症过程调控细胞,为进一步研究天麻素通过何种机制调控Sirt3,在体外实验利用LPS 诱导激活小胶质细胞。研究发现天麻素可能通过调控Notch 信号通路调节Sirt3 的表达[13]。LPS 是大多数革兰氏阴性细菌的结构成分,可激活小胶质细胞诱导炎症环境。利用LPS 刺激小胶质细胞相较于OGD 模型具有局限性。OGD 模型为氧糖剥夺实验,通过注入氮气以及更换无糖培养基可精确控制氧气含量和细胞生长的营养环境,更加接近模拟机体内发生缺血缺氧时小胶质细胞的变化。因此本研究利用OGD 诱导BV2 小胶质细胞以获得精确结果,检测Notch 信号通路相关蛋白的表达及天麻素干预的作用,发现OGD 诱导BV2 小胶质细胞Notch 信号通路激活,Notch 信号通路相关蛋白Notch-1、NICD、RBP-JK 和Hes-1 表达升高,天麻素干预后Notch-1 表达显著减少,同时抑制其下游靶标NICD、RBP-JK 和Hes-1 的表达,说明天麻素可以通过抑制Notch 信号通路减少小胶质细胞激活。综合课题组目前的体内和体外实验结果显示,天麻素可通过调控小胶质细胞Notch 信号通路、调节Sirt3 和营养因子以及炎症因子释放对缺血缺氧性脑损伤提供保护作用。这可能为临床天麻素治疗缺血缺氧性脑损伤提供明确的治疗靶点,然而还需进一步探索其具体机制。