模拟高原低氧小鼠学习记忆能力与肠道菌群结构改变的相关性研究
李文豪,齐宝宁,施艺,王昱昊,赵再华,王瑜,沈学锋
1.陕西中医药大学公共卫生学院,陕西 咸阳 712046;2.空军军医大学军事预防医学系劳动与环境卫生学教研室,西安 710032;3.空军军医大学西京医院消化外科,西安 710032
低氧是危害人体健康的重要因素,大脑是机体需氧量最大的器官,对低氧尤为敏感[1,2]。以往低氧对学习记忆能力损伤的研究显示,从急性到慢性暴露于低氧环境中,神经元突触发生功能到结构可塑性变化,长时程增强(long-term potentiation,LTP)形成受到干扰,导致学习记忆能力下降[3,4]。虽然脑功能随着机体对低氧环境的习服有所改善,但随着暴露时间延长或海拔高度增加,海马、纹状体和小脑等低氧敏感脑区往往会出现损伤,导致认知功能发生不可逆变化[5]。囿于神经损伤靶点的药物安全性和血脑屏障通透性,亟待从多器官系统互联调控角度出发,阐释低氧脑功能损伤的潜在机制,为提出具有切实可行的防护策略提供理论基础。机体初入高原出现呼吸、循环、消化及中枢神经等多系统损伤,严重者导致多器官功能衰竭,甚至死亡。早期临床表现为头痛、心慌、胸闷、食欲不振、上腹部疼痛及注意力、执行力、复杂思维判断力和短时记忆能力下降。越来越多的研究表明肠道菌群与学习记忆能力密切相关[6],以“微生物-肠-脑轴”为核心,肠道菌群可通过神经、免疫和内分泌系统等途径与大脑进行双向交流,维护宿主的微生物平衡和中枢神经系统稳态[7]。低氧能破坏肠道菌群稳态[8~10],但肠道菌群动态变化在高原低氧所致学习记忆能力损伤中发挥的作用还未阐明。本文通过建立慢性高原低氧暴露动物模型,采用行为学和基因组学相结合的方法研究高原低氧环境下小鼠肠道菌群的变化特征及其与学习记忆功能的关系,旨在以肠道菌群角度寻找学习记忆损伤的生物标志物,为高原低氧暴露学习记忆损伤防治提供新思路。
1 材料和方法
1.1 材料
1.1.1 实验动物 雄性6~8 周龄C57BL/6 小鼠14 只,体质量(22.33±1.54)g,由空军军医大学动物中心提供,22~24 ℃的恒温环境饲养,保持24 h 昼夜节律,自由饮水进食。所有动物实验操作获得空军军医大学实验动物管理伦理委员会批准(IACUC-20190402)。1.1.2 实验仪器及试剂 低压低氧动物试验舱(贵州风雷航空军械有限公司),行为学系统(上海欣软信息科技有限公司),核酸定量仪(美国Thermo Fisher 公司),基因扩增仪(美国Applied Biosystems 公司),E.Z.N.A.®粪便DNA 试剂盒(美国Omega Biotek 公司)。
1.2 方法
1.2.1 构建动物模型 小鼠被随机分为低氧组(Hypoxia)和对照组(Control),每组7 只。对照组动物在实验室动物房常规饲养,低氧组动物根据课题组的前期研究[10]放入低压低氧动物试验舱,海拔高度设置4000 m,持续低氧暴露4 周。
1.2.2 行为学检测 旷场实验采用40 cm×40 cm×40 cm 旷场箱测量小鼠的自发探索行为、自主活动和一般焦虑抑郁样症状。箱底部中央20 cm×20 cm 为中央区,其余为周围区。小鼠适应环境2 h 后让其自由探索5 min,每只小鼠实验结束后,清理旷场箱并用75%的乙醇消除气味。记录小鼠运动总距离、平均速度、在中央区的运动时间和距离。
新物体识别分为习惯、熟悉、测试3 个阶段。小鼠低压低氧暴露4 周结束,提前适应环境后在场地对角线的位置放置两个相同的物体,让其自由探索5 min。2 h 后,将一个物体换成新的物体,测试5 min 并记录数据,每只小鼠结束后清理排泄物并用75%的酒精喷洒以消除气味对实验的影响。
Morris 水迷宫水池分为4 个象限,其中一个象限放置逃逸平台,水面超过平台1.5~2.0 cm。实验期间环境保持不变,水温维持在(21±2)℃。定位航行训练期间,每只小鼠游120 s 寻找平台,若没有找到则引导小鼠到平台上休息20 s,记录小鼠从入水到爬上平台所需的时间作为逃避潜伏期。每只小鼠每天训练4 次,持续5 d。第6 d 进行空间探索实验,移除平台,将小鼠从任一象限放入水中,让其自由游泳120 s,记录小鼠在4 个象限停留的时间。
1.2.3 16S rDNA 测序 低氧组暴露结束按摩小鼠下腹部刺激排便,无菌镊子取新鲜粪便于无菌冻存管中,经液氮速冻后转移至-80 ℃冰箱保存备用。采用E.Z.N.A.®粪便DNA 试剂盒提取小鼠粪便样本中的DNA,1.0%琼脂糖凝胶电泳验证提取的基因组DNA的完整性。使用通用引物341F、806R 从提取的DNA中扩增细菌核糖体RNA 基因的V3-V4 区。F 端序列(5′-3′):CCTACGGGRSGCAGCAG(341F);R 端序列(5′-3′):GGACTACHVGGGTWTCTAAT(806R);得到425 bp 左右扩增片段。扩增程序为95 ℃预变性2 min;95 ℃变性、55 ℃退火、72 ℃延伸共30 s,27 个循环;72 ℃稳定延伸5 min;4 ℃保存。Illumina 测序平台上机测序,获得的原始数据经高质量质控及嵌合体去除后得到有效数据。根据不同的相似度水平,对有效数据中所有的序列进行归类获得可操作分类单元(operational taxonomic unit,OTUs)。根据已有数据对每个OTU 的代表性序列进行物种注释,得到相应的物种信息和物种丰度分布。
1.3 统计学分析
行为学图片绘制用Graphpad Prim 8.0,所有数据采用平均值±标准误(Mean±SEM),根据数据是否符合正态分布,采用独立样本t检验或者Wilcoxon 秩和检验。组间整体微生物群落采用置换多变量方差分析(PERMANOVA)确定是否存在差异;相对丰度采用线性判别分析LEfSe(Linear discriminant analysis Effect Size)确定组间差异。相关性分析采用Spearman 方法,Rversion3.6.3 软件分析绘制。P<0.05表明两组间存在显著的统计学差异。
2 结果
2.1 高原低氧环境小鼠学习记忆功能降低
旷场实验中运动总距离、平均速度反映小鼠自发探究行为活动能力,在中央区活动时间和活动距离初步反映小鼠的焦虑抑郁样行为(图1A)。对照组小鼠在旷场实验中运动总距离(1982.12±206.36)cm、平均速 度(7.07±0.70)cm/s,低氧组小鼠运动总距离(1959.89±154.73)cm、平均速度(6.87±0.54)cm/s,两组之间无显著性差异,表明小鼠在低氧环境下自发活动能力未发生明显的改变(图1B~C)。对照组小鼠在中央区运动距离(325.92±34.34)cm、中央区运动时间(40.32±9.78)s,低氧组小鼠在中央区运动距离(258.19±40.83)cm、中央区的运动时间(26.16±4.88)s,两组之间无显著性差异,表明小鼠在低氧环境下无显著的焦虑抑郁样行为(图1D~E)。
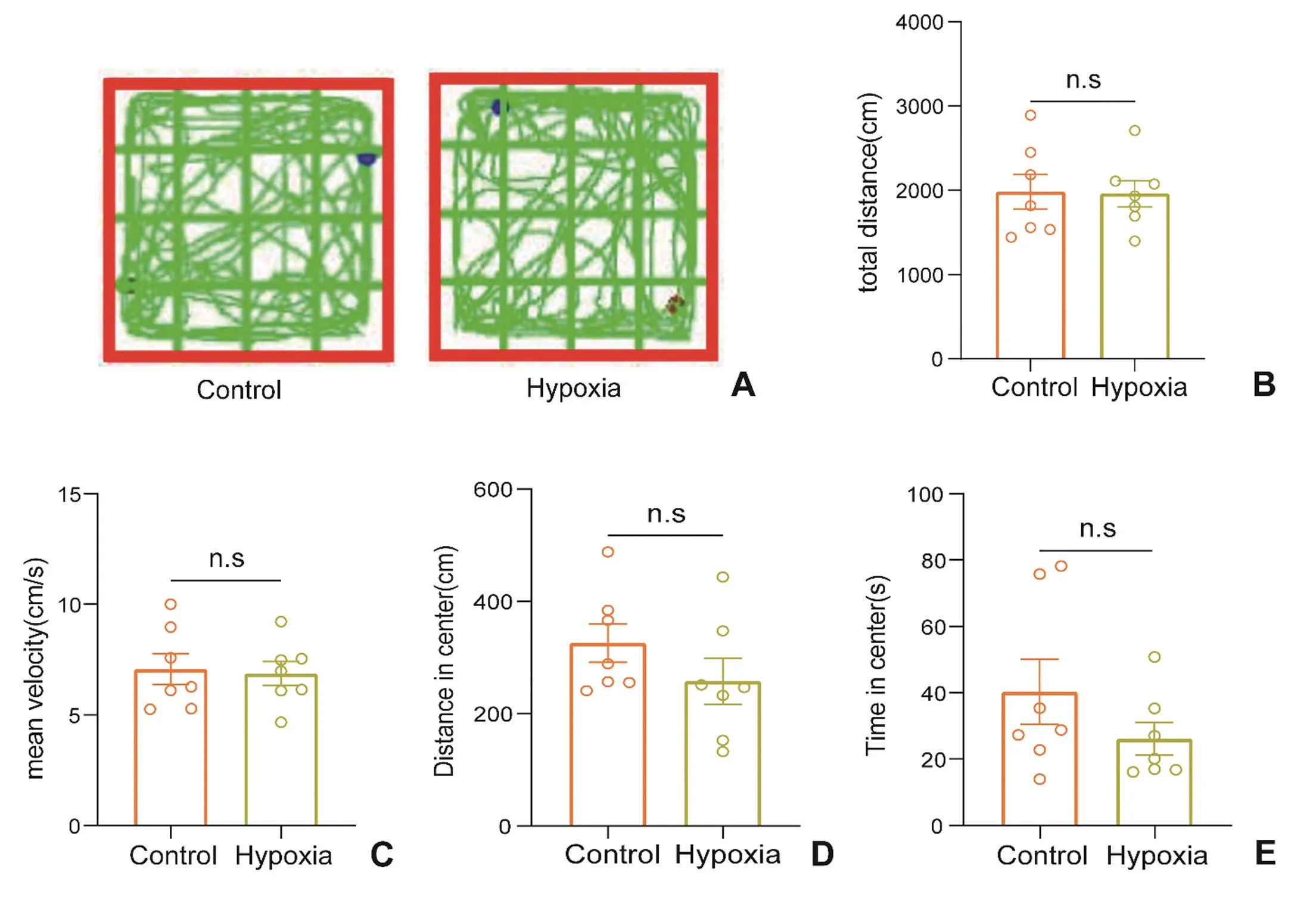
图1 旷场实验小鼠代表性运动轨迹图及统计分析图A:两组小鼠代表性运动轨迹图 B:运动总距离 C:平均速度 D:在中央区运动总距离E:在中央区运动时间Hypoxia:低氧组 Control:对照组 n.s 表示无显著性差异 n=7Fig.1 Representative locomotion tracking routes and statistical analysis histogram of mice in open field testA: Representative locomotion tracking routes of mice; B: The total distance of the two groups of mice in the open field;C: Mean velocity; D: Distance in center; E:Time in center; n.s represented no significant difference, n=7
新物体识别和水迷宫用于检测小鼠短时记忆力和空间记忆能力。新物体识别数据结果表明,对照组小鼠辨别指数(discrimination index,DI)为(0.32±0.13),低氧组小鼠DI 为(-0.21±0.12),两组之间存在显著性差异,表明低氧组小鼠对新物体识别能力下降,学习记忆能力降低(P<0.05,图2A~B)。水迷宫结果表明在定位航行期间,两组小鼠逃避潜伏期随着训练时间的增加而逐渐缩短,第5 d 低氧组比对照组小鼠逃避潜伏期延长且差异具有统计学意义(16.65±1.89)vs(10.84±1.67),P<0.05;空间探索实验期间,低氧组小鼠在目标象限停留的时间百分比(35.52±2.41)%相较于对照组(44.78±2.09)%降低(P<0.05),表明低氧组小鼠空间记忆能力下降(图2C~E)。

图2 小鼠新物体识别和水迷宫实验轨迹图及统计分析图A:新物体识别代表性轨迹图B:新物体识别DI 指数C:水迷宫定位航行训练及空间探索实验代表性轨迹图D:定位航行训练期间逃避潜伏期E:空间探索期间小鼠在目标象限停留时间百分比 Hypoxia:低氧组Control:对照组*P<0.05 n=7Fig.2 Representative locomotion tracking routes and statistical analysis histogram of mice in novel object recognition (NOR) and morris water maze (MWM)A: Representative locomotion tracking routes in NOR; B: Discrimination Index; C: Representative locomotion tracking routes of navigation test and probe test in MWM; D: The escape latency in navigation test; E: Precent time in target quadrant in probe test*P<0.05, n=7
2.2 高原低氧环境导致小鼠肠道菌群紊乱
2.2.1 高原低氧对小鼠肠道菌群结构多样性影响低氧暴露4 周结束,收集两组小鼠的粪便样本进行16S rDNA 测序,结果发现,与对照组相比低氧组chao1、observed_species、shannon、simpson 指数显著降低,表明低氧组小鼠肠道菌群α 多样性降低(chao1、observed_species 指数比较P<0.001,shannon、simpson指数比较P<0.01,图3A~D);goods_coverage 两组间无显著性差异,表示两组肠道菌群测序深度合理(图3E)。主坐标分析(PCoA)显示两组之间肠道菌群结构呈现分离的状态(R2=0.5105,P=0.002,图3F),表明β 多样性存在显著性差异。上述数据均表示两组肠道菌群结构存在显著性差异。
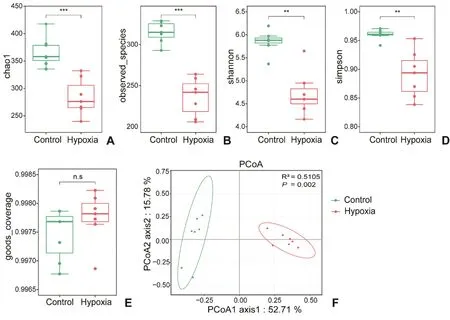
图3 小鼠肠道菌群多样性分析统计图A:chao1 指数B:observed species 指数C:shannon 指数D:simpson 指数E:goods coverage 指数 F:β 多样性主坐标分析(R2=0.5105,P=0.002) Hypoxia:低氧组Control:对照组* P<0.05,** P<0.01,*** P<0.001,与对照组比较n=7Fig.3 Statistical analysis histogram of gut microbiota diversity in miceA: Chao1 Index; B: Observed species Index; C: Shannon Index; D: Simpson Index; E: Goods coverage Index; F: The principal coordinate analysis of β diversity (R2=0.5105, P=0.002);Compared with the control group,*P<0.05,**P<0.01,***P<0.001, n=7
2.2.2 高原低氧对小鼠肠道菌群门水平影响 对照组和低氧组小鼠肠道菌群组成在门水平发生改变,对照组小鼠肠道菌群主要包括拟杆菌门(Bacteroidetes),厚壁菌门(Firmicutes),变 形菌 门(Proteobacteria)和放线菌门(Actinobacteria);而低氧组小鼠肠道菌群主要由拟杆菌门,厚壁菌门,疣微菌门(Verrucomicrobia)和变形菌门组成(图4A)。与对照组相比,低氧组小鼠肠道菌群中厚壁菌门与拟杆菌门的比值(F/B)降低(P<0.01,图4B)。
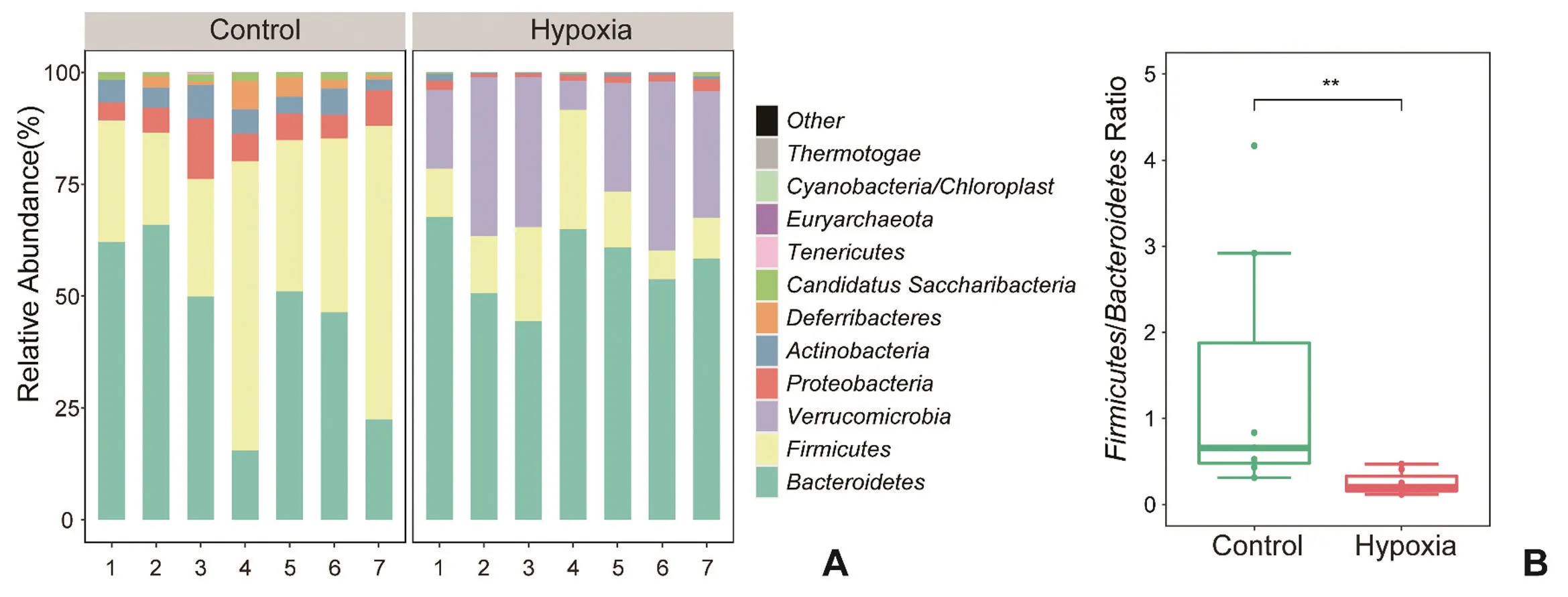
图4 小鼠肠道菌群门水平物种组成分布图A:两组小鼠肠道菌群门水平物种组成 B:两组小鼠厚壁菌门与拟杆菌门比值 Hypoxia:低氧组Control:对照组** P<0.01 n=7Fig.4 The composition of gut microbiota in mice at the phylum levelsA: Relative abundance at the phylum level of each group; B:The Firmicutes/Bacteroidetes ratio;**P<0.01, n=7
2.2.3 高原低氧对小鼠肠道菌群属水平影响 对肠道菌群进一步分析发现,水平相对丰度前10 的有艾克曼菌属(Akkermansia)、梭状芽胞杆菌 IV(Clostridium IV)、普雷沃氏菌属(Prevotella)、乳杆菌属(Lactobacillus)、拟普雷沃氏菌属(Alloprevotella)、螺杆菌属(Helicobacter)、另枝菌属(Alistipes)、梭状芽胞杆菌XlVa(Clostridium XlVa)、副萨特氏菌属(Parasutterella)和Barnesiella菌属(图5A)。LEFSe 差异分析结果显示,两组有21 个差异菌属。对照组中梭状芽胞杆菌IV、普雷沃氏菌属、Mucispirillum菌属、螺杆菌属、欧陆森氏菌属(Olsenella)、Intestinimonas菌 属、Romboutsia菌属、Saccharibacteria_genera_incertae_sedis菌属、脱硫弧菌 属(Desulfovibrio)、Rikenella、Dorea、拟杆菌 属(Bacteroides)、Butyricicoccus、Allobaculum、Paraprevotella菌属、Roseburia菌属和梭状芽孢杆菌XlVb 菌属增加,低氧组中艾克曼菌属、另枝菌属、肠杆菌属(Enterorhabdus)和瘤胃球菌属(Ruminococcus)增加(图5B)。
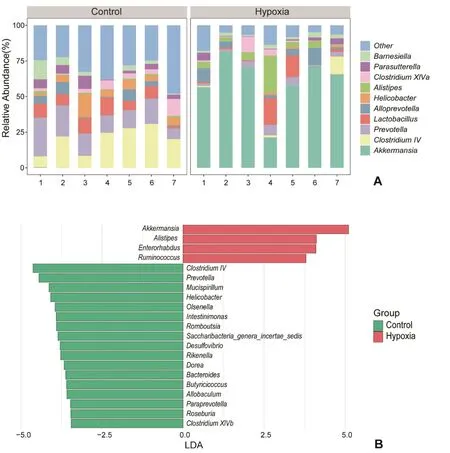
图5 小鼠肠道菌群属水平物种组成分布图及差异性物种分布图A:两组小鼠肠道菌群属水平物种组成分布图B:LEfSe 差异性分析两组小鼠肠道菌群属水平物种差异Hypoxia:低氧组Control:对照组n=7Fig.5 The species composition and differential species distribution of gut microbiota in mice at the genus levelsA: The relative abundance at the genus level of each group; B: LEfSe analysis of discriminative taxa of gut microbiota in mice at the genus levels; n=7
2.3 小鼠肠道菌群与行为学指标相关性分析
Spearman 相关性分析结果显示旷场实验中运动总距离,平均速度,中央区运动距离,中央区时间与α多样性指 数(chao1,observed species,shannon,simpson)无显著相关性。新物体识别中的DI 指数与chao1,observed species,shannon,simpson 指数存在显著性正相关,其R 值分别为0.657、0.705、0.574、0.604,P<0.05。水迷宫实验中小鼠在目标象限停留时间百分比与chao1,observed species,shannon,simpson 指数也存在显著性正相关,其R 值分别为0.591、0.749、0.688、0.710,P<0.05,见图6A。DI 指数与艾克曼菌属、另枝菌属呈负相关,且差异具有显著性,其R 值分别为-0.709、-0.604,P<0.05;与螺杆菌属、Roseburia菌属、Intestinimonas菌属、Rikenella菌属、梭状芽孢杆菌XlVb 菌属、脱硫弧菌属、Mucispirillum菌属、欧陆森氏菌属、梭状芽胞杆菌IV、Saccharibacteria_genera_incertae_sedis菌属呈正相关,且具有统计学意义,其R值分别为0.569、0.616、0.658、0.714、0.643、0.705、0.650、0.648、0.591、0.596,P<0.05。水迷宫实验中小鼠在目标象限停留时间百分比与艾克曼菌属、另枝菌属及瘤胃球菌属呈负相关,且具有统计学意义,R 值分别为-0.704、-0.560、-0.547,P<0.05;与螺杆菌属、Intestinimonas菌属、Rikenella菌属、梭状芽孢杆菌XlVb 菌属、脱硫弧菌属、Mucispirillum菌属、欧陆森氏菌属、梭状芽胞杆菌IV 呈正相关,且具有统计学意义,其R值分别 为0.6、0.602、0.668、0.570、0.640、0.608、0.587、0.569,P<0.05,见图6B。
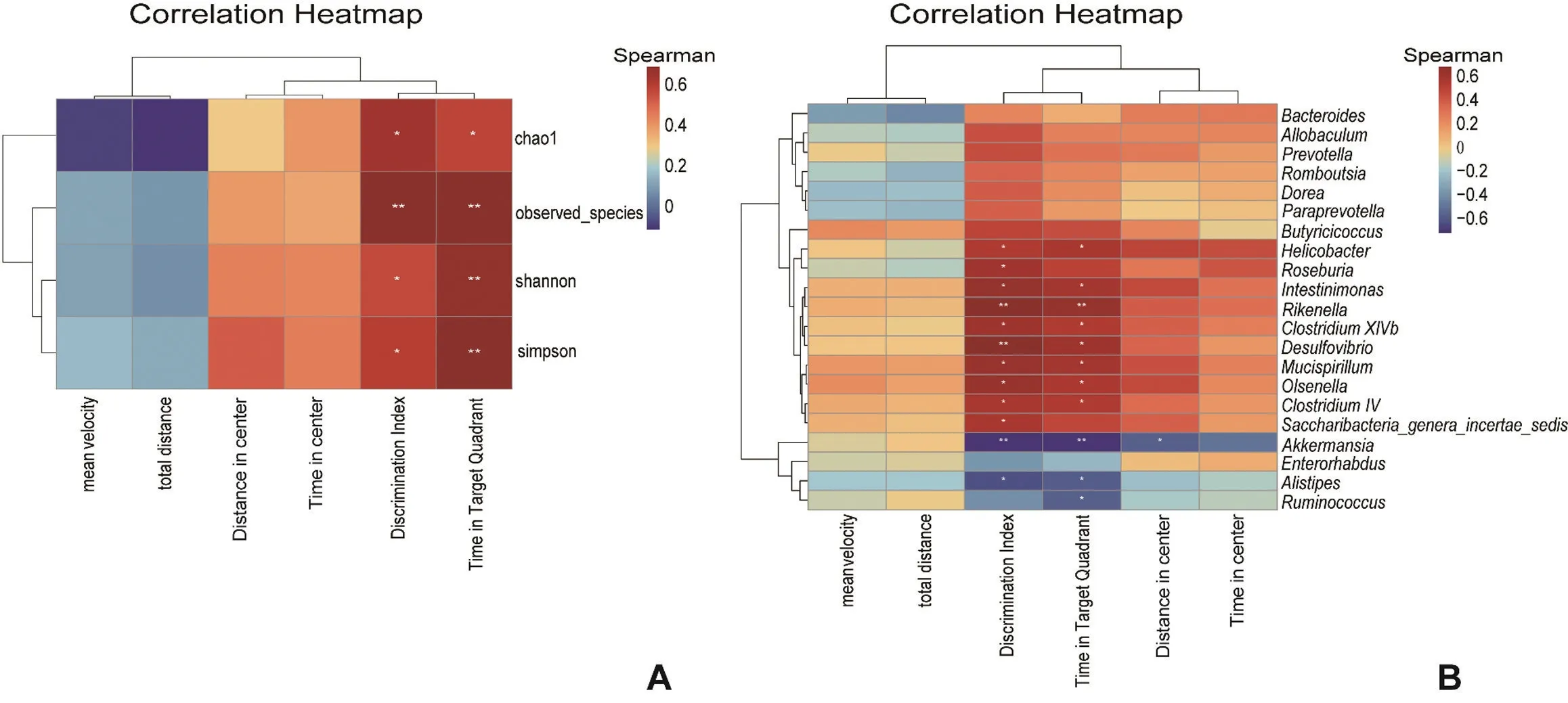
图6 小鼠肠道菌群与行为学相关性分析A:α 多样性与行为学相关性分析热图B:差异性肠道菌群与行为学相关性分析热图Hypoxia:低氧组Control:对照组* P<0.05,** P<0.01,与对照组比较n=7Fig.6 Correlations analysis between the gut microbiota at the genus levels and behavioral dataA: Heat map correlation analysis of mean velocity,total distance,distance in center,time in center(OFT),discrimination index(NOR) and time in target quadrant(MWM) and alpha diversity; B: Heat map correlation analysis of mean velocity,total distance,distance in center,time in center(OFT),discrimination index(NOR) and time in target quadrant(MWM) and discriminative taxa of gut microbiota at the genus levels;Compared with control group,*P<0.05,**P<0.01, n=7
3 讨论
低氧是高原环境的主要气候特点,机体长期处于这种环境可导致各系统功能紊乱。大脑具有较高的代谢率且缺乏抗氧化防御系统,对低氧更为敏感,更易受到低氧引起的损伤[11]。学习记忆能力下降是机体急进高原最常见的症状[12]。以往的研究证明高原低氧导致学习记忆能力损伤与氧化应激、谷氨酸兴奋毒性、胆碱能和肾上腺素能系统的改变、BDNF 抑制和线粒体功能障碍等多种机制密切相关[13~16]。然而,低氧对学习记忆能力的损伤机制异常复杂,仅以增加氧代谢为核心的治疗干预措施在急性期疗效尚可[17],在慢性期疗效甚微,从侧面证实了机体是以多系统共同参与低氧导致的学习记忆能力下降,其机制亟需进一步阐明。
越来越多的研究表明,肠道菌群通过“微生物-肠-脑轴”参与调控认知功能。现已证明肠道菌群在阿尔兹海默病、自闭症、抑郁症、精神分裂症和帕金森综合征等中枢神经系统疾病中发挥重要作用[7,18~22]。氧含量可以调节肠道上皮中需氧菌和厌氧菌之间的平衡。高原低氧可使肠道菌群多样性及结构发生改变,破坏肠道菌群的稳态[23]。菌群失调可能是高原低氧环境下学习记忆能力下降的关键调节因素,但目前关于此类研究尚少。
研究证实低氧暴露后小鼠的肠道菌群结构发生显著性改变,菌群多样性明显下降,F/B 比值下降,艾克曼菌、瘤胃球菌相对丰度增加[24]。同时,Ma 等[25]研究藏羚羊的肠道菌群,发现藏羚羊的肠道菌群相较于平原羚羊F/B 的比例更高,这可能是由于藏羚羊世居于高原,机体已经发生适应性的改变,抵抗外界恶劣环境的影响。本实验采用的是非本土动物,在高海拔的环境中可能经历一系列的生理变化,造成多系统损伤。进一步对肠道菌群的属水平分析结果发现低氧组中厌氧菌艾克曼菌属(Akkermansia)、另枝菌属(Alistipes)、瘤胃球菌属(Ruminococcus)、肠杆菌属(Enterorhabdus)的相对丰度增加,可能原因是高原低氧环境进一步加剧了机体缺氧程度,导致体内厌氧菌种群规模扩大。艾克曼菌属作为一种粘蛋白降解菌,主要存在于黏液层并在肠道中定植,将肠道粘蛋白降解成各种产物[26]。艾克曼菌属丰度增加与肠黏膜屏障受损有关[23]。高原环境下肠道屏障损伤,会导致细菌移位和局部或者全身炎症反应,可能引起大脑炎症反应影响学习记忆能力。另有研究表明在低压低氧暴露第1 d,另枝菌属相对丰度开始增加且随着暴露时间的延长其相对丰度一直高于对照组水平;而瘤胃球菌属的相对丰度在低氧暴露第14 d 开始增加并且之后持续增加[27],与本实验中低氧组另枝菌属、瘤胃球菌属相对丰度增加结果一致。
相关性分析结果表明艾克曼菌属、另枝菌属、瘤胃球菌属与学习记忆功能呈负相关,普雷沃氏菌属、梭状芽孢杆菌XlVb 菌属等菌属与学习记忆功能呈正相关。减肥术前后的受试者采用听觉学习词汇测验(auditory verbal learning test,AVLT)和Weschler 记忆量表的符号广度(the symbol span,SS)分别评定言语记忆和工作记忆,并且对其肠道菌群测序分析,结果发现减肥术后瘤胃球菌(Ruminococcaceae),普雷沃氏菌(Prevotella)与AVLT 得分提高显著相关,且SS 得分提高与普雷沃氏菌增多,艾克曼菌属减少有关[28],这与本次实验中对照组普雷沃氏菌丰度增加,低氧组艾克曼菌属丰度增加的结果一致。另枝菌属作为拟杆菌门种属的代表,在空间记忆受损的应激鹌鹑中相对丰度较高[29],另枝菌属的有害影响可能与肠道菌群失衡引起的肠道通透性有关,可增加有害物质例如脂多糖进入血液,导致神经炎症和行为的改变。
综上所述,高原低氧环境引起小鼠学习记忆能力下降与肠道菌群改变存在关联性。由此推断高原低氧环境造成肠道菌群失调可能是学习记忆功能损伤的关键因素,但高原低氧环境下肠道菌群影响大脑学习记忆功能的作用机制仍需要进一步的研究。下一步将以“微生物-肠-脑轴”为中心,探索高原低氧条件下肠道菌群是通过哪些途径作用于大脑造成记忆能力下降,探寻特异性肠道菌群和肠道菌群代谢物预防及治疗高原环境学习记忆能力损伤,为进驻高原环境人群提供可靠的研究基础。