基于SRAP标记的不同产区黄精的遗传多样性
李亚萍,戴惠明,姜 武,陈家栋,段晓婧,陶正明
(1.浙江农林大学 食品与健康学院 浙江省特色中药资源保护与创新利用重点实验室,浙江 杭州 311300;2.浙江省亚热带作物研究所,浙江 温州 325005;3.永嘉县自然资源和规划局,浙江 永嘉 325199)
黄精Polygonatumspp.的干燥根茎是常用的一味中药[1],具有补气养阴、健脾、益肾等功效,临床常用于脾胃气虚、胃阴不足、精血不足、腰膝酸软等证[2-3]。现代研究发现:黄精含有多糖、甾体皂苷、木质素等多种化合物,其中黄精多糖被认为是黄精主要的活性成分,可清除自由基,延缓衰老,降低血乳酸,缓解疲劳等。黄精多糖的降血糖和抗炎等多种作用相互协作,为研究治疗糖尿病提供了较好的思路。黄精药性平和,不仅具有多种药理作用,还有一定滋补作用,故在复方汤剂以及中成药的守正创新中具有较好的应用前景[4-5]。另外,黄精因具有独特风味和较好的口感,已被开发出多种保健食品,如黄精药膳、黄精酒、黄精饮料、黄精酸奶等[6]。随着大健康产业的发展,黄精保健食品的复合开发具有极大的市场潜力。
黄精品种多,适应能力强,分布广[7]。黄精遗传多样性保护与优良品种选育可以提高黄精品质与产量,促进黄精产业高质量发展。叶钱等[8]对多花黄精P.cyrtonema有效成分与主要环境因子的相关性进行研究,发现不同种源的多花黄精化学成分存在差异,这为进一步探讨黄精品质与环境因素之间关系提供了理论依据。
相关序列扩增多态性(SRAP)分子标记技术在植物遗传多样性方面研究应用较多,但在药用植物应用较少,如何首乌[9]。另有研究表明:SRAP 分子技术能较好地用于铁皮石斛Dendrobiumofficinale品种亲缘关系的研究[10],但此技术尚未见用于黄精遗传多样性分析。与之前研究使用的简单重复序列SSR 多态位点分析方法[11]、多态性分子标记(SCoT)方法[12]和简单序列间重复(ISSR)分子标记方法[13]、叶绿体基因联合序列分析[14]等技术相比,SRAP 分子标记技术以基因的开放阅读框 (open reading frames,ORFs)的特定区域进行扩增,具有简单、可靠、共显性高等特点[15]。本研究采用SRAP 分析技术对华东、西北、华中、西南4 个居群47 份黄精种质资源的遗传多样性进行研究,为黄精的遗传多样性与优良品种选育研究提供依据,以更好地保护和开发黄精种质资源。
1 材料与方法
1.1 材料
收集华东居群(浙江省、福建省、安徽省、江西省),西北居群(河北省、陕西省),华中居群(湖南省),西南居群(四川省、贵州省、云南省)的黄精干燥叶片,共47 份种质资源,各种质资源位置信息如表1所示。样品采集后置于密封袋中干燥保存,经浙江省亚热带作物研究所陶正明研究员鉴定后为多花黄精、长梗黄精P.filipes、黄精P.sibiricum、滇黄精P.kingianum。
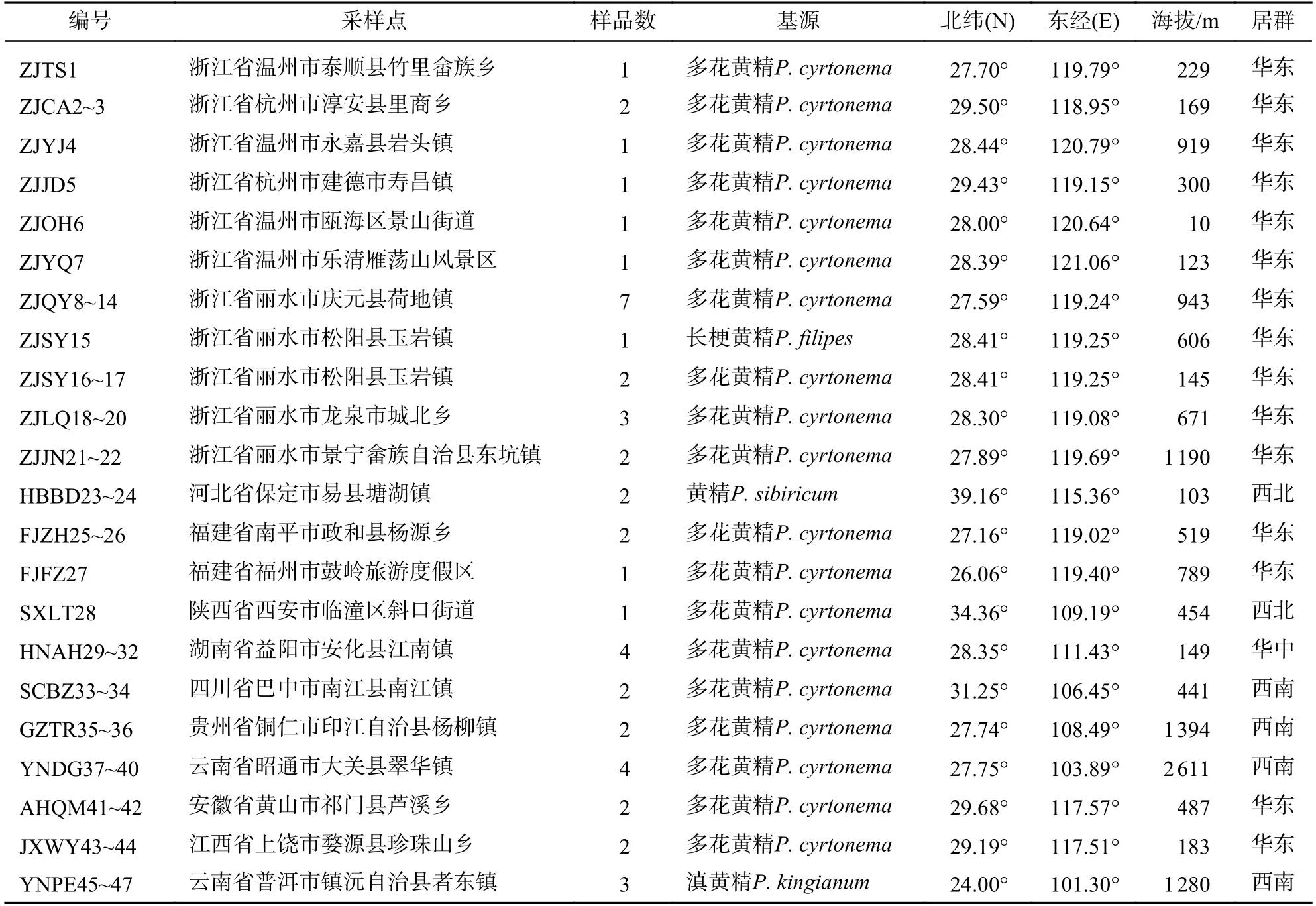
表1 黄精种质采集信息Table 1 Collected information of Polygonatum spp.
1.2 DNA 提取
将150~450 mg 叶片于液氮下研成粉末,采用杭州莱枫生物科技有限公司的plant DNAzol 试剂,逐一提取DNA 后用核酸蛋白分析仪测定其质量浓度及质量分数,均稀释至20 mg·L-1,于-20 ℃保存待用。
1.3 SRAP-PCR 扩增
PCR 反应体系参照文献[16]。具体为:12.5 μL 2×预混型Taq酶,1.0 μL 浓度为10 mmol·L-1的引物,模板DNA 40~60 ng,补水至25.0 μL。扩增程序为:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火52℃ 30 s,延伸72 ℃ 2 min,35 个循环后结束。72 ℃延伸7 min,4 ℃保存。电泳方法:反应产物5.0 μL,质量分数为1.2%聚丙烯酰胺凝胶电泳,5×TBE 缓冲液,150 V 跑胶 40 min,结束后凝胶成像系统拍照留存。
1.4 数据分析
由SRAP-PCR 电泳结果获得0/1 矩阵。使用PopGene version 1.32 进行数据分析,计算多态位点百分率(PPB)、等位基因数(Na)、有效等位基因数(Ne)、Nei’s 基因多样性指数(H)、Shannon’s 多态性信息指数(I)、Nei’s 基因分化系数(Gst)、居群总基因多样性(Ht)、居群内基因多样性(Hs)、基因流(Nm);使用Ntsys-PC 2.1 进行非加权组平均法(UPGMA)聚类分析。
2 结果与分析
2.1 SRAP-PCR 结果
88 对SRAP 引物中筛选出7 对扩增条带清晰且多态性明显的SRAP 引物。引物序列见表2。47 份样品共检测到159 条扩增条带,其中140 条为多态性条带,PPB 为88.05%。引物ME4/em3 扩增条带数最多,但其多态率最低,为68.29%。而引物ME5/em9、ME6/em4 两者多态性条带数与扩增条带数量一致,多态率为100.00%(表3,图1)。
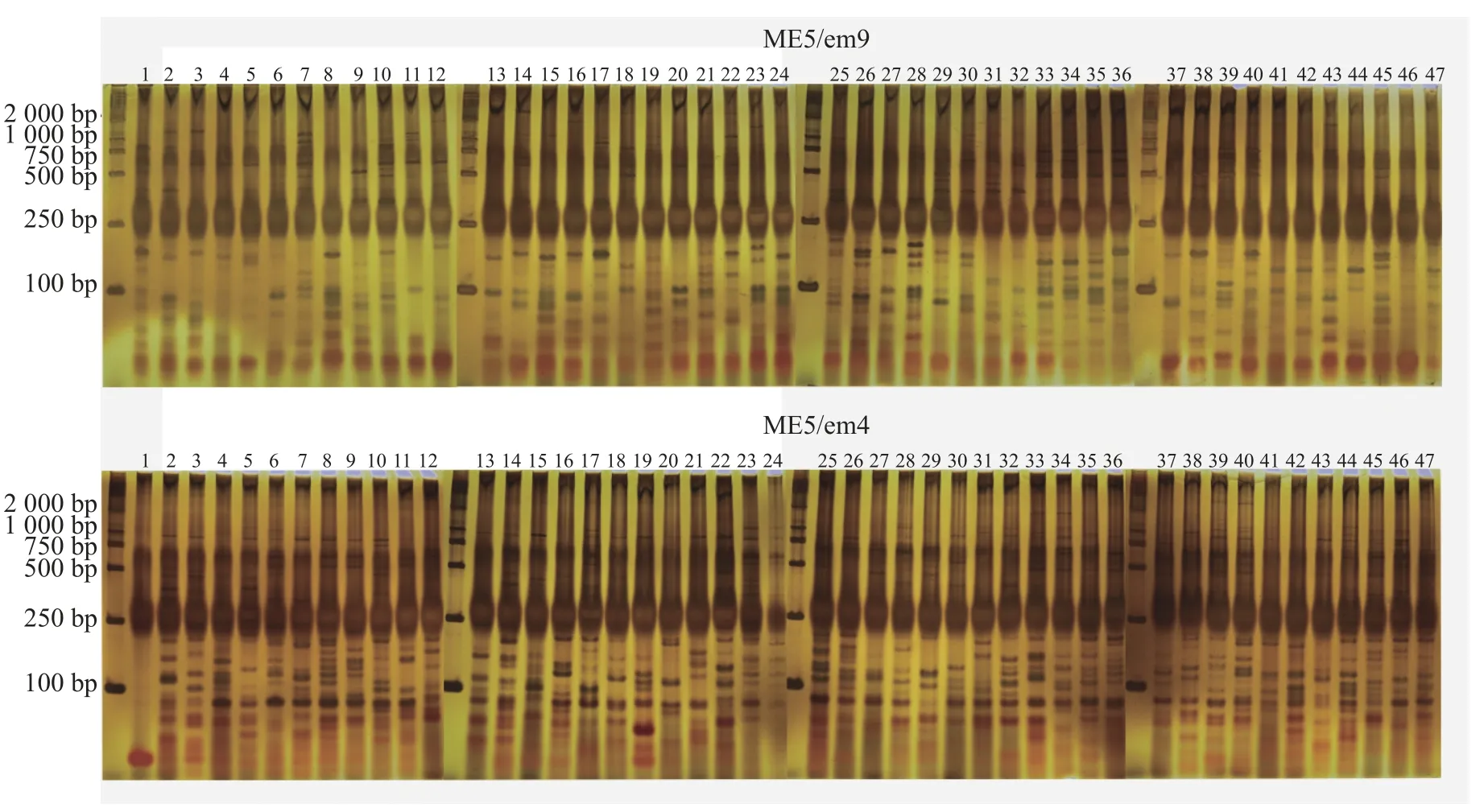
图1 引物ME5/em9 和ME6/em4 对47 份黄精种质资源总DNA 的扩增结果Figure 1 Amplification results of total DNA based on primer ME5/em9 and ME6/em4 from 47 samples of Polygonatum spp.
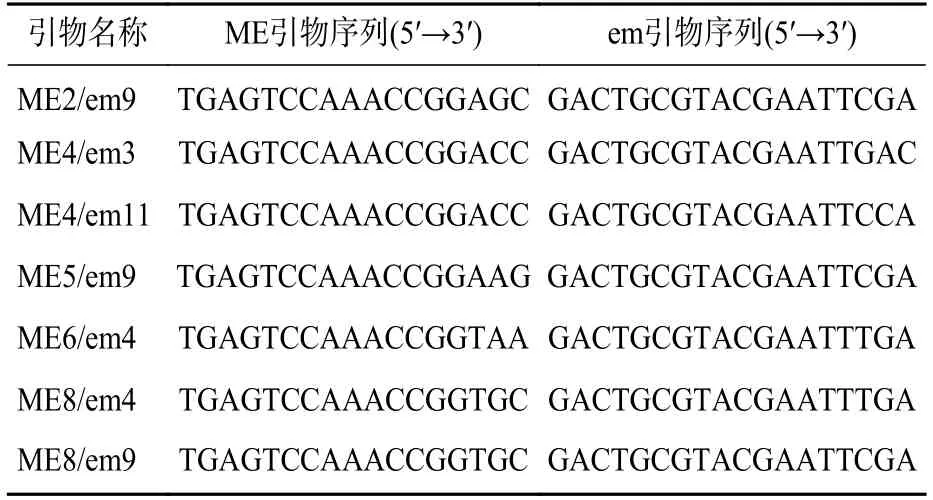
表2 SRAP 引物序列Table 2 Primer sequences for SRAP
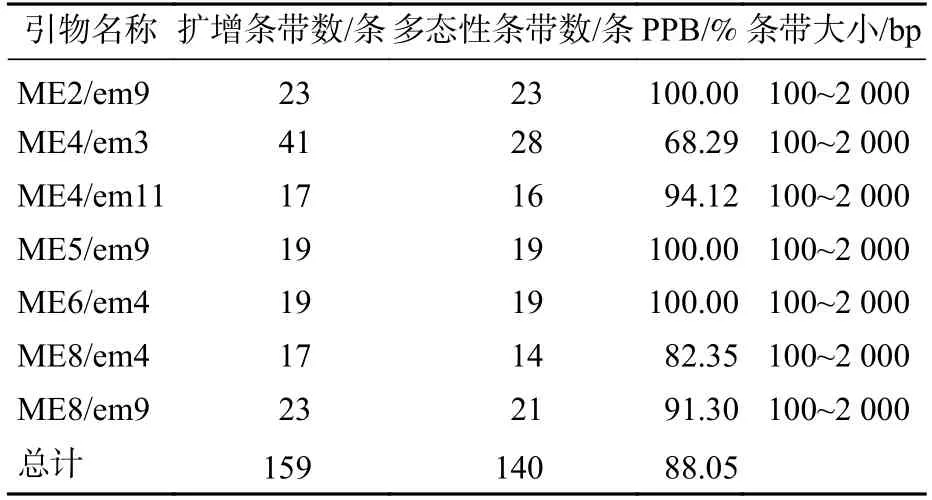
表3 SRAP 引物组合的扩增结果Table 3 Amplification results of combinated SRAP primers
2.2 遗传多样性分析
物种水平上黄精PPB 为88.05%,H为0.259 8±0.166 9,I为0.401 0±0.227 2 (表4),表明黄精有较高的遗传多样性和遗传变异度。居群水平上,Na为1.421 4~1.861 6,平均值为1.600 6;Ne为1.276 1~1.421 2,平均值为1.343 6;H为0.188 1~0.259 1,平均值为0.204 1;I为0.238 2~0.399 4,平均值为0.308 0;PPB 为42.14%~86.16%(表4),从高到低依次是华东居群、西南居群、华中居群、西北居群,表明华东居群遗传多样性丰富,遗传变异度较高。4 个黄精居群之间的Ht为0.253 3±0.029 4,Hs为0.204 1±0.020 1,基因分化系数Gst为0.194 1,即居群间遗传变异占居群遗传变异的19.41%,80.59%的遗传变异在居群内进行;种群间的遗传分化系数基因流Nm为2.075 4,表明居群间存在一定的基因流动。
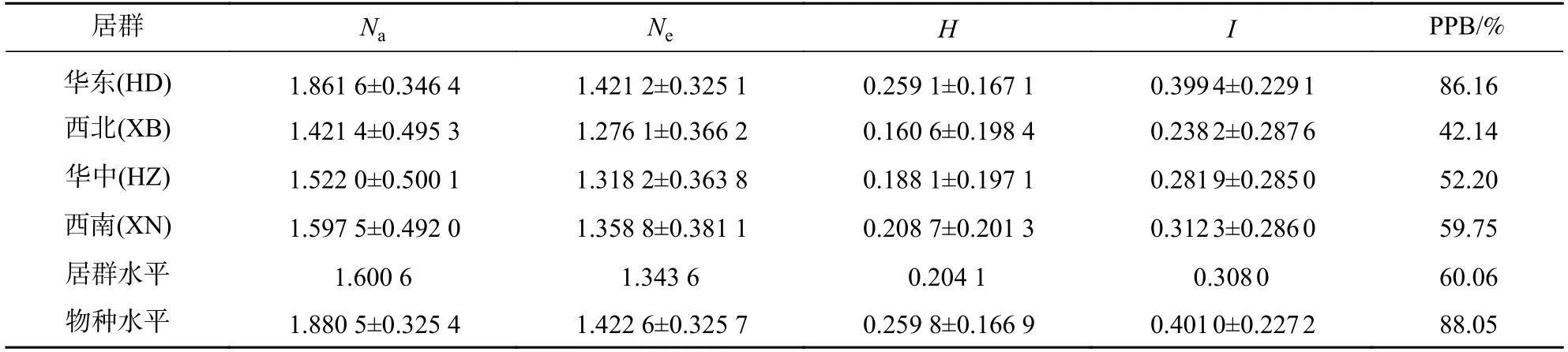
表4 黄精居群遗传多样性Table 4 Genetic diversity of Polygonatum spp.
2.3 聚类分析
对样品个体进行聚类分析(图2),47 份黄精种质资源的遗传相似系数为0.63~0.84。当相似系数为0.63,浙江泰顺种质资源单独聚为一类,表明此种质资源与其他黄精种质资源的遗传距离较远。当相似系数为0.66,聚为4 类,Ⅰ、Ⅲ、Ⅳ 类为浙江部分种质资源单独聚类,表明这些地区的黄精种质资源在亲缘关系上比较接近,可能与引种有关。当相似系数为0.68 时,Ⅱ类分聚为2 支,华东地区的安徽、江西与浙江龙泉、庆元、松阳部分种质资源以及少数华中居群聚为一支,另一支为华东地区的浙江景宁、庆元和松阳部分种质资源与多数华中、西南、西北居群聚类,西北居群与西南居群虽然地理差异大,但黄精种质资源之间的遗传距离相差并不大,种质资源之间亲缘关系较近,可能与黄精引种栽培有关。庆元地区是黄精种植开始较早的地方,因此种质引进种植比较多样,所以采集数量最多。由图2可以看出,庆元7 份种质资源分别聚为4 类:ZJQY8 和ZJQY13与ZJSY15、ZJLQ18~20、AHQM41~42、JXWY43~44 以及HNAH32 聚为一类;ZJQY11与ZJYQ7 聚为一类;ZJQY14 与ZJCA2~3、ZJOH6聚为一类;ZJQY9~10 和ZJQY 12 与部分华东、华中以及西北、西南种质资源聚为一大类,遗传多样性丰富。
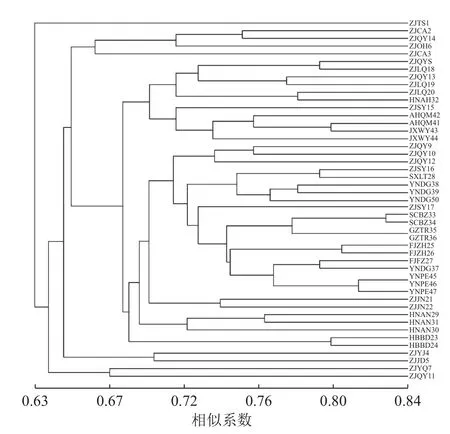
图2 基于SRAP 的黄精种质资源UPGMA 分析聚类图Figure 2 UPGMA dendrogram of Polygonatum spp.based on SRAP
对4 个居群的种质资源进行聚类,遗传相似系数为0.90~0.97 (图3)。相似系数为0.90 时,可分为2 类,华东居群、西南居群与华中居群聚为一类,西北居群单独为一类。
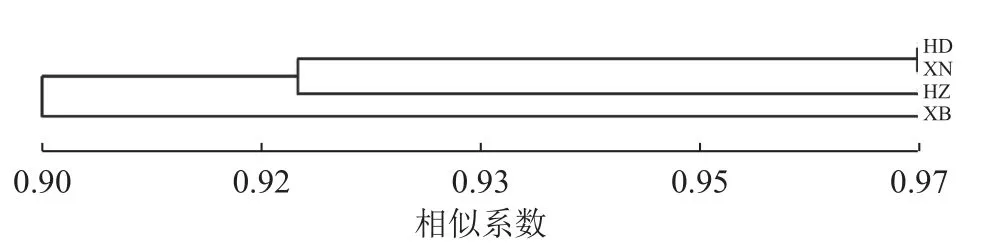
图3 基于SRAP 的黄精居群UPGMA 分析聚类图Figure 3 UPGMA dendrogram of Polygonatum spp.populations based on SRAP
3 讨论
遗传多样性是生物多样性的核心,是物种保持进化潜能的基本条件,也是优良品种选育的主要依据[17]。本研究采用SRAP 分子标记技术对47 份黄精种质资源进行分析,多态性比率为88.05%,表明黄精遗传多样性丰富,其中华东居群遗传多样性相对其他地区更丰富一些。推测有2 种原因:一是与地区采样量有关,二是华东地区黄精种质资源以多花黄精为主。多花黄精遗传多样性高于黄精[18]。相对于SRAP 分子标记方法,使用ISSR 方法,对福建多花黄精与长梗黄精多态性比率可达100%,使用SCoT 分子标记技术,多态性比率可达为99.6%[12-13]。从多态位点来看,另外2 种标记方法优于SRAP 技术。物种或者居群的遗传多样性越高,对环境变化的适应能力就越强。在本研究中,华东居群整体上遗传多样性高,与朱巧等[19]的研究结果相反。他们对60 份黄精种质资源进行SSR 分子标记分析,其结果为西部地区黄精种质资源遗传多样性最高,与黄精属起源中心为西南地区染色体基数较高有关,但结合居群聚类结果,华东与西南遗传相似系数最近,且聚为一类。这可能是因为黄精自西南引种之后,在华东地区对环境变化的适应力较强,保留了一定的遗传多样性,所以华东地区在黄精遗传多样性保护以及优良品种选育方面有一定的地理优势,可充分利用以促进黄精产业高质量发展。
遗传分化是指遗传多样性在居群内和居群间的分布[20]。本研究47 份黄精资源的Gst为0.194 1,表明80.59%的遗传分化发生在居群内,19.41%的遗传分化存在于居群间,居群内有较高的遗传分化。这一结果与籍蓉蓉[21]对安徽省多花黄精遗传变异研究结果一致,居群内变异要大于居群间变异。基因流大于1 时,表明居群间有一定程度的基因交流。本研究中黄精基因流Nm为 2.075 4,表明不同居群间存在一定的基因交流。黄精可自花授粉,也可借助昆虫等媒介进行异花授粉。对各种质资源的聚类分析发现:华东居群有较高的遗传多样性,这可能与引种其他地区黄精种质资源有关,引种在同一地区增加了不同居群间的基因交流,从而提高了黄精遗传多样性。
遗传距离能判断种质资源间遗传关系远近。云南普洱和贵州铜仁采集的黄精种质资源都有最小的遗传距离,遗传相似度高,亲缘关系较近,与刘新等[22]研究结果一致,相同或相近地区种质资源基本聚在一起,可能与黄精无性繁殖有关。浙江庆元黄精种质资源则不同,遗传距离远近不一,具有复杂的亲缘关系,这与庆元地区为早期种植黄精的地区,种质资源引进种植多样有关。浙江一带黄精种质资源有较为复杂的亲缘关系,这种复杂性增加了黄精的遗传多样性。浙江一带引种栽培较多,为各种质资源之间遗传交流提供基础,有助于优质黄精品种选育。

