两样本孟德尔随机化研究克罗恩病与玫瑰痤疮的因果关系
李晓健,陈施宇,陈小敏,黄李婷 ,尧鑫,邱桂荣,吴允波,刘中勇
玫瑰痤疮是一种以反复发作的毛细血管扩张、潮红或短暂肿块性变化、丘疹、持续性红斑、脓疱为特征的炎症性皮肤疾病,皮损主要分布在脸颊及鼻子部位[1]。这种红色的、布满粉刺的面部皮疹会使患者感到尴尬、自卑和焦虑,并可能导致其产生抑郁和污名化的感觉,给患者的生活质量造成严重的负面影响[2-3]。据报道[4],玫瑰痤疮在美国、欧洲、亚洲等地的发病率为1%~22%。关于玫瑰痤疮的发病机制尚无权威解释,目前大多数学者认为与先天免疫功能异常以及神经血管调节功能紊乱密切相关[5]。有趣的是,最近的研究[6]表明,玫瑰痤疮的发病与心血管、胃肠和精神疾病有显著的关联,肠道菌群可能会影响玫瑰痤疮的发病[7]。
克罗恩病(Crohn′s disease,CD)是一种影响胃肠道的慢性炎症性疾病,它可以引起从口腔到肛门的病变,并可能导致肠外并发症[8]。克罗恩病的发生主要与遗传因素与环境因素及黏膜相关黏附侵袭性大肠杆菌数量增加有关[9]。有学者[10]经病例对照研究发现,克罗恩病患者的玫瑰痤疮发病率比正常人高49%。来自Meta分析的数据证明玫瑰痤疮与克罗恩病之间存在显著的因果关系[11]。然而,临床观察研究容易受到统计或环境等偏移风险的影响。因此,克罗恩病与玫瑰痤疮各自发展过程中的因果双向作用仍存在争议。
为了进一步研究克罗恩病与玫瑰痤疮之间的因果关系、关联强度以及因果关系的方向,笔者使用了孟德尔随机化(MR)来进行研究。该方法由 Katan[12]于1986年提出,通过引入遗传变异作为工具变量的孟德尔随机化(MR)分析,可以评估暴露和结果之间的因果关系。其基本原理参照孟德尔第二遗传定律:等位基因是随机分配的,并且在受孕时是固定的。这个过程类似于传统RCT试验中患者被随机分配到治疗组和对照组。该方法利用遗传变异的随机分布来消除混杂因素,逆转因果关系,模拟随机对照试验的随机化过程,避免了传统随机对照试验中遇到的反向因果关联及潜在混杂因子的干扰[13]。
1 研究方法与资料
1.1研究设计 本研究将克罗恩病作为暴露因素,与克罗恩病显著相关的单核苷酸多态性作为工具变量,玫瑰痤疮则作为结局变量。使用两样本MR分析的方法进行因果关联分析,利用 CochranQ检验进行异质性检验,最后对所得结果进行敏感性分析以验证其可靠性。为了筛选出合适的工具变量进行双样本MR分析,本文采用了以下三个关键假设:①工具变量与克罗恩病之间存在显著的关联;②工具变量与克罗恩病-玫瑰痤疮关联的所有混杂因素均不相关;③工具变量只能通过与克罗恩病的关联影响结局[14]。见图1。
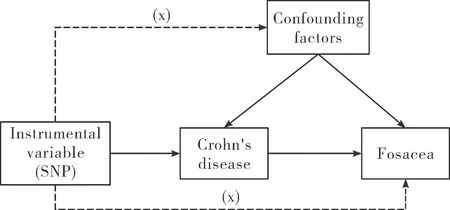
图1 MR分析的关键假设图
1.2数据来源 从网站(https://gwas.mrcieu.ac.uk)获得了关于克罗恩病和玫瑰痤疮遗传数据。这是一项来自欧洲生物信息研究中心(EBI)的数据,其中包括40 266名欧洲男女后裔,SNP数量为9 457 998。玫瑰痤疮的遗传数据则来自于芬兰数据库(The Finn Gen Biobank),其中包括212 334名欧洲男女后裔,SNP数量为16 380 452。由于所有使用的数据都已在公共领域,因此不需要额外的伦理批准。研究人群的遗传背景均来自欧洲血统,以避免因种族相关混杂因素造成的偏差。基本信息见表1。

表1 两样本MR研究中 GWAS 数据库的基本信息
1.3工具变量 选择汇集与克罗恩病具有显著意义(P<5.0×10-8,F>10) 的 SNPs,设置参数r2阈值为0.001,千碱基对(kb)为10 000,以排除连锁不平衡(LD)的干扰[15]。异质性检验剔除显著异质性 SNPs,最后得到与克罗恩病显著相关的有效SNPs 作为工具变量。
总F计算公式为:
(1)
其中N为所纳入克罗恩病患者的样本量,K为数据库中SNPs的个数,R2为克罗恩病数据库中由SNPs解释的变异所占的比例。
R2的计算公式为:
(2)
单个SNP的公式为:
(3)
其中EAF为效应等位基因频率,SE为标准误,SD为标准差,β为等位基因效应值[16]。
1.4孟德尔随机化分析 使用了R version 4.1.2中的“TwoSampleMR”包进行MR分析。首先对每个SNP进行关联,计算出每个SNP的Wald比值,再运用逆方差加权法(inverse variance weighted,IVW)方法对Wald比值进行合并以评估克罗恩病与玫瑰痤疮之间的关联。此外采用MR-Egger回归法、加权中位数法(weighted median,WME)对得出的MR结果进行验证以及稳定性检验。本研究采用的逆方差加权法主要是将每一个工具变量方差的倒数作为权重进行加权计算,这一过程是在保证所有工具变量都是有效的前提下进行,以此来评估水平多效性[17];MR-Egger回归法则是使用结局方差的倒数作为权重来进行拟合,它在回归的同时加入截距项[18]。加权中位数法(weighted median,WME)[19]是定义为比率估计值的加权经验密度函数的中位数,当无效工具变量比例高达50%且工具变量间估计的精度差异较大时,WME仍然能提供一致的效应估计值。
1.5敏感性分析 本研究采用留一法(Leave-one-out)、MR-Egger法对结果进行可靠性评价。MR-Egger法指的是当MR-Egger截距项与0差异很大时,说明此时存在水平多效性[20]。留一法主要是依次剔除每个SNP,然后计算剩下所有SNP的结果,当某个MR结果和总结果无显著统计学差异,则说明该SNP不会对效应估计结果产生非特异性影响[21]。
2 结果
2.1工具变量 在排除连锁不平衡后,获得了18个 SNP,这便是本次研究的工具变量,其基本信息见表 2。其中Position和CHR表示基因的位置和染色体信息;EAF表示效应等位基因频率;EA/OA表示等位基因;β为克罗恩病相关SNP的效应量;SE是β值的标准误;P值表示SNP与克罗恩病的关联程度;F值是用来评估弱工具变量效应的统计量。本次研究单一 SNP 对应的F统计量分布范围为30.54~436.43,F值均>10,这表明结果不存在弱IVs偏倚,说明本结果可靠。
2.2孟德尔随机化分析 结果IVW法结果[OR=1.11(95%CI:1.01~1.22),P=0.03<0.05]表明,基因预测克罗恩病与玫瑰痤疮的风险显著相关,也就是说将克罗恩病的基因数据对数变换后每降低一个标准差,则导致玫瑰痤疮的发病风险增加10%,且差异有统计学意义。WME分析结果也证明克罗恩病的玫瑰痤疮患病风险增高,差异有统计学意义[OR=1.15(95%CI:1.00~1.31),P=0.04<0.05],见图2~3。

图2 MR分析森林图
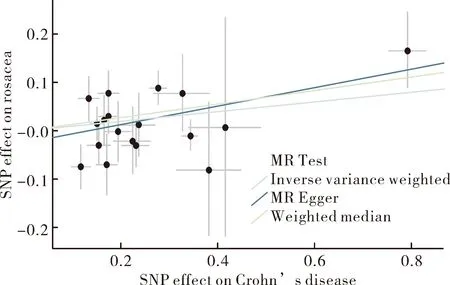
图3 MR分析结果图
2.3敏感性分析 经CochranQ检验表明,IVW(P=0.33>0.05)和 MR-Egger回归(P=0.34>0.05)并不存在异质性。MR-Egger的egger_intercept结果为(P=0.37>0.05),与0比较差异无统计学意义,这表明本研究结果不存在水平多效性。漏斗图结果表明当逐个以SNP为变量时,因果关联效应的散点基本呈对称分布,结果不存在潜在偏倚(图4)。 “Leave-one-out”敏感性分析,结果显示依次剔除各SNP后,剩余的17个 SNPs的 IVW分析结果与纳入全部 SNPs的分析结果相近,未发现对因果关联估计值影响较大的 SNPs(图5)。
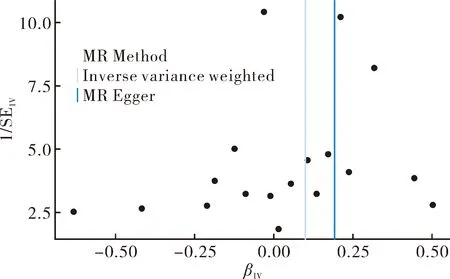
图4 MR漏斗图
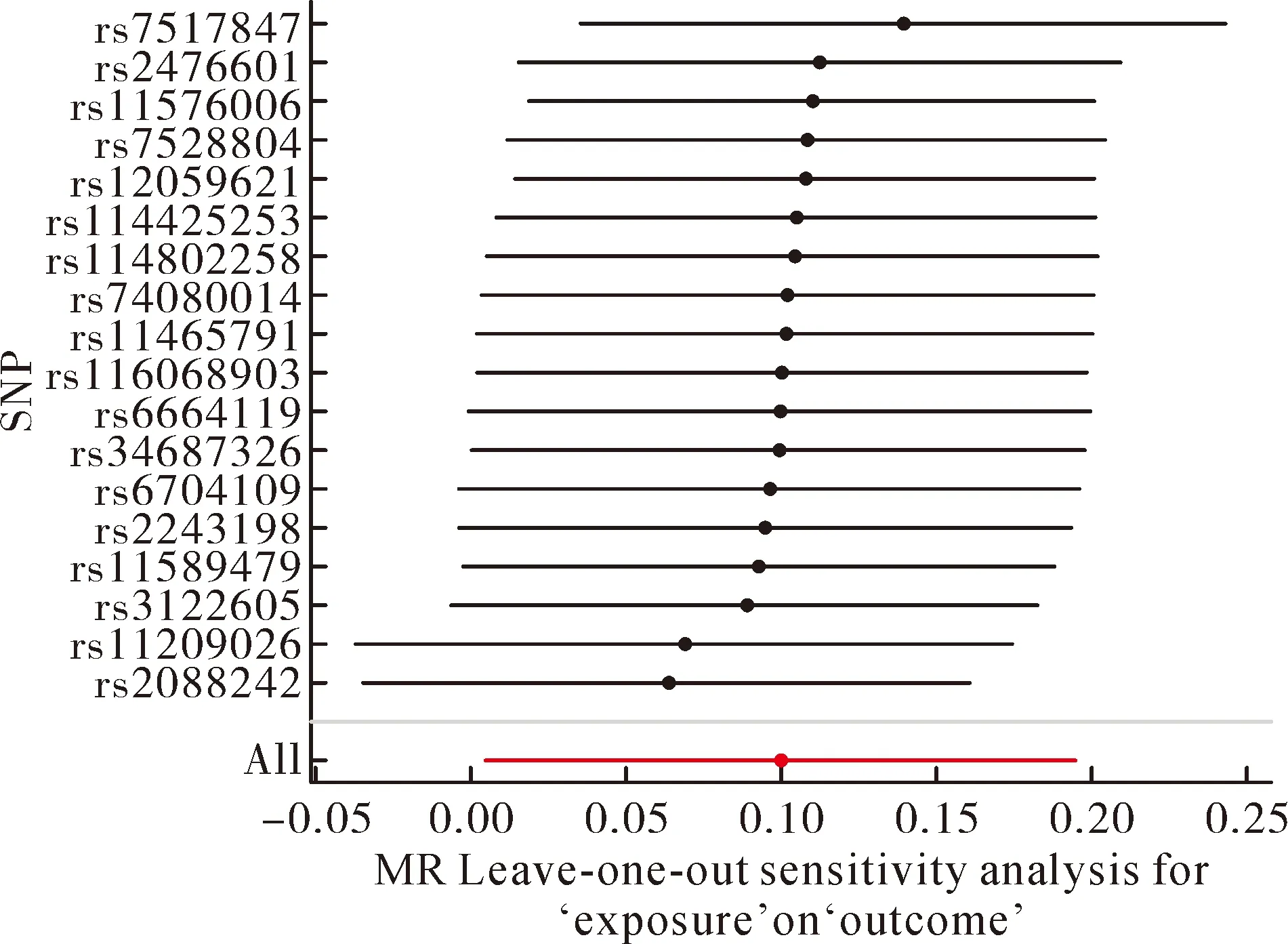
图5 “留一法”敏感性分析结果
3 讨论
明确玫瑰痤疮的病因对其预防、诊断和治疗具有重要意义。本次研究是国内首次运用孟德尔随机化系统评估克罗恩病与玫瑰痤疮发病风险之间因果关系的研究。IVW法[OR=1.11(95%CI:1.01~1.22),P=0.03<0.05]与WME分析[OR=1.15(95%CI:1.00~1.31),P=0.04<0.05]结果表明,基因预测克罗恩病患者的玫瑰痤疮患病风险将会增加,多种敏感性分析进一步证实了两种疾病之间的因果关系。
以往的观察性研究已经证明克罗恩病等炎症性肠病会增加玫瑰痤疮的患病风险。来自英国临床实践研究数据链的一项大型回顾性病例对照研究[22]指出,克罗恩病患者发生玫瑰痤疮的概率将会提升49%[OR=1.49(95%CI: 1.25~1.77)],特别是在克罗恩病相关胃肠道炎症增加的阶段。Kim等[23]在美国进行了一项包含40 843例炎症性肠病患者的横断面研究,证明克罗恩病患者的玫瑰痤疮发生概率高于白癜风、银屑病等其他炎症性皮肤病。来自一项针对韩国人口的全国性横断面研究也证明,玫瑰痤疮的发病与克罗恩病等炎症性肠病密切相关[24]。与之前的研究结果一致,笔者使用MR研究发现,克罗恩病患者的遗传易感性大约会增加11%玫瑰痤疮的感染风险。
关于克罗恩病增加玫瑰痤疮患病风险的具体机制尚不清楚,目前多数学者认为与炎症相关。玫瑰痤疮作为一种高发病率的皮肤疾病,很可能有全身起源,亦或者说是一种全身疾病风险增加的标志[25]。报告显示,玫瑰痤疮患者血清中C反应蛋白水平升高明显[26],而C反应蛋白正是全身炎症、氧化介质不平衡的标志。有趣的是,C反应蛋白也是研究得最好的克罗恩病的炎症非侵入性生物标志物之一[27]。除此之外,克罗恩病与玫瑰痤疮还有些共同的致病炎症因子,例如白介素1b(IL-1b)和肿瘤坏死因子α(TNF-α),以及基质金属蛋白酶(MMPs),这些炎症因子在病理上共同导致了玫瑰痤疮和克罗恩病的发生发展[11,28]。这有可能是克罗恩病增加玫瑰痤疮患病风险的机制。
经留一法发现,rs7517847的变异可能是克罗恩病影响玫瑰痤疮发病的关键所在。rs7517847最靠近的基因是IL-23R,这是一个已经被大量数据证实的炎症性肠病相关基因[29]。IL-23R是编码IL-23受体的一个亚基,由p19、p40两个亚基组成,同时也是多种免疫相关性皮肤病的易感位点,例如银屑病、白塞病[30-31]。IL-23已被证明能刺激T辅助17细胞(Th17)增殖,并增加炎性细胞因子如IL-1、IL-6、IL-17和TNF-α的产生[32]。值得注意的是,玫瑰痤疮的发病同样与Th1/Th17通路的激活密切相关。有学者对玫瑰痤疮患者的面部活检进行了免疫组织化学及转录分析,发现了大量Th1/Th17极化免疫细胞主导的T细胞反应以及产生的IFN-γ、IL-17等炎症因子[33]。这在一定程度上与笔者的猜想一致,即克罗恩病影响玫瑰痤疮的发病关键在于IL-23R的变异。
据报道,阻断IL-23信号通路是克罗恩病的一种有效的治疗策略。Mannon等[34]进行了一项双盲随机对照试验,发现接受了抗IL-12治疗的患者中,临床症状得到有效改善,且患者结肠固有层单个核细胞分泌的IL-12、IFN-α和TNF-α显著减少。Weinstock[35]的一项对克罗恩病合并玫瑰痤疮的回顾调查发现,在使用利福昔明的基础上加入阿达木单抗后,克罗恩病和玫瑰痤疮完全缓解的速度比单独使用利福昔明更快。该研究加入阿达木单抗对患者病情的改善证明TNF-α在克罗恩病和玫瑰痤疮的双重发展中发挥了重要作用。由此笔者提出猜想:阻断IL-23信号通路或许可以达到治疗克罗恩病合并玫瑰痤疮患者的治疗和预防目的。
当然本研究还存在一些局限性:第一,纳入研究的样本均是来自于欧洲血统,往后还需亚洲、非洲等其他人种的样本进行扩大研究;第二,获得的数据来自于GWAS汇总数据,因此无法排除因患者饮酒、熬夜等因素[36]的影响;第三,克罗恩病提高玫瑰痤疮发病率的具体机制尚不清楚,后期还需进一步对笔者的猜想进行验证研究。
综上所述,本研究使用孟德尔随机化研究发现,克罗恩病与玫瑰痤疮的发生存在因果关联,rs7517847的变异可能是克罗恩病影响玫瑰痤疮发病的关键所在。因此对于克罗恩病的患者应该注意及时用药阻断治疗,预防玫瑰痤疮的发生。对于克罗恩病合并玫瑰痤疮的患者,阻断IL-23信号通路或许可以达到改善和治疗目的。

