黄连素通过KLF4 减轻缺血/再灌注损伤所致的大鼠心肌细胞凋亡的作用机制研究
陈晨 林科 王恺婧 吴圣杰
心肌梗死是致残率和致死率均较高的心血管疾病之一,相关严重并发症可降低患者的生活质量,增加经济负担[1]。目前普遍认为缺血/再灌注(ischemia/reperfusion,I/R)损伤参与心肌梗死的病理、生理过程[2]。而体内外实验也表明,氧化应激、炎症、细胞凋亡、自噬和细胞病理过程等可能在机体I/R 损伤中起着关键作用[3-4]。但是,目前关于I/R 损伤的分子和细胞病理学机制尚未完全阐明,可供临床使用的有效药物也有待进一步研究。黄连素(berberine,BBR)是一种具有强大生物活性的生物碱[5]。最新研究证实,BBR 可以通过调节炎症反应、线粒体自噬,从而保护细胞免受高血糖或高脂血症所致的损伤[6-7]。Yu等[8]研究表明,BBR 能通过抑制核因子-κB(nuclear factor kappa-B,NF-κB)、JNK 通路来减轻心肌I/R损伤。然而,BBR 是一种多位点化合物,具有一定的组织特异性[9],因此这种保护功能的潜在机制较为复杂,可能存在其他潜在因素参与BBR 减轻心肌I/R 损伤的过程。KRUPPEL 样因子4(Kruppel-like factor 4,KLF4)是一种进化比较保守的含锌指转录因子,可作为上皮-间充质转化、炎症反应和细胞凋亡的关键调控因子[10],可能参与心肌I/R 损伤的生理及病理过程。然而,目前尚无相关研究探讨KLF4 与BBR 功效机制的联系。因此,本研究利用心肌I/R 损伤的成熟细胞模型验证BBR 对I/R 损伤的保护作用,并探讨KLF4 是否参与保护心肌细胞的过程,现将结果报道如下。
1 材料和方法
1.1 细胞和试剂 大鼠永久心肌细胞系H9C2 细胞购自上海生物化学和细胞生物学研究所。盐酸BBR 水合物(CASNO.141433-60-5,纯度98%)购自上海阿拉丁生化科技公司;杜尔贝科改良Eagle110培养基(Dulbeco modified Eagle110 medium,DMEM)、胎牛血清、青霉素、链霉素均购自美国Gibco 公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自杭州连科生物科技有限公司;原位末端转移酶标记法(terminal deoxynucleotidyl transferase-mediated dutp-biotin nick end labeling assay,TUNEL)检测试剂盒购自江苏碧云天生物技术公司;双铬酸蛋白检测试剂盒购自美国Thermo 公司;抗Bcl-2 相关X蛋白(Bcl-2 associated X protein,Bax)(批号:ab32503)、抗B 淋巴细胞瘤-2 基因(B lymphoblastoma-2 gene,Bcl-2)(批号:ab32124)、抗KLF4(批号:ab215036)、抗β-actin(批号:ab8227)均购自英国Abcam 公司;Trizol 试剂购自美国Thermo 公司。
1.2 细胞培养和分组处理 将H9C2 细胞接种于含10%胎牛血清、100 U/mL 青霉素和100 U/mL 链霉素的DMEM 中,置于含5%CO2的37 ℃湿化孵化器中进行细胞传代培养。将培养获得的3~15 代H9C2 细胞按随机数字表法分为4 组,即对照组、I/R组、BBR 组、KLF4 小干扰RNA(small interfering RNA,siRNA)组。除对照组经饥饿处理24 h 后,置于完全培养基中培养4 h,其余3 组均诱导体外I/R 模型,具体参考文献[11-12](将密度约60%的传代培养H9C2 细胞置于无血清的DMEM 中饥饿处理24 h,随后置于5%CO2和95%N2混合气体充填的缺氧室中孵育;缺氧处理1 h 后,将H9C2 细胞转移至含95%O2和5%CO2的培养箱中3 h;再次给氧前,更换新鲜培养基)。在此基础上,BBR 组在诱导I/R 模型期间给予50 μmol/L BBR 作用4 h;KLF4 siRNA 组在诱导I/R 模型前转染KLF4 siRNA,诱导I/R 模型期间给予50 μmol/L BBR 作用4 h。
1.3 细胞活力检测 采用CCK-8 法。在96 孔板中加入200 μl CCK-8 溶液,在按2.0×104个/孔加入H9C2 细胞,37 ℃避光持续孵育3 h。使用美国Thermo Fisher 酶标仪于450 nm 波长下测定吸光度(optical density,OD)值。细胞活力=OD 值样品/OD 值对照。
1.4 细胞凋亡情况检测 (1)采用TUNEL 染色法。H9C2 细胞经4%多聚甲醛固定1 h,在经3%H2O2孵育染色20 min,置于37 ℃进行TUNEL 染色1 h。在光镜下观察凋亡细胞并拍照记录,计算膜阳性面积百分比。(2)采用流式细胞术。H9C2 细胞经冷磷酸盐缓冲液洗涤3 次,加入5 μL 异硫氰酸荧光素标记的膜联蛋白V(Annexin V)和1 μL 碘化丙啶(propidium iodide,PI)工作液(100 μg/mL)在室温下避光孵育15 min。使用双激光流式细胞仪分析细胞凋亡情况,采用美国BD 公司ModFit 软件进行细胞凋亡率的估计。
1.5 Bax、Bcl-2、KLF4 蛋白表达水平检测 采用蛋白质印迹法。将H9C2 细胞置于4 ℃下的RIPA 裂解液(含1/1 000 蛋白酶抑制剂苯甲基磺酰氟)中处理30 min,提取总蛋白,使用双铬酸蛋白检测试剂盒进行定量检测。将等量的蛋白裂解物装入10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳中,并转移到聚偏二氟乙烯膜上。细胞膜在含0.05%吐温20 和5%脱脂牛奶的Tris 缓冲液中封闭1.5 h;随后将聚偏二氟乙烯膜与特定的一抗(包括抗Bax、抗Bcl-2、抗KLF4 和抗β-actin)在4 ℃下孵育过夜。再将聚偏二氟乙烯膜与适当的二抗在室温下复温1 h。使用增强化学发光系统进行条带可视化处理,使用Bio Rad 凝胶成像系统进行扫描,使用Quantity One v4.62软件进行分析,使用Image J 1.38e软件进行蛋白质印迹分析,计算Bax、Bcl-2、KLF4 蛋白表达水平。
1.6 KLF4 mRNA 表达水平检测 采用实时定量逆转录-聚合酶链反应。使用Trizol 试剂从H9C2 细胞中分离总RNA。使用two-step M-MLV Platinum SYBR Green qPCR SuperMix-UDG 试剂盒进行实时荧光定量逆转录-聚合酶链反应。引物由美国Invitrogen 公司合成并获得。KLF4 的引物序列:正向为5'-CAAGTCCCGCCGCTCCATTACCAA-3',反向为5'-CCACAGCCGTCCCAGTCACAGTGG-3'。以βactin 为内参基因,采用2-ΔΔCt法计算KLF4 mRNA 表达水平。
1.7 统计学处理 采用Graph Pad Prism 7.0 统计软件。计量资料多组间比较采用单因素方差分析,两两比较采用Tukey 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组H9C2 细胞活力比较 3 组H9C2 细胞药物处理48 h 后细胞活力比较,差异有统计学意义(P<0.05),其中BBR 组细胞活力明显高于I/R 组(P<0.05),见图1。
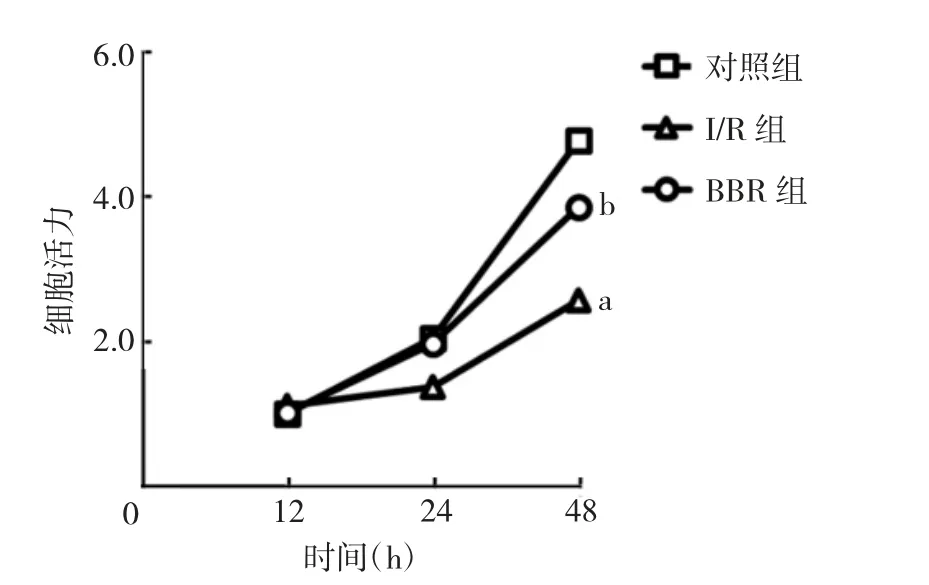
图1 3 组H9C2 细胞活力比较
2.2 3 组H9C2 细胞凋亡因子蛋白表达水平比较3 组H9C2 细胞凋亡因子Bax、Bcl-2 蛋白表达水平比较,差异均有统计学意义(均P<0.05),其中BBR组Bax 蛋白表达水平明显低于I/R 组(P<0.05),Bcl-2蛋白表达水平明显高于I/R 组(P<0.05),见图2。
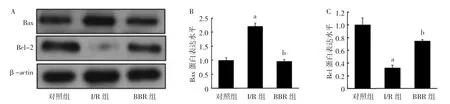
图2 3 组H9C2 细胞凋亡因子蛋白表达比较(A:电泳图;B:Bax 蛋白表达水平比较;C:Bcl-2 蛋白表达水平比较;与对照组比较,aP<0.05;与I/R 组比较,bP<0.05)
2.3 3 组H9C2 细胞凋亡情况比较 TUNNEL 染色结果显示,BBR 组、I/R 组、对照组膜阳性面积百分比分别为(23.0±5.6)%、(45.0±7.3)%和(16.0±3.3)%,差异有统计学意义(P<0.05);其中BBR 组明显低于I/R 组(P<0.05),见图3A-B(插页)。流式细胞术实验结果显示,BBR 组、I/R 组、对照组细胞凋亡率分别为(15.3±1.4)%、(30.5±2.4)%和(9.3±1.3)%,差异有统计学意义(P<0.05);其中BBR 组明显低于I/R 组(P<0.05),见图3C-D(插页)。
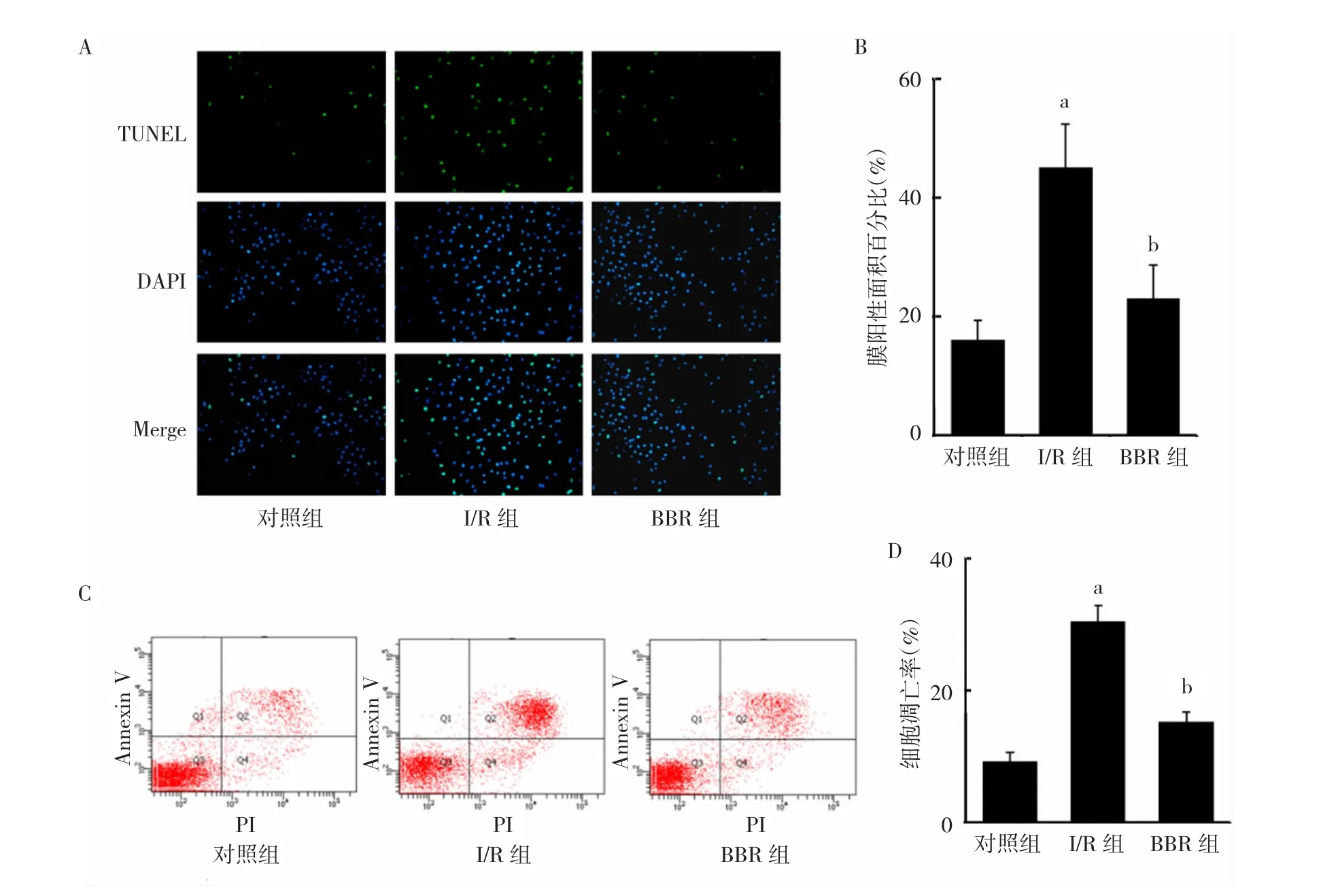
图3 3 组H9C2 细胞凋亡情况比较(A:TUNNEL 染色结果,×200;B:膜阳性面积百分比比较;C:流式细胞术实验结果;D:细胞凋亡率比较;与对照组比较,aP<0.05;与I/R 组比较,bP<0.05)
2.4 3 组H9C2 细胞KLF4 蛋白和mRNA 表达水平比较 3 组H9C2 细胞KLF4 蛋白和mRNA 表达水平比较,差异均有统计学意义(均P<0.05),其中BBR 组、对照组均明显高于I/R 组(均P<0.05),见图4。

图4 3 组H9C2 细胞KLF4 蛋白和mRNA 表达水平比较(A:电泳图;B:KLF4 蛋白表达水平比较;C:KLF4 mRNA 表达水平比较;与对照组比较,aP<0.05;与I/R 组比较,bP<0.05)
2.5 KLF4 沉默对BBR 心肌细胞保护作用的影响I/R 组、BBR 组、KLF4 siRNA 组细胞活力、膜阳性面积百分比、细胞凋亡率比较,差异均有统计学意义(均P<0.05);其中BBR 组细胞活力明显高于I/R组(P<0.05),膜阳性面积百分比和细胞凋亡率均明显低于I/R 组(均P<0.05);而KLF4 siRNA 组细胞活力明显低于BBR 组(P<0.05),膜阳性面积百分比和细胞凋亡率均明显高于BBR 组(均P<0.05),见图5(插页)。
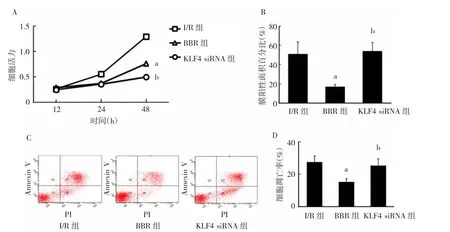
图5 KLF4 沉默对BBR 心肌细胞保护作用的影响(A:细胞活力比较;B:膜阳性面积百分比比较;C:流式细胞术实验结果;D:细胞凋亡率比较;与I/R 组比较,aP<0.05;与BBR 组比较,bP<0.05)
3 讨论
心肌I/R 损伤被认为是心肌缺血后发生损伤的主要机制[2]。研究表明,炎症反应、自噬、细胞凋亡和焦亡、氧化应激、钙超载等机制均参与该病的生理及病理过程[13]。Cummins 等[14]研究发现,在I/R 损伤过程中,NF-κB 激活将导致持续炎症反应,并导致细胞凋亡。另有研究表明,细胞凋亡是由于缺血区活性氧积累导致的[15]。本研究证实I/R 损伤可导致严重的细胞凋亡,如Bcl-2、Bax 蛋白表达水平发生了明显变化,细胞凋亡率明显升高。
BBR 被证实对阿尔茨海默病、癌症、糖尿病、冠心病以及许多其他慢性病治疗有效[16]。近年来关于BBR 对慢性缺血性疾病(特别是I/R 损伤)的保护作用,引发了广泛而持续的关注。Zhu 等[17]研究表明,BBR 能够改善小鼠的I/R 损伤。此外,BBR 也有利于急性肾I/R 损伤的恢复[18]。有趣的是,在心脏I/R损伤中也发现了BBR 具有类似的治疗效果[19-22]。本研究发现,BBR 可以部分逆转I/R 诱导的心脏损伤,包括降低细胞凋亡率、下调Bax 蛋白表达水平、上调Bcl-2 蛋白表达水平。关于BBR 保护作用的机制,已有不少研究作了探讨。Huang 等[23]报道BBR 可以过度抑制自噬,这可能是介导此现象的潜在机制。Wang 等[24]研究发现I/R 损伤大鼠模型出现线粒体功能受损和细胞凋亡障碍,包括基质金属蛋白酶过表达、Bcl-2 及Bax 蛋白表达水平失衡等,而BBR 可以削减上述现象,从而改善I/R 损伤大鼠的心功能。体外研究表明,BBR 可以通过激活Smad7 来改善I/R 损伤[9]。本研究引入了一个关键性凋亡相关转录因子KLF4,以探讨BBR 保护作用的潜在机制。已有文献报道KLF4 作为关键转录因子,与I/R 损伤过程中的细胞凋亡高度相关[25-26]。本研究结果发现,KLF4 在经BBR 处理的I/R 损伤的心肌细胞中过表达,且沉默KLF4 可抑制BBR 对I/R 损伤所诱导细胞凋亡的保护作用,这与预期相符。Lin 等[27]研究表明,BBR 可以抑制鼠前脂肪胚胎成纤维贴壁细胞中miR-92 的表达。Ji 等[28]研究结果发现,miR-92 是下调细胞中KLF4 表达水平的主要因子。因此,笔者推测BBR 可能通过抑制miR-92 的表达,从而上调KLF4 在心肌细胞中的表达。
综上所述,BBR 可以通过KLF4 依赖的方式保护心肌细胞免受I/R 损伤所致的细胞凋亡。但本研究也存在一定的局限性,由于缺乏临床样本和体内实验,在一定程度上削弱了这一结论,今后将进一步深入研究明确。

