AGTR1(A1166C)基因多态性对高血压患者检验指标的影响*
余汉忠,李磊,董勃,孔倩倩,钮威,张凯,魏书瑶,方路,王丽(.徐州医科大学附属徐州市立医院检验科,江苏徐州 6;.徐州市肿瘤医院检验科,江苏徐州 005)
原发性高血压(EH)被认为是环境和遗传因素相互作用的结果,约30%的个体间血压变异性由遗传因素决定[1]。EH是心血管疾病、中风和肾脏等疾病最常见的危险因素[2-3]。肾素—血管紧张素—醛固酮系统(RAAS)在血压调节中具有重要作用,并且与EH发病密切相关[4]。血管紧张素Ⅱ受体是RAAS重要的成员之一,主要分为以下2种类型:1型(AGTR1)受体和2型(AGTR2)受体。AGTR1基因由位于染色体3q上的5个外显子组成,其中前4个外显基因编码5′-非翻译区(5′-UTR),最后1个外显基因编码3′-非翻译区(3′-UTR)的多态性,导致腺嘌呤(A)在1 166位的碱基转换为胞嘧啶(C)[5]。AGTR1(A1166C)基因多态性(SNP ID:rs5186)在心血管系统中发挥血管收缩、平滑肌细胞生长和细胞肥大等重要作用,受主要信号机制调控,并参与调控EH患者的血压水平。笔者通过分析徐州地区AGTR1基因多态性与EH的关系,探讨AGTR1(A1166C)基因多态性与EH患者临床检验指标水平的关联,以期为EH的个性化诊疗提供实验依据。
1 材料和方法
1.1一般资料 选取2022年1月至12月徐州市第一人民医院心血管内科确诊的240例EH患者(EH组)作为研究对象,男145例,女95例,年龄(53.2±13.4)岁。均根据中国高血压防治指南(2018 年修订版)[6]诊断为EH。纳入标准:(1)收缩压≥140 mmHg和(或)舒张压≥90 mmHg;(2)首次诊断后2个月内3次偶测血压值均符合上述标准。同时具备以上2条即可纳入病例组,且患者未服用任何抗高血压药物。排除标准:继发性高血压患者,患严重的肝肾疾病,血液系统疾病,恶性肿瘤,自身免疫性疾病以及近期有手术、外伤和严重感染者。另选取同期本院体检健康者180例作为健康人对照组,男95例,女85例,年龄(52.23±8.87)岁。本研究获徐州市第一人民医院医学伦理委员会审核批准(No.xyyll-2021-098),各研究对象知情同意。
1.2仪器与试剂 CFX96型核酸扩增仪(美国Bio-Rad公司),AU5821全自动生化分析仪(美国贝克曼库尔特公司),cobas E801化学发光分析仪(德国罗氏公司),Snibe MAGluMI X8化学发光分析仪(深圳新产业公司)。血液基因组提取试剂盒、AGTR1(A1166C)基因检测试剂盒(PCR-荧光探针法)购自武汉友芝友医疗科技公司,肾素活性(PRA)、血管紧张素2(AT2)、醛固酮(ALD)测定试剂盒(化学发光法)购自深圳新产业生物医学工程股份公司,TSH、FT3、FT4测定试剂盒(电化学发光法)购自德国罗氏公司,TC(酶法)、AST(MDH法)、ALT(乳酸脱氢酶法)、T-Bil(重氮盐法)、D-Bil(重氮盐法)、TBA(酶循环法)、Ure(尿素酶-谷氨酸脱氢酶法)检测试剂盒购自江苏贝克曼库尔特实验系统公司,TG(终点法)、HDL-C(终点法)、LDL-C(终点法)、apo A1(透射比浊法)、apo B(比浊法)、Lp(a)(乳胶增强免疫比浊法)、apo E(免疫比浊法)、ALP(NPP底物-AMP缓冲液法)、GGT(速率法)、UA(尿酸酶-过氧化物酶法)、Glu(己糖激酶法)购自南京东软威特曼生物科技公司,NEFA(酶法)购自上海睿康生物科技公司,sdLDL-C(过氧化物酶法)购自北京安图生物工程公司,ADA(过氧化物酶法)、AFU(CNPF底物法)购自北京利德曼生化股份公司,CG(均相酶免疫法)购自苏州博源医疗科技公司,Cr(肌氨酸氧化酶法)、CysC(乳胶增强免疫比浊法)、FMN(四氮唑蓝法)、IMA(清蛋白有限钴结合法)、Hcy(酶循环法)购自宁波瑞源生物科技公司。
1.3标本采集 使用促凝管采集EH患者住院第1天和体检健康者体检时晨起空腹(禁食8~12 h)静脉血5 mL,4 000 r/min离心5 min,分离血清,检测生化、甲状腺相关指标,另取EDTA-K2抗凝血5 mL检测PRA、AT2指标,取肝素抗凝血5 mL检测ALD含量。血清样本置于-20 ℃保存。
1.4血液基因组DNA提取 按照血液组DNA提取试剂盒说明书进行DNA提取,蛋白质核酸分析仪检测DNA的浓度及纯度,选取吸光度比值(A260 nm/A280 nm)在1.6~2.1,浓度0.5~50 ng/μL之间的样本用于后续试验。DNA样本置于-20 ℃保存。
1.5引物设计及AGTR1(A1166C)基因多态性检测AGTR11166 A-C引物与探针由武汉友芝友医疗科技公司设计并合成,其上游引物序列(AGTR1-F):5′-CATTCCTCTGCAGCACTTCAC-3′,下游引物序列(AGTR1-R):5′-AGAAAAGTCGGTTCAGTCCAC-3′。PCR总反应体系为25 μL,包括5×buffer 5 μL、MgCl2(1 mol/L) 0.125 μL、dATP(100 mmol/L) 0.037 5 μL、dCTP(100 mmol/L) 0.037 5 μL、dGTP(100 mmol/L) 0.037 5 μL、dUTP(100 mmol/L) 0.075 μL、AGTR1-F(100 μmol/L) 0.05 μL、AGTR1-R(100 μmol/L) 0.05 μL、AGTR1-WP(100 μmol/L) 0.13 μL、AGTR1-MP(100 μmol/L) 0.065 μL、ICON-F1(100 μmol/L) 0.015 μL、ICON-R1(100 μmol/L) 0.015 μL、ICON-ROX-P1(100 μmol/L) 0.012 μL、DMSO 0.5 μL、BSA(100 mg/mL) 0.05 μL、50%甘油(加入反应体系后的终浓度为4%) 2 μL、TaKaRa Taq Hot Start酶 0.1 μL、UNG酶 0.05 μL、ddH2O 14 .650 5 μL、DNA模板2 μL。PCR循环参数:37 ℃ UNG处理10 min;95 ℃ 预变性5 min,95 ℃ 变性15 s,60 ℃退火及延伸1 min,共40个循环。于每个循环的延伸阶段各采集1次荧光信号,用Bio-Rad CFX Manager 3.1软件进行分析。每个样本检测3个复孔。结果判读标准:FAM通道Ct值≤36且VIC通道Ct值>36或无Ct值,判定为AGTR1基因A/A型;FAM通道Ct值≤36且VIC通道Ct值≤36,判定为AGTR1基因A/C型;FAM通道Ct值>36或无Ct值且VIC通道Ct值≤36,判定为AGTR1基因C/C型。
1.6临床检验指标检测
1.6.1生化指标检测 按照贝克曼AU5821全自动生化分析仪及相应试剂盒说明书检测EH患者AST、ALT、T-Bil、D-Bil、TBA、Ure、TC、TG、HDL-C、LDL-C、apo A1、apo B、apo E、Lp(a)、 ALP、GGT、UA、Glu、NEFA、sdLDL-C、ADA、AFU、CG、Cr、CysC、FMN、IMA、Hcy等生化指标。各指标的参考区间:AST 0~50 U/L、ALT 0~50 U/L、T-Bil 5~21 μmol/L、D-Bil 0~3.40 μmol/L、TBA 0~13 μmol/L、Ure 2.80~7.60 mmol/L、TC 3.00~5.70 mmol/L、TG 0.34~1.70 mmol/L、HDL-C 1.04~1.67 mmol/L、LDL-C0~3.12 mmol/L、apo A1 1.00~1.60 g/L、apo B 0.60~1.10 g/L、Lp(a) 0~300 mg/L、apo E 2.90~5.30 mg/L、ALP 30~120 U/L、GGT 8~57 U/L、UA 154.70~428.40 μmol/L、Glu 4.30~5.90 mmol/L、NEFA 0.10~0.60 mmol/L、sdLDL-C 0.26~1.36 mmol/L、ADA 4~18 U/L、AFU 14.30~39.90 U/L、CG 0~2.70 mg/L、Cr 35~97 μmol/L、CysC 0~1.16 mg/L、FMN 1.70~2.50 mmol/L、IMA 0~78 U/mL、Hcy 4.00~15.40 μmol/L。
1.6.2RAAS及甲状腺功能指标检测 按照Snibe MAGluMI X8化学发光分析仪及相应试剂盒说明书检测EH患者PRA、AT2、ALD水平;应用罗氏cobas E801化学发光分析仪及配套试剂盒说明书进行TSH、FT3、FT4测定。各指标的参考区间:PRA 0.10~6.56 ng/mL.h、AT2 50~120 pg/mL、ALD 70~300 pg/mL、TSH 0.27~4.20 μIU/mL、FT3 3.10~6.80 pmol/L、FT4 12~22 pmol/L。

2 结果
2.1各研究对象一般资料比较 EH患者和体检健康者在性别、年龄、身高、体重指数等组间差异均无统计学意义(P>0.05),EH组收缩压和舒张压均高于健康人对照组(P<0.05),见表1。
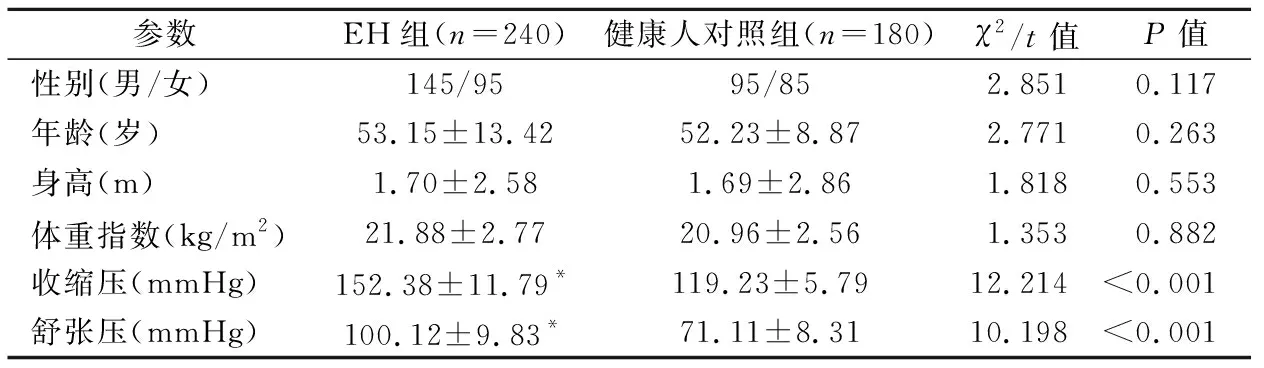
表1 EH患者和健康人对照组一般资料比较
2.2PCR-荧光探针法检测AGTR1(A1166C)基因型AGTR1(A1166C)基因纯合野生型A/A、杂合型A/C、纯合突变型C/C的基因检测结果见图1。AGTR1(A1166C)基因型及基因位点频率分布:EH组AA型199例,AC型36例,CC型5例;健康人对照组AA型165例,AC型15例,无CC型检出。EH组等位基因A频率为90.42%,等位基因C频率为9.58%,健康人对照组等位基因A频率为95.83%,等位基因C频率为4.17%,2组间差异具有统计学意义(χ2=24.815,P<0.05),提示具有AC/CC基因型的个体更易罹患EH。
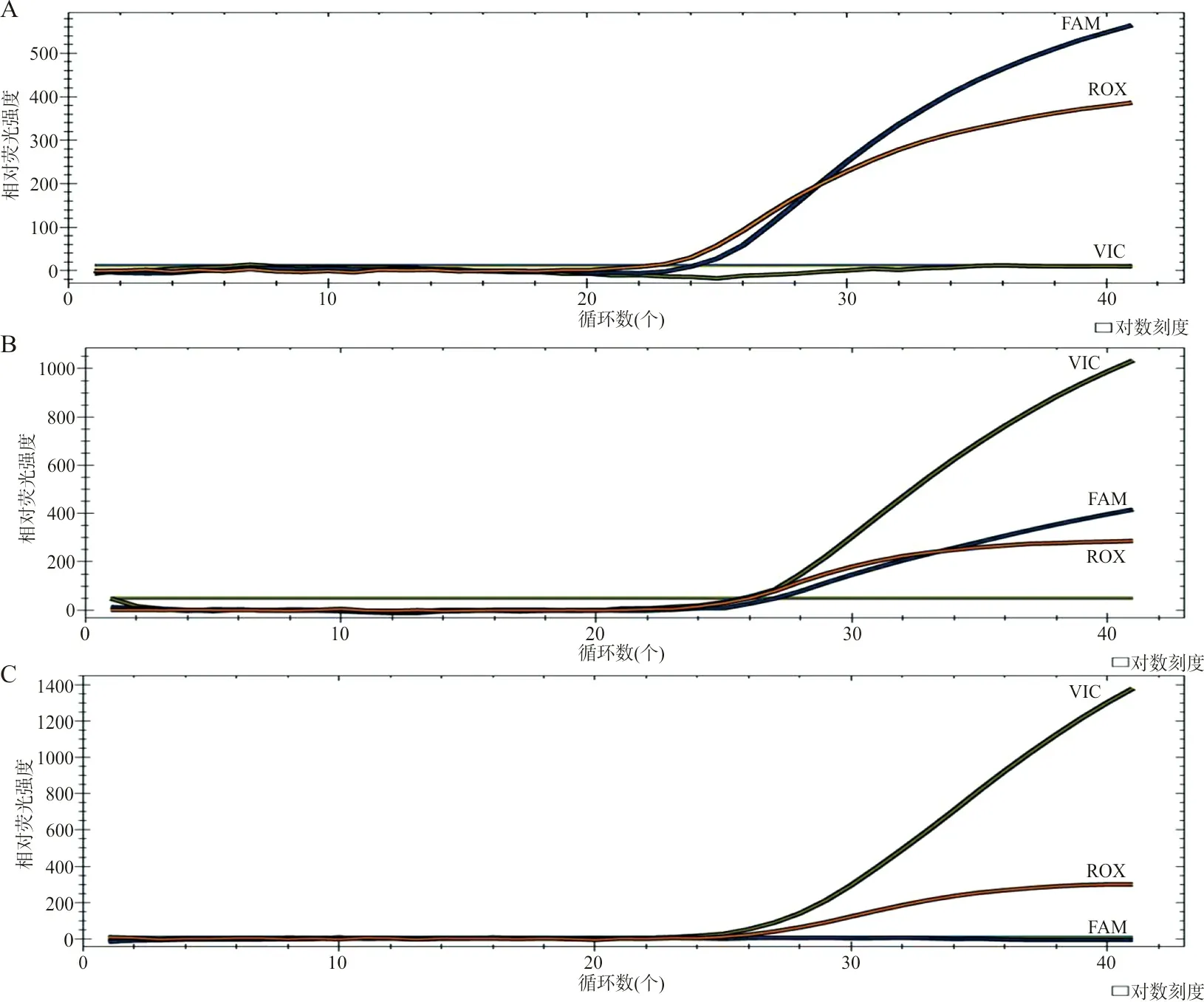
注:A,AA基因型(纯合野生);B,AC基因型(杂合突变);C,CC基因型(纯合突变)。图1 AGTR1(A1166C)基因检测结果
2.3各临床检验指标在2组中的比较结果 EH患者AC/CC组PRA、ALD、Lp(a)项目均高于AA组[PRA:Z=2.216,P=0.029;ALD:t=2.406,P=0.017;Lp(a):t=2.406,P=0.021];其余检验项目在2组间的差异均无统计学意义(P>0.05),见表2、表3。

表2 EH患者AGTR1(A1166C)基因对RAAS及甲状腺功能指标的影响
3 讨论
EH是我国最常见的慢性疾病之一,严重危害国人生命健康,其发病与遗传变异、环境和其他因素的相互作用有关。AGTR1基因A1166C多态性与EH之间的关系仍存在争议,AGTR1与EH检验指标关联的研究更是鲜有报道。因此,笔者认为有必要进一步揭示AGTR1A1166C多态性与EH发生、发展的关联。
目前已有大量研究探讨了AGTR1基因多态性在EH复杂病因中的作用。例如Deepak等[7]报告AGTR1C基因变异赋予EH 1.74倍的风险,可能作为影响家庭高血压易感性的预测标志物。Chen等[8]的研究结果显示AGTR1A1166C基因多态性在正常对照组和高血压患者之间未发现明显的相关性。罗洁等[9]研究了湖南汉族患者以及孙晓燕等[10]研究了河南汉族人群,均证实携带AGTR1C型基因的人群患高血压的危险性增加。因此,笔者选择测定EH患者AGTR1基因A1166C多态性的基因型频率,以评估该多态性变异对高血压发生、发展的影响。结果发现AGTR1(A1166C)基因型及基因位点频率分布在2组间的差异具有统计学意义(P<0.05),表明徐州地区具有AC/CC基因型的个体更易患EH,与上述研究者的结果相一致。
本研究还探讨了徐州地区人群AGTR1多态性对常规检验指标的影响,并通过大量的检验数据分析,以期揭示AGTR1(A1166C)基因多态性与临床检验指标水平的关联。结果发现EH患者AC/CC组PRA、ALD水平均高于AA组(PRA:Z=2.216,P=0.029;ALD:t=2.406,P=0.017),提示AGTR11166 C基因突变可能上调了EH患者PRA、ALD水平。RAAS与多种心血管疾病的发生有关,AGTR1基因是RAS系统的关键基因,与高血压的发生、发展密切相关[11]。本研究结果显示EH患者AGTR11166 C基因突变存在对血脂代谢的影响,EH患者AC/CC组Lp(a)高于AA组(t=2.406,P=0.021),表明AGTR11166 C基因突变同时上调了血清Lp(a)水平。血脂代谢在高血压的进展中发挥着巨大的作用,其中Lp(a)主要在肝细胞内合成,与动脉粥样硬化和血栓形成有着密切的相关性。另有研究发现,高心血管疾病风险的EH患者血清Lp(a)颗粒浓度、质量浓度高于低风险患者[12]。本研究表明,AGTR11166 C基因突变可能通过调节PRA、ALD水平参与了高血压的进展,或可能通过调节Lp(a)水平参与动脉粥样硬化的进程。已有研究提示AGTR1A1166 C多态性与缬沙坦等抗降压药物的降压效果显著相关,AGTR1C等位基因在缬沙坦的治疗下能够更好地控制高血压[13-14]。而携带C基因的高血压患者血清PRA、ALD、Lp(a)含量明显高于非携带者,这提示临床医师在高血压的诊疗过程中,PRA、ALD及Lp(a)含量偏高的患者有必要优先选择缬沙坦等血管紧张素Ⅱ受体拮抗剂进行治疗。笔者同时对EH患者的其他检验指标进行汇总分析,结果发现AGTR11166 C基因突变对AT2、TSH、FT3、FT4、TC、AST、ALT、T-Bil、D-Bil、TBA、Ure、TG、HDL-C、LDL-C、apo A1、apo B、apo E、ALP、GGT、UA、Glu、NEFA、sdLDL-C、ADA、AFU、CG、Cr、CysC、FMN、IMA、Hcy均无明显影响。
综上所述,AGTR1(A1166C)基因多态性在心血管系统中发挥着重要的生理作用,AGTR1基因多态性能够对EH的发生、发展起到调节作用。但由于 EH 发病机制极其复杂,一些潜在的混杂因素可能尚未完全概括,如饮食习惯、日常锻炼、吸烟和饮酒等。若要进一步确定AGTR1基因多态性对EH的影响机制,尚需更为深入的临床研究,如扩大检测样本量,基因联合分析,观察受试者用药前后血压和检验指标的变化等,才能得到更为全面的结果。

