基于网络药理学和实验验证探讨肠安Ⅱ号方中白芍-白术药对治疗肠易激综合征的作用机制
吴亚宁,周辉辉,田雅晴,袁佳楠,程堃铭,郑咏秋,2
(皖南医学院 1.中药学教研室;2.安徽省皖南地区植物药活性筛选与再评价工程实验室,安徽 芜湖 241002)
肠易激综合征(irritable bowel syndrome,IBS)是临床常见的一种以慢性腹痛或不适及排便习惯改变为主要特征的功能性肠病[1]。流行病学调查显示,全球人口IBS患病率高达10%~15%[2]。目前,临床治疗IBS药物常用的解痉剂、肠道动力感觉调节剂、益生菌或抗抑郁药物仅能针对性改善症状,存在治疗上的局限性[3]。而中医药因其具有整体调节、多靶点的作用和临床实践特点,在IBS的治疗中具有独特的优势和疗效[4]。
肠安Ⅱ号方是由白芍、白术等多味药组成的痛泻要方加减方,该加减方具有温中散寒、疏肝补脾的疗效,是临床止痛止泻的传统经验性复方药物[5],具有改善胃肠动力,修复肠黏膜屏障作用及消炎镇痛的功效[6]。
白芍是毛茛科植物芍药的干燥根,为临床治疗类风湿性关节炎与肝病的常用中药[7]。白术常用于腹胀泄泻,具有调节胃肠运动、抗炎、保肝、抗肿瘤等效用,在经典名方痛泻要方中作为君药,是治疗IBS重要中药之一[8]。处方成分药效分析表明白芍-白术(paeoniae radix alba-atractylodis macrocephalae rhizoma,PRA-AMR)药对是肠安Ⅱ号方发挥促进胃肠动力,止痛止泻,改善大便性状药效的关键中药药对[5-6]。
本研究运用网络药理学方法预测肠安Ⅱ号方中PRA-AMR治疗IBS的活性成分、核心靶标和信号通路,并在此基础上进行分子对接,以脂多糖(Lipopolysaccharide,LPS)诱导的人结肠上皮HCoEpiC细胞炎症损伤模型进行活性成分的体外细胞验证,探讨PRA-AMR治疗IBS的药效物质基础及其作用机制,为临床研究提供理论参考。
1 材料与方法
1.1 数据库与分析软件 TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)、GeneCards数据库(https://www.genecards.org)、PharmGKB数据库(https://www.pharmgkb.org)、TTD数据库(https://db.idrblab.net/ttd/)、DrugBank数据库(https://go.drugbank.com)、OMIM(https://www.omim.org)、UniProt数据库(https://www.uniprot.org)、Bioconductor数据库(http://www.bioconductor.org)、STRING数据库(http://string-db.org/cgi/input.pl)、Cytoscape Version 3.8.0软件。
1.2 药物活性成分的筛选 在TCMSP数据库中输入关键词“白术”“白芍”检索其化学成分,所得成分须满足类药性(drug-likeness,DL)≥0.18、口服生物利用度(oral bioavaliability,OB)≥30%。同时,在该数据库获取PRA-AMR所对应的靶点,使用Strawberry-perl软件,对有效成分及药对靶点进行匹配读取,并筛除重复靶点形成数据文件。并利用UniProt数据库将基因靶点转换为基因简称。
1.3 IBS相关靶点的筛选 通过数据库GeneCards、DrugBank、OMIM、PharmGKB、TTD数据库检索“irritable bowel syndrome”以获得IBS相关靶基因,并对基因进行并集及去重,利用R×64 4.1.2合并IBS疾病相关基因并制作venn图。
1.4 活性成分-IBS靶点网络模型构建与分析 利用筛选的药对活性成分及靶点和治疗IBS靶点等相关信息导入Cytoscape 3.8.0软件进行可视化处理分析,进而构建PRA-AMR活性成分-疾病靶点网络模型。
1.5 PRA-AMR-IBS靶点蛋白相互作用网络分析 通过在线进入STRING网站平台,将PRA-AMR活性成分靶点与IBS相关靶点的交集输出PPI核心靶标网络图,获取蛋白相互作用关系,根据节点连接数目绘制柱状图,获得核心靶标基因。
1.6 生物过程注释及代谢通路分析 通过R Studio软件进行京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)和基因本体(gene ontology,GO)富集分析。将靶点基因做出GO功能注释,并对KEGG数据库富集靶点基因参与的主要代谢途径进行注释筛选,通路富集分析设定Pvalue为0.05。
1.7 分子对接验证 PRA-AMR核心活性成分结构从pubchem中获取并以sdf格式下载,通过OpenBabel 3.1.1软件更改选择mol 2格式。利用PDB数据库下载文件建立靶点蛋白的3D结构,于AutoDock 4.2.6软件中将活性成分与靶点蛋白结构均转为格式PD-BQT,进行分子对接并分析结合能力。
1.8 体外实验验证
1.8.1 实验材料 HCoEpiC细胞(中国科学院上海细胞库);DMEM培养基(gibco公司);LPS(Sigma公司);IL-6 ELISA试剂盒(杭州联科生物技术股份有限公司);芍药苷(peaoniflorin,纯度≥98%,批号:wkq22032903,四川省维克奇生物科技有限公司);3β-乙酰氧基苍术酮(3β-acetoxyatractylone,纯度≥98%,批号:MUST-21030920,成都曼斯特生物科技有限公司),噻唑蓝(MTT,批号:EZ7890C117,德国Biofroxx)。
1.8.2 HCoEpiC细胞培养 选取对数生长期HCoEpiC细胞,置于主要由DMEM与10%胎牛血清配置的完全培养基中,37℃、5%CO2培养箱中培养。
1.8.3 MTT检测细胞活力 将HCoEpiC接种对数生长期的细胞到96孔板中24 h,待细胞贴壁后,除对照组外,其余组均加入5 μg/mL LPS。实验分为对照组(无LPS、无芍药苷、无3β-乙酰氧基苍术酮);模型组(5 μg/mL LPS);芍药苷(5、10 μmol/L)组;3β-乙酰氧基苍术酮(5、10 μmol/L)组;芍药苷+3β-乙酰氧基苍术酮(均为5 μmol/L)组。各组分别孵育培养12、24、48 h,每孔加入20 μL 0.5% MTT溶液,置于37℃、5%CO2培养箱中继续孵育4 h,弃去上清液,每孔再次加入二甲基亚砜DMSO 150 μL。低速振荡10 min,在490 nm处测量各孔的吸光值。细胞活力=(A实验组-A调零组)/(A空白组-A调零组)×100%。分组中LPS、芍药苷、3β-乙酰氧基苍术酮剂量均参考相关文献[10-11]。
1.8.4 ELISA法检测细胞上清IL-6含量 取对数生长期的HCoEpiC细胞接种于培养皿中,置于培养箱中培养,实验分组同1.8.3,加药孵育12 h后收集各组细胞培养液上清,离心除去细胞杂质,依据IL-6 ELISA试剂盒说明书进行测定,计算每组对应的IL-6含量。

2 结果
2.1 有效成分的获取与筛选 从TCMSP中检索筛选得知,白芍、白术有效成分分别为13和7个。见表1~2。另将该药对在此数据库中分别查询共得靶点1 764个;后收集上述有效成分规定的靶标信息,借助Strawberry-perl软件,删去重复靶点数据并最终将其名称转变成72个基因名从而构成药物基因文件。

表1 白芍潜在活性成分

表2 白术潜在活性成分
2.2 疾病靶点文件的建立 以“irritable bowel syndrome”为关键词分别在Genecards、PharmGKB、OMIM、TTD、DrugBank数据库中搜集IBS的疾病靶点,在Genecards获得基因3 098,DrugBank中获得249,OMIM中获得324,PharmGkb中获得204,TTD中获得37。在R运行帮助下,整理上述数据库中最终靶点为3 417个,见图1。

图1 IBS疾病相关靶点交集
2.3 PRA-AMR-疾病靶点文件的建立 将PRA-AMR的主要调控靶点与已取得的3 417个IBS靶基因相交,venn图分析显示出63个交集靶点。见图2。
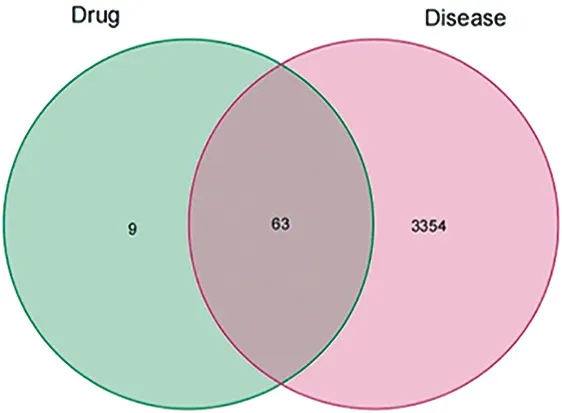
图2 PRA-AMR-疾病靶点交集
2.4 PRA-AMR“活性成分-靶点-疾病”网络构建 以已获取的63种交集靶基因作为IBS的靶点,运用Cytoscape 3.8.0软件构建PRA-AMR“活性成分-靶点-IBS”相互作用网络,在网络图中显示的节点代表该药对活性成分、交集靶点基因,分别用不同颜色形状以示明确,节点之间连线为边表示相互作用关系。其中,山奈酚(kaempferol)、β-谷甾醇(beta-sitosterol)、3β-乙酰氧基苍术酮(3β-acetoxyatractylone)3种活性化合物对应的靶基因数目最多。山奈酚对应PTGS1,JUN,PPARG等43个靶基因;β-谷甾醇对应PON1,PRKCAA,CASP8等25个靶基因;3β-乙酰氧基苍术酮对应AR、GABRA1、ADRB2等11个靶基因,见图3。

紫色表示白术活性成分;红色表示白芍活性成分;蓝色表示交集靶点。
2.5 PPI的构建及其核心靶点的筛选 基于STRING数据库分析获得蛋白相互作用(PPI)网络,以进一步探究该药对治疗IBS的作用机制。该网络共有63个节点,416条边,见图4。在PPI网络中,代表靶点的节点之间连线数目为度(degree),连线越多,度越大,则表示靶点发挥作用越重要。按照度值由大到小顺序筛选前30个关键靶点,其中AKT1、IL-6度较大,分别为32和41条,为PRA-AMR作用于IBS的关键靶点,见图5。

图4 PRA-AMR治疗IBS相关靶点的PPI网络

图5 PRA-AMR治疗IBS的核心靶点(排名前30)
2.6 GO及KEGG富集分析 将PRA-AMR与IBS交集的63个靶基因进行GO富集分析,得到GO条目1 482个,其中生物过程(biological process,BP)1 293条,细胞成分(cellular component,CC)31条,分子功能(molecular function,MF)158条。依据富集程度取排名前10的GO条目绘制气泡图,见图6。与生物过程相关的主要有对外来刺激的反应、对细菌来源分子的反应、LPS反应等;与细胞成分相关的主要有膜筏、膜微区、突触膜等;与分子功能相关的主要有血红素结合、四吡咯结合等。在P<0.05条件下,KEGG分析共同靶点富集134条通路,主要涉及糖尿病并发症中AGE-RAGE信号通路、TNF信号通路、化学致癌信号通路、肝炎(hepatitis B)信号通路、白介素-17信号通路等通路,根据P值大小评定KEGG富集程度,取排名前30的结果构建KEGG功能富集气泡图(图6D)。

A.GO-BP;B.GO-CC;C.GO-MF;D.KEGG。
2.7 分子对接验证 运用分子验证方法预测成分与靶点的相互作用关系,如表3表示为7个核心活性成分化合物(白芍4个、白术3个)分别与8个交集靶点分子对接信息,文献表明结合自由能小于-5 kcal/mol时,分子与靶标结合活性良好[11]。结合力越强,化合物作用稳定性越好,结合能越小。由表3可知,PRA-AMR治疗IBS排名首位的关键核心靶点IL-6与白芍活性成分芍药苷(paeoniflorin)对接自由能最小,为-8.0 kcal/mol,可与IL-6稳定结合;3β-乙酰氧基苍术酮(3β-acetoxyatractylone)与IL-6结合自由能为-6.5 kcal/mol,在白术筛选出候选活性成分中自由能最小,表明具有良好的结合。提示芍药苷、3β-乙酰氧基苍术酮可能是PRA-AMR治疗IBS的关键成分。对接分析如图7。

表3 PRA-AMR活性成分与治疗IBS潜在靶点的对接信息
2.8 体外细胞实验验证
2.8.1 芍药苷与3β-乙酰氧基苍术酮对LPS诱导HCoEpiC细胞活力的影响 如图8所示,相比于对照组,12、24、48 h后模型组(LPS 5 μg/mL)细胞存活率降低(P<0.01);12、24、48 h培养后5、10 μmol/L芍药苷组较模型组细胞活力增加(P<0.05);而与模型组相比,5、10 μmol/L 3β-乙酰氧基苍术酮存活率差异无统计学意义(P>0.05);同时给予5 μmol/L 3β-乙酰氧基苍术酮、5 μmol/L芍药苷12 h组较仅给予5 μmol/L芍药苷组HCoEpiC细胞活力增加(P<0.05),而与10 μmol/L芍药苷组相比差异无统计学意义(P>0.05)。而给药孵育至24、48 h时,5 μmol/L 3β-乙酰氧基苍术酮+5 μmol/L芍药苷组较给予5、10 μmol/L芍药苷组存活率有升高趋势,但差异无统计学意义(P>0.05)。
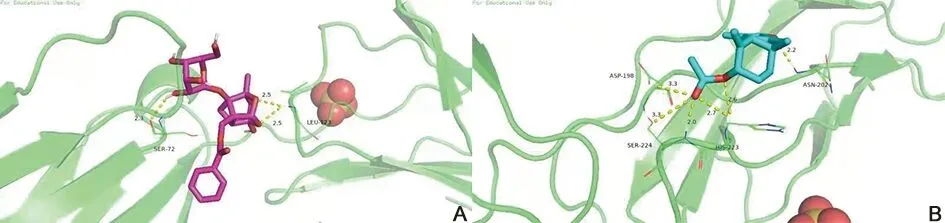
A.IL-6与芍药苷;B.IL-6与3β-乙酰氧基苍术酮。
2.8.2 芍药苷与3β-乙酰氧基苍术酮对LPS诱导HCoEpiC细胞IL-6表达的影响 与对照组相比,5 μg/mL LPS诱导增加模型组细胞上清IL-6的含量(P<0.01);与模型组相比,5、10 μmol/L芍药苷组IL-6含量减少(P<0.05)。而给予5、10 μmol/L 3β-乙酰氧基苍术酮组较模型组IL-6水平差异无统计学意义(P>0.05);然而,5 μmol/L 3β-乙酰氧基苍术酮+5 μmol/L芍药苷联用组较仅芍药苷给药组IL-6水平下降(P<0.05)(图9)。

A.12 h;B.24 h;C.48 h。F12 h=69.424,F24 h=111.461,F48 h=63.554,P<0.001。

与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与LPS+5 μmol/L芍药苷+5 μmol/L 3β-乙酰氧基苍术酮组比较,&&P<0.01。F12 h=9.843,F24 h=40.905,F48 h=28.415,P<0.001。
3 讨论
中医理论认为肝郁脾虚是IBS的重要诱因,中医药在治疗IBS方面表现出明显的优势[4]。PRA-AMR是肠安Ⅱ号方治疗IBS的重要药味,但该药对发挥治疗作用的机制尚不明确,限制其临床的推广应用[12]。
本研究利用网络药理学和分子对接手段并进行体外验证对PRA-AMR治疗IBS的主要活性成分和作用机制进行初步探讨。
本研究应用网络药理学方法初步筛选出PRA-AMR中治疗IBS的主要药效成分为芍药苷、芍药新苷、苯甲酰芍药苷、山奈酚、3β-乙酰氧基苍术酮等,已有研究发现芍药苷可通过增加降钙素基因相关肽(CGRP)、肠血管活性肽(VIP)、5-HT等神经肽的合成与分泌,调节脑-肠轴,缓解疼痛,逆转肠推进障碍,从而缓解IBS症状[13]。另外,通过KEGG通路富集分析我们发现IL-17信号通路、AGE-RAGE信号通路、TNF信号通路、化学致癌信号通路、肝炎(hepatitis B)信号通路等通路均是PRA-AMR治疗IBS的潜在信号通路。已有研究表明IL-17信号通路是介导肠道黏膜炎症的关键通路,黏膜炎症严重程度与IL-17水平呈正相关[14]。TNF是一种多效促炎细胞因子,在临床实践中TNF抗体药物已广泛用于肠道疾病炎症的治疗,Park等[15]通过临床观察发现结肠炎患者体内血清中TNF水平显著升高,经治疗后可恢复正常水平。
根据PRA-AMR治疗IBS靶点的PPI网络筛选得出关键核心靶点IL-6在治疗IBS中发挥重要作用。IL-6是由T细胞等多种细胞产生的促炎细胞因子,可通过多种信号转导炎症反应并诱发肠神经感觉异常从而加重患者的内脏敏感程度。研究认为,IBS发病表现出循环IL-6水平的上调,因此,通过抑制靶点IL-6表达可能降低其致病因素,缓解IBS患者疼痛表现及炎症状态,达到治疗目的[16]。依据网络药理学结果推测PRA-AMR可能通过关键主要活性成分芍药苷、3β-乙酰氧基苍术酮调节IL-6水平以改善IBS炎症作用。因此,进一步采用LPS诱导HCoEpiC细胞炎症损伤模型,选择5、10 μmol/L芍药苷与3β-乙酰氧基苍术酮评价预测结果,通过MTT法检测两种关键成分对该模型细胞活性的影响及对PRA-AMR治疗IBS的核心靶点IL-6进行验证。LPS诱导细胞炎症,模型组IL-6含量较正常组显著上升;与模型组比较,IL-6含量给予5、10 μmol/L芍药苷后明显下降,提示芍药苷具有减轻肠细胞炎症作用,符合预测结果;而5、10 μmol/L 3β-乙酰氧基苍术酮较模型组未显著抑制IL-6表达;有趣的是,5 μmol/L 3β-乙酰氧基苍术酮与5 μmol/L芍药苷联用较仅给予5、10 μmol/L芍药苷组明显下调IL-6水平,表明白芍活性成分芍药苷可通过抑制炎症因子IL-6表达有效改善结肠炎症,而3β-乙酰氧基苍术酮显著促进其抑炎效果,表明白芍白术作为中医临床治疗IBS经典药对的广泛合理性,可能与芍药苷、3β-乙酰氧基苍术酮调节IL-6有关,为肠安Ⅱ号复方中白芍与白术配伍治疗IBS机制的网络药理学预测提供进一步实验支持。
本研究应用网络药理学方法研究了PRA-AMR治疗IBS的主要活性成分及作用机制,并通过分子对接和细胞实验证实了结果。芍药苷与3β-乙酰氧基苍术酮是筛选出的此药对治疗IBS主要活性成分,两者合用较单一成分抗结肠炎症效果增强,与网络药理学所得结果相符,从而为PRA-AMR配伍在肠安Ⅱ号复方中发挥作用及临床应用肠安Ⅱ号方研究奠定理论基础。然而,PRA-AMR治疗IBS其他相关作用机制仍需更多实验进行系统完善的验证研究。

