基于经直肠超声造影参数的Logistic回归模型评估局部进展期直肠癌新辅助放化疗疗效的临床价值
廖中凡 罗 源 敬基刚 杨 音 闫静文 彭玉兰 庄 华
局部进展期直肠癌(locally advanced rectal cancer,LARC)是指临床分期为Ⅱ期(T3-4N0M0)或Ⅲ期(T1-4N1-2M0)的直肠癌,约占直肠癌的50%,其标准的治疗方案是术前新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)联合全直肠系膜切除术。NCRT后,肿瘤会出现退缩性改变[1]。通过观察治疗后癌巢内残余肿瘤细胞和纤维化占比,可获得病理指标肿瘤退缩分级(pathological tumor regression grade,pTRG),该指标广泛用于评估直肠癌NCRT 的疗效,与患者预后密切相关。因此,术前准确预测pTRG,对于临床制定适合患者的个体化治疗方案具有重要意义。影像学作为无创或低创的检查手段,是术前预测TRG的主要手段。Patel等[2]首次提出了磁共振肿瘤退缩分级(magnetic resonance tumor regression grade,mrTRG),并表明mrTRG是NCRT后总体生存期和无病生存期的独立预测因素。但研究[3-4]表明pTRG 与mrTRG 的一致 性 较 低(Kappa为0.25~0.36),mrTRG 不 能 代 替pTRG。有研究[5-6]将mrTRG 改进为二分类变量后,其预测效能有所提升,但仍不足以对直肠癌患者的治疗反应进行准确评估。经直肠超声(transrectal ultrasound,TRUS)可清晰显示NCRT 后直肠癌的形态、大小,并可通过超声造影(contrast-enhanced ultrasound,CEUS)评估其血流灌注情况。本研究旨在探讨基于经直肠CEUS 参数的Logistic 回归模型评估LARC 患者NCRT疗效的临床价值,以期为肿瘤的疗效监测提供更准确的手段。
资料与方法
一、研究对象
选取2020 年1 月至2022 年8 月于我院接受NCRT后并行全直肠系膜切除术的LARC 患者96 例,根据第7 版美国癌症联合委员会(AJCC)pTRG 分级标准[7]将其分为反应良好组(pTRG 0、1 级)34 例和反应不佳组(pTRG 2、3级)62例。反应良好组中,男24例,女10例,年龄39~73岁,平均(42.59±10.45)岁;pTRG 0级12例,pTRG 1 级22 例。反应不佳组中,男50 例,女12 例,年龄36~75 岁,平均(38.74±9.58)岁;pTRG 2 级51 例,pTRG 3 级11 例。纳入标准:①患者均经病理确诊有单发的直肠癌病灶;②术前均接受NCRT;③NCRT 前后均行TRUS 检查;④NCRT 后均接受全直肠系膜切除术治疗并获得明确的病理结果;⑤临床资料、病理资料均完整。排除标准:①肠腔狭窄,TRUS 检查时探查受限,不能全面评估者;②发生远处转移或合并其他脏器的恶性肿瘤者;③NCRT 后的超声检查间隔时间超过10 周[8];④超声图像质量欠佳。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.TRUS 及CEUS 检查:使用BK 5000 彩色多普勒超声诊断仪,E14CL4b(9048)双平面经直肠超声探头,频率4~14 MHz。检查前嘱患者尽量排空肠道,取左侧卧位,嘱其深呼吸,放松肛管,缓慢经肛门旋转置入探头,先行常规超声对直肠及肛管进行全面扫查,确定肿瘤位置后,于肿瘤最大切面测量其长径、厚径、肿瘤下缘距白线距离,以及肿瘤内主要动脉的收缩期峰值血流速度(PSV)、阻力指数(RI);然后切换至CEUS 模式,经患者肘正中静脉团注2.4 ml 配置好的SonoVue混悬液(意大利Bracco 公司),观察约1 min,选取造影剂达峰时的图像对肿瘤进行超声造影不均匀增强程度分级(contrast-enhanced ultrasound inhomogeneity grade,CEUS-IG),分级标准[9]:Ⅰ级,病灶呈不均匀增强,增强分布极不均匀,可出现无增强区域;Ⅱ级,病灶呈欠均匀增强,可出现大片低增强区域;Ⅲ级,病灶呈较均匀增强,可出现分层增强或小片状低增强区域;Ⅳ级,病灶呈均匀性增强,各部分增强程度及分布基本无差异。CEUS-IG治疗后Ⅰ、Ⅱ级提示治疗后肿瘤灌注出现明显异质性,预示反应良好;Ⅲ、Ⅳ级提示肿瘤整体灌注与治疗前比较无变化或变化小,预示反应不佳;CEUS-IG 降级预示反应良好,未降级预示反应不佳[10]。计算治疗后肿瘤长径、厚径、肿瘤下缘距白线距离、PSV、RI变化率,各参数变化率计算公式为:变化率=(治疗前参数-治疗后参数)/治疗前参数×100%。以上操作均由同一具有5年以上胃肠道超声检查经验的超声医师完成。
2.临床资料收集:收集患者年龄、性别,以及治疗前后癌胚抗原(CEA)、糖类抗原199(CA199)水平,并计算CEA、CA199变化率,变化率计算公式同上。
三、统计学处理
应用SPSS 26.0统计软件,符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验;不符合正态分布的计量资料以M(IQR)表示,两组比较采用Mann-WhitneyU检验。计数资料以频数或率表示,两组比较采用χ2检验。应用Logistic 回归分析筛选LARC 患者NCRT 疗效的独立影响因素,并建立Logistic 回归模型;应用Hosmer-Lemeshow 检验评估该模型的拟合优度。绘制受试者工作特征(ROC)曲线分析Logistic 回归模型及单一参数预测LARC 患者NCRT疗效的诊断效能;AUC 比较采用Delong 检验。P<0.05为差异有统计学意义。
结 果
一、两组临床资料比较
两组性别比、年龄、CEA治疗前、CA199治疗前、CEA治疗后、CA199治疗后、CEA 变化率、CA199 变化率比较差异均无统计学意义。见表1。

表1 两组临床资料比较
二、两组TRUS参数和CEUS参数比较
两组肿瘤长径变化率、PSV变化率、CEUS-IG治疗后、CEUS-IG降级占比比较差异均有统计学意义(均P<0.05);其余参数比较差异均无统计学意义。见表2,3 和图1,2。
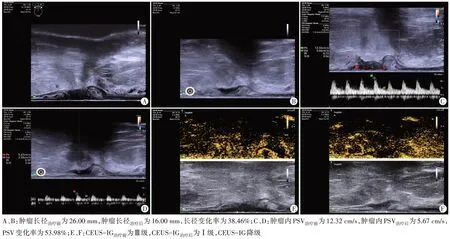
图1 反应良好组(男,59岁,pTRG 0级)NCRT前、后TRUS及CEUS图
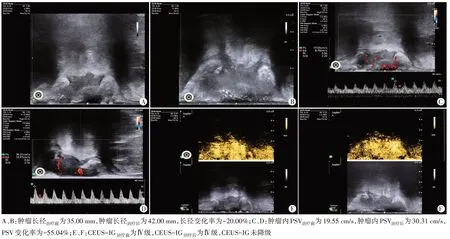
图2 反应不佳组(男,36岁,pTRG 3级)NCRT前、后TRUS及CEUS图
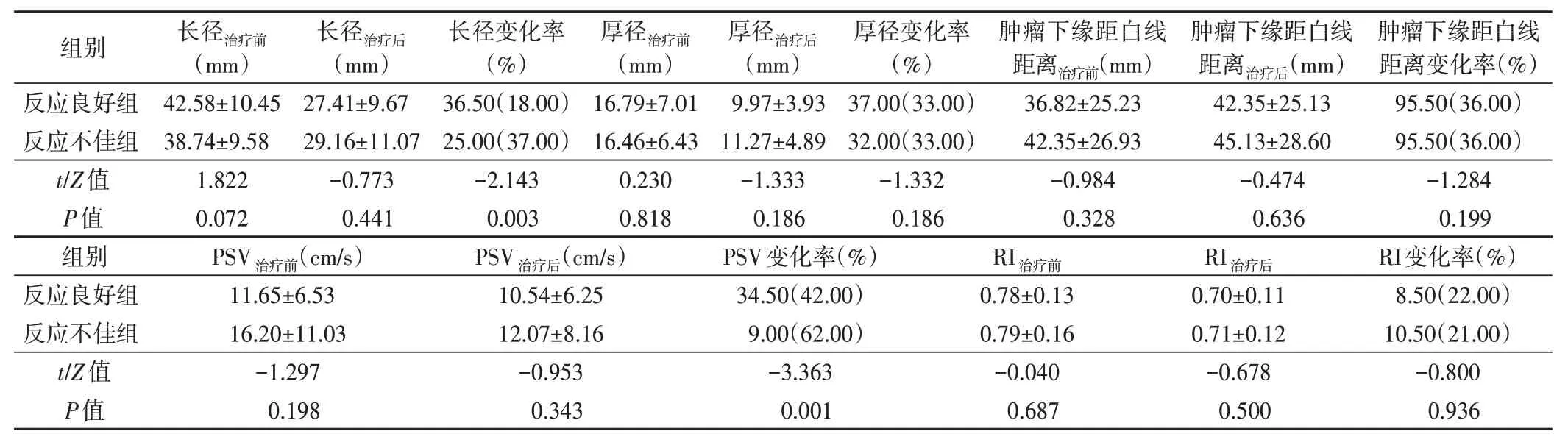
表2 两组TRUS参数比较
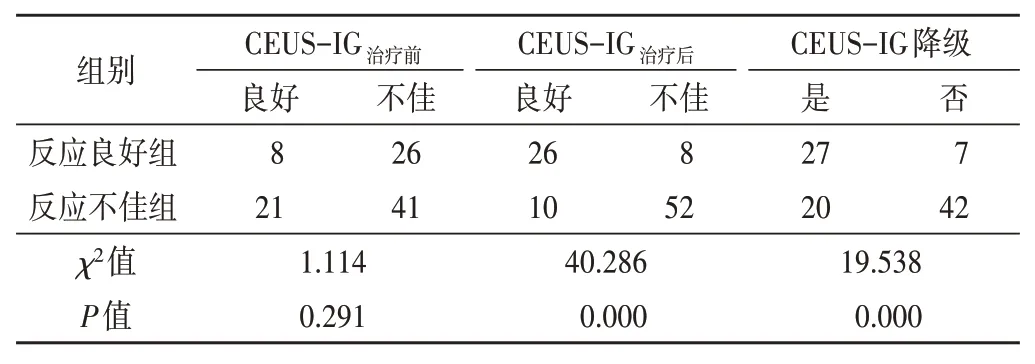
表3 两组CEUS参数比较 例
三、Logistic回归分析及预测模型建立
将上述差异有统计学意义的肿瘤长径变化率、PSV 变化率、CEUS-IG治疗后、CEUS-IG 降级纳入Logistic回归分析,结果显示,PSV变化率、CEUS-IG治疗后、CEUSIG 降级均为预测LARC 患者NCRT 疗效的独立影响因素(OR=6.95、15.69、4.62,均P<0.05);建立Logistic回归模型,Hosmer-Lemeshow 检验显示该模型的拟合效果良好(χ2=13.803,P=0.087)。见表4。

表4 Logistic回归分析
四、ROC曲线分析预测NCRT反应良好的诊断效能
ROC 曲线分析显示,Logistic 回归模型预测NCRT反应良好的特异度、准确率和AUC 均最高;且CEUSIG治疗后预测NCRT 反应良好的AUC 高于长径变化率,Logistic回归模型的AUC高于单一参数,差异均有统计学意义(均P<0.05)。见表5和图3。
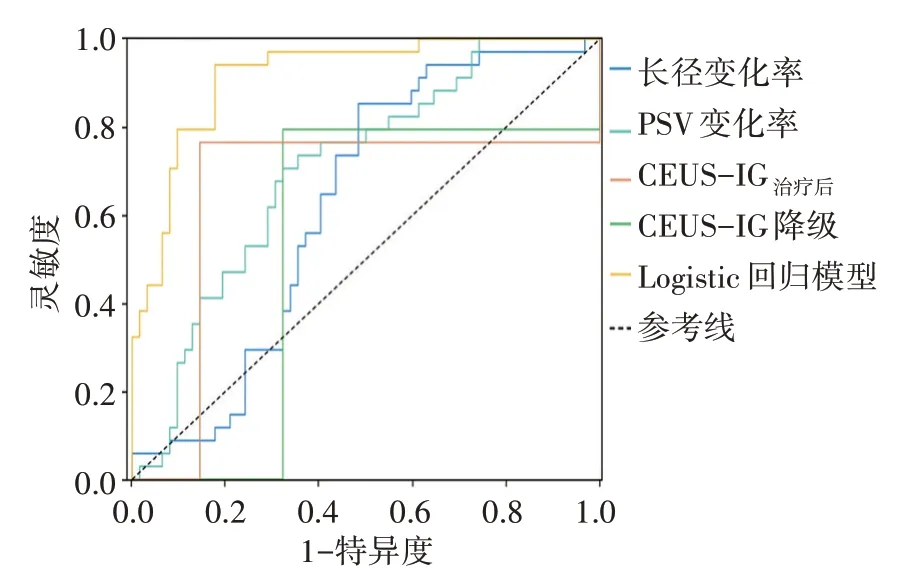
图3 Logistic 回归模型及单一参数预测LARC 患者NCRT 反应良好的ROC曲线图

表5 Logistic回归模型及单一参数预测LARC患者NCRT反应良好的诊断效能
讨 论
LARC 的标准治疗方案为NCRT 联合全直肠系膜切除术,NCRT 可减小肿瘤体积并降低肿瘤分期,提高对直肠癌的局部控制率和患者生存率。LARC 患者接受NCRT后肿瘤会产生退缩性改变,其中pTRG是评估NCRT 疗效的重要病理指标。研究[11]表明,若能在术前对pTRG进行准确预测,可对病理完全缓解(pCR)的患者采取“观察并等待”的策略,避免手术带来的并发症和永久性造瘘,有助于提高患者的生存质量,为患者制定个体化的治疗方案,实现精准医疗。既往研究[12-13]对血清CEA、CA199 能否准确评估NCRT 疗效仍存在分歧,本研究结果显示,反应良好组与反应不佳组血清CEA治疗前、CEA治疗后、CEA 变化率、CA199治疗前、CA199治疗后、CA199 变化率比较差异均无统计学意义,与Kalady 等[13]研究结论相似,表明血清CEA、CA199预测NCRT 疗效的价值有限。影像学是术前预测pTRG 的主要方法。TRUS 及CEUS 可对接受NCRT 后的LARC 进行实时观察,显示肿瘤的大小及血流灌注,对NCRT 的疗效评估有重要的应用价值。本研究旨在探讨基于经直肠CEUS 参数的Logistic 回归模型评估LARC患者NCRT疗效的临床价值。
陈丽梅等[14]研究表明pCR 患者NCRT 后肿瘤长径、厚径均较治疗前显著减小(均P<0.05);金鑫等[15]研究表明,pCR 与非pCR 组治疗后肿瘤长径、厚径、长径变化率、厚径变化率与pTRG 显著相关(r=0.336、-0.407、0.403、-0.435,均P<0.05)。本研究结果显示,NCRT 治疗后长径变化率>26.0%时,预测其疗效的准确率为63.5%,AUC 为0.633,表明长径变化率可对NCRT 疗效进行预测,与上述研究结论一致。但本研究两组肿瘤长径治疗前、长径治疗后、厚径治疗前、厚径治疗后及厚径变化率比较差异均无统计学意义,与既往研究[14-15]结果不一致,分析原因可能与样本量较小和测量仪器不同有关。接受NCR 后,反应良好的肿瘤内血供会受到破坏,超声血流参数会出现相应改变,本研究结果显示PSV 变化率截断值为22.5%时,预测LARC 患者NCRT 反应良好的准确率为68.8%,AUC 为0.708,与既往研究[16-17]结果相似。CEUS 相较于彩色多普勒超声的优势在于能反映肿瘤整体的血流灌注,已有研究[18]将CEUS 用于预测NCRT 后的肿瘤T 分期,但暂未见研究将其应用于预测pTRG。本研究依据pTRG 将接受NCRT 后行全直肠系膜切除术的LARC 患者分为反应良好组与反应不佳组,采用CEUS-IG 对LARC 的血流灌注进行整体评价,将CEUS-IGⅠ、Ⅱ级判定为肿瘤内血供丰富,预示反应不佳,CEUS-IGⅢ、Ⅳ级判定肿瘤内血供匮乏,预示反应良好;比较治疗前后CEUS 图像,治疗后CEUS-IG 若较治疗前发生降级,则预示肿瘤内血供减少,预示反应良好,否则预示反应不佳;研究 结 果 显 示,CEUS-IG治疗后和CEUS-IG 降 级 预 测LARC 患者NCRT 反应良好的准确率和AUC 分别为83.3%、71.9% 和0.810、0.736,且CEUS-IG治疗后预 测LARC 患者NCRT 反应良好的AUC 高于长径变化率(P<0.05),表明CEUS对NCRT 疗效的评估优于常规超声的径线测量方法。
为进一步探究TRUS参数和CEUS参数评估NCRT疗效的价值,本研究将两组比较差异有统计学意义的超声参数纳入Logistic 回归分析,结果显示PSV 变化率、CEUS-IG治疗后、CEUS-IG降级均为预测NCRT反应良好的独立影响因素(OR=6.95、15.69、4.62,均P<0.05),表明治疗后CEUS-IGⅠ、Ⅱ级及PSV 降低、CEUS-IG 降级均与NCRT 疗效显著相关。据此建立Logistic 回归模型,其预测LARC 患者NCRT 反应良好的灵敏度、特异度、准确率分别为73.5%、94.1%、84.4%;AUC 最高,为0.917,与单一参数比较差异均有统计学意义(均P<0.05),表明Logistic 回归模型可联合多参数准确评估NCRT 疗效,且优于单一参数,有助于为LARC 患者制定治疗方案提供参考。
本研究的局限性:①为回顾性的单中心研究、样本量较小,尚需多中心、大样本量的前瞻性研究进一步验证;②超声参数的获取或评价均由同一操作者进行,可能使结果出现主观偏倚;③未考虑不同治疗方案对研究结果的影响。
综上所述,基于经直肠CEUS 参数的Logistic 回归模型可准确评估LARC 患者NCRT 疗效,为临床实现直肠癌精准治疗提供参考。

