超声联合O-RADS 对卵巢黏液性交界性肿瘤与黏液性囊腺瘤的鉴别诊断价值
王晓玉,梁明明,吕帅帅,李世真,刘欣欣,仇春丽
1.山东大学齐鲁医院超声科,山东 济南 250012;2.山东省龙口市中医医院超声科,山东 龙口265701
卵巢黏液性交界性肿瘤是由轻、中度非典型胃肠型含黏液的上皮细胞构成的肿瘤,其增生比良性黏液性肿瘤明显,但无间质浸润,具有良性卵巢肿瘤和浸润性卵巢癌之间的组织病理学特征和临床行为[1]。卵巢黏液性交界性肿瘤好发于年轻女性,可行保留生育功能的手术,早期发现和诊断对改善患者预后和选择最佳手术方式具有重要意义。卵巢-附件影像报告和数据系统(Ovarian-adnexal Reporting and Data System,O-RADS)超声风险分层和管理指南[2]由美国放射学会在2020 年发布,旨在为超声描述用语提供统一标准,以减少和消除超声报告中的歧义,从而提高卵巢和其他附件肿块、恶性肿瘤风险分层的准确性。超声可有效鉴别卵巢良恶性肿瘤,但对卵巢交界性肿瘤的诊断欠佳,且超声诊断结果易受医师主观因素和技术水平影响。本研究旨在探讨超声联合O-RADS 分类在鉴别卵巢黏液性交界性肿瘤和黏液性囊腺瘤中的价值。
1 资料与方法
1.1 一般资料
回顾性分析2021 年1 月至2022 年9 月山东大学齐鲁医院诊治的20 例卵巢黏液性交界性肿瘤(黏液性交界性肿瘤组)和33 例卵巢黏液性囊腺瘤(黏液性囊腺瘤组)患者的超声和临床资料。黏液性交界性肿瘤组中,单侧附件区肿块18 例、双侧2 例,共22 个肿块;黏液性囊腺瘤组中,单侧附件区肿块32 例、双侧1 例,共34 个肿块。纳入标准:均经术后病理证实;术前均行彩色多普勒超声检查,超声图像信息完整,可行O-RADS 分类;术前行血清肿瘤标志物CA125 和CA19-9 测定;无卵巢恶性肿瘤病史和家族史;无急腹症症状;非妊娠期妇女。
1.2 仪器与方法
采用Philips IU22 和EPIQ7 超声诊断仪,经腔内超声(探头频率5~9 MHz)或经腹部超声(探头频率2~5 MHz)扫查子宫、双侧附件区及盆腔。记录肿块的大小、形态、内部回声、囊壁/分隔情况、有无乳头状突起、彩色多普勒血流及有无腹水等情况。由1 位具有10 年以上妇产科超声工作经验的高年资医师根据超声图像特征行O-RADS 分类[2]。
1.3 统计学处理
采用SPSS 25.0 软件进行数据分析。计量资料若服从正态分布且方差齐,以表示,组间比较行独立样本t 检验,反之行Mann-Whitney U 检验;计数资料以个(%)表示,组间比较行χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组一般资料比较
黏液性交界性肿瘤组年龄19~83 岁,平均(45.3±20.1)岁;黏液性囊腺瘤组年龄13~74 岁,平均(37.0±17.9)岁,2 组差异无统计学意义(P=0.123)。2 组患者多表现为下腹部增大或扪及腹部包块、腹痛、腹胀、月经不规律等,其中12 例黏液性交界性肿瘤和24 例黏液性囊腺瘤患者无症状,由查体发现。
黏液性交界性肿瘤组术前CA125、CA19-9 中位数分别为28.9、20.0 U/mL,黏液性囊腺瘤组术前CA125、CA19-9 中位数分别为16.8、11.7 U/mL,2 组差异均无统计学意义(P=0.073,0.106)。
2.2 2 组超声表现比较(表1)
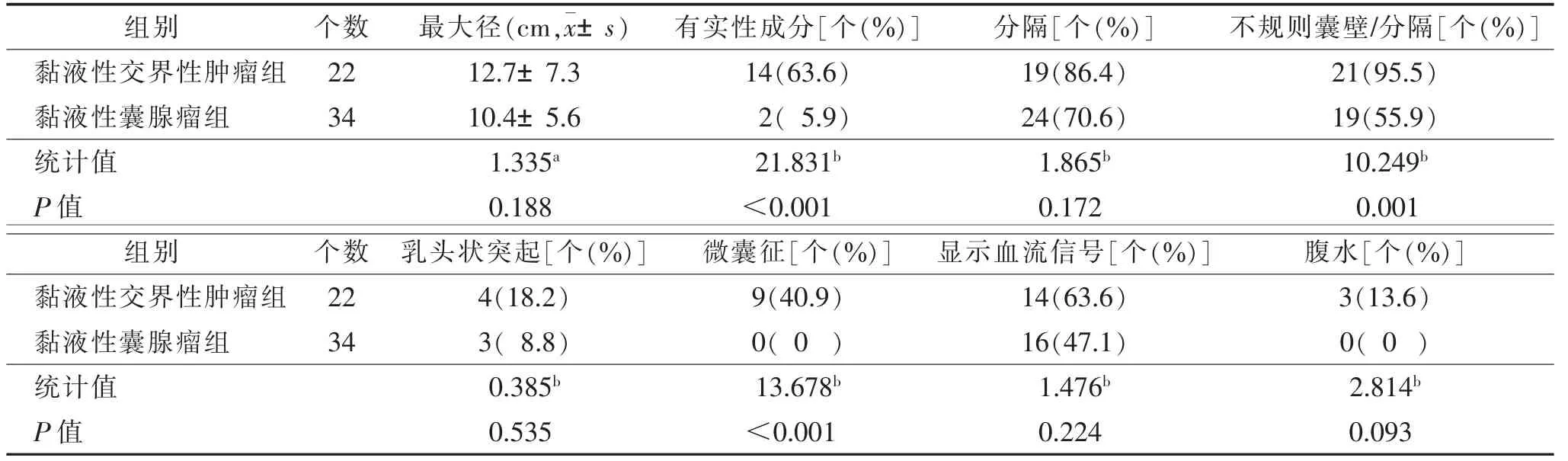
表1 卵巢黏液性交界性肿瘤组和黏液性囊腺瘤组的超声表现比较
黏液性交界性肿瘤组肿瘤最大径3.0~30.0 cm,黏液性囊腺瘤组2.8~26.0 cm,2 组差异无统计学意义(P=0.188)。2 组均以多房性肿块多见,且乳头状突起较少见。黏液性囊腺瘤多表现为纯囊性,而黏液性交界性肿瘤囊实性多见(P<0.001)。黏液性交界性肿瘤有不规则囊壁/分隔的比例高于黏液性囊腺瘤(P=0.001)。微囊征仅见于黏液性交界性肿瘤(P<0.001)。2 组在显示血流信号和腹水方面差异均无统计学意义(均P>0.05)。
卵巢黏液性交界性肿瘤与黏液性囊腺瘤典型超声图像见图1~3。

图1~3 卵巢黏液性交界性肿瘤和黏液性囊腺瘤超声图像 注:图1 患者,女,30 岁,左侧卵巢可见大小约10 cm×8 cm 囊实性包块,内见多发分隔,CDFI 示中等血流信号,血流评分3 分,卵巢-附件影像报告和数据系统(O-RADS)分类为5 类,病理为卵巢黏液性交界性肿瘤;图2 患者,女,29 岁,左侧卵巢可见大小约8 cm×5 cm 囊性包块,内见多发分隔,CDFI 示少量血流信号,血流评分2 分,O-RADS 分类为3 类,病理为卵巢黏液性囊腺瘤;图3 患者,女,49 岁,为卵巢黏液性交界性肿瘤局部放大超声图像,可见微囊征(箭头)
2.3 2 组O-RADS 分类比较(表2)
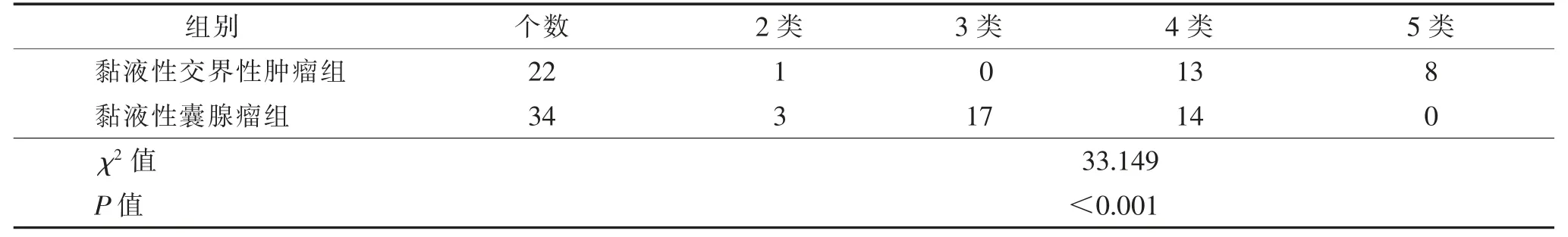
表2 卵巢黏液性交界性肿瘤组和黏液性囊腺瘤组O-RADS 分类比较 个
黏液性交界性肿瘤组中O-RADS 2~3 类占4.5%(1/22),4~5 类占95.5%(21/22);黏液性囊腺瘤组中O-RADS 2~3 类占58.8%(20/34),4~5 类占41.2%(14/34);2 组差异均有统计学意义(均P<0.001)。O-RADS 分类4~5 类诊断黏液性交界性肿瘤的敏感度、特异度、阳性预测值和阴性预测值分别为95.5%、58.8%、60.0%和95.2%。
3 讨论
近年来,卵巢交界性上皮性肿瘤的发病率逐年升高,且发病呈低龄化趋势[3]。卵巢交界性上皮性肿瘤在临床表现、影像学特征和病理方面与卵巢肿瘤有一定重叠,且术中快速冰冻病理与术后病理的符合率也较低[4],其诊断仍是妇科肿瘤的难点之一。
卵巢黏液性交界性肿瘤和黏液性囊腺瘤常需经腹成像观察肿块的范围,两者体积多较大,均以多房性为主,囊内可见多发高回声分隔,分隔密集时可呈蜂窝状。囊内透声表现因黏蛋白的含量不同而不同,可呈细密点状、呈云雾状或胶冻样。乳头样突起在黏液性交界性肿瘤和黏液性囊腺瘤中均较少见。本研究显示,黏液性交界性肿瘤与黏液性囊腺瘤在肿块最大径、有无分隔、有无乳头状突起和腹水方面差异均无统计学意义。黏液性交界性肿瘤中彩色多普勒显示血流信号的比例高于黏液性囊腺瘤,但差异无统计学意义(P=0.224),与其他文献[5-6]报道不同,可能与样本量较小有关。本研究中2 组在有无实性成分及囊壁/分隔方面差异有统计学意义,黏液性交界性肿瘤有实性成分和不规则囊壁或分隔的比例高于黏液性囊腺瘤。黏液性交界性肿瘤中95.5%有不规则的囊壁/分隔,仅1 个为囊壁光滑的单房囊肿被误诊为良性肿瘤。因此,当肿块中有实性成分及不规则的囊壁/分隔时,应警惕黏液性交界性肿瘤的可能。
Timor-Tritsch 等[7]提出了一种超声诊断卵巢交界性上皮性肿瘤的新指标——微囊征,是指肿瘤内壁的乳头状突起或实性部分由密集排列的多个直径在1~3 mm 的微小囊性回声组成,表现为松散随机分布的微气泡样堆积。本研究中卵巢黏液性交界性肿瘤组微囊征9 个(40.9%),黏液性囊腺瘤组未发现,2 组差异有统计学意义(P<0.001),与文献报道73.3%的黏液性交界性肿瘤可观察到微囊征[7]不符,可能与本研究使用的探头频率较低有关。
血清CA125 和CA19-9 已被广泛应用于卵巢良恶性肿瘤的鉴别诊断和术后随访等,但其对卵巢交界性上皮性肿瘤的诊断价值尚有争论。卵巢交界性肿瘤患者血清CA125 和CA19-9 多正常或轻度升高[8]。本研究中,黏液性交界性肿瘤组CA125 和CA19-9水平虽高于黏液性囊腺瘤组,但差异无统计学意义。Valentin 等[9]研究认为,高年资超声医师对卵巢肿瘤的诊断优于CA125,超声联合CA125 并不能提高诊断性能。Kelly 等[10]研究显示,虽然卵巢黏液性肿瘤中CA19-9 升高较多见,但其无法区分良性、交界性和恶性。此外,一些良性疾病,如子宫内膜异位症、盆腔炎、卵巢成熟性畸胎瘤等也可出现CA125或CA19-9 升高,因此CA125 和CA19-9 的临床应用有一定局限性。
目前,已建立多个超声评估附件肿瘤良恶性的诊断模型和分类系统,包括国际卵巢肿瘤分析组织(IOTA)简单法则、ADNEX 模型和妇科影像报告与数据系统(GI-RADS)等[11-13]。O-RADS 是目前唯一包含所有风险类别和相关管理方案的分类系统。Basha 等[14]认为,O-RADS 诊断恶性肿瘤的敏感度明显高于GI-RADS 和IOTA 简单法则,但特异度略低。Hiett 等[15]研究发现,当设置恶性风险阈值≥10%时,O-RADS 的敏感度为100.0%,特异度为46.4%,与IOTA 简单法则风险预测模型和ADNEX 模型敏感度相似。本研究设置O-RADS 分类4~5 类,即中、高度恶性风险用于诊断黏液性交界性肿瘤的敏感度为95.5%,特异度为58.8%,与Hiett 等[15]的研究结果一致。O-RADS 诊断黏液性交界性肿瘤具有较高的敏感度,可减少误诊,避免遗漏恶性病变[16]。
本研究的不足:样本量较小,某些指标与其他研究的结果存在一定差异,且研究过程中未使用超声新技术,今后将扩大样本量,联合超声造影等多模态超声成像进行更深入的研究。
综上所述,大部分卵巢黏液性交界性肿瘤与黏液性囊腺瘤均表现为多房囊性病变,超声征象有相似之处。当发现肿块内有实性成分、不规则囊壁/分隔或微囊征时,应警惕卵巢黏液性交界性肿瘤的可能。O-RADS 分类对诊断黏液性交界性肿瘤有较高的敏感度,可作为超声医师鉴别卵巢交界性肿瘤的辅助手段。

