载脂蛋白E背景E1A激活基因阻遏子转基因小鼠建立及鉴定
赵晓杰, 闫 冰, 刘 丹, 张大力, 何佳奇
北部战区总医院 心血管内科,辽宁 沈阳 110016
载脂蛋白E(apolipoprotein E,ApoE)蛋白是一种富含精氨酸的血浆载脂蛋白,参与乳糜微粒残体、极低密度脂蛋白和高密度脂蛋白的一些亚类等脂质的代谢,与特定细胞表面的受体和硫酸肝素蛋白聚糖相互作用,将其从血浆循环中清除[1]。为研究ApoE与人类疾病的关系,如动脉粥样硬化[2]、肥胖[3]、糖尿病[4]及阿尔兹海默症[5]等,ApoE背景(ApoE-/-)小鼠作为实验动物模型被广泛应用。E1A激活基因阻遏子(cellular repressor of E1A-stimulated genes,CREG)是一种含有220个氨基酸的进化保守的糖蛋白,结构类似于氧化还原酶,具有高度保守性,人类与小鼠的CREG基因高度同源[6]。本课题组前期研究发现,CREG可以通过调节不同细胞增殖、分化、凋亡等,对心血管及代谢疾病产生影响,且在调节肝糖脂代谢方面也具有重要作用[7]。本研究旨在建立ApoE-/-CREG转基因(CREGTg)小鼠模型,为进一步探讨CREG在动脉粥样硬化等心血管疾病中的作用及机制提供新的实验工具。现报道如下。
1 材料与方法
1.1 实验动物与配繁方案 3只雄性ApoE-/-小鼠和9只雌性CREGTg小鼠均购自江苏集萃药康生物科技有限公司。首先,将雄性ApoE-/-小鼠与雌性CREGTg小鼠进行交配,获得雄性ApoE+/-小鼠和雌性ApoE+/-CREGTg小鼠(或雌性ApoE+/-小鼠和雄性ApoE+/-CREGTg小鼠),再将两者进行交配,以获得ApoE-/-CREGTg小鼠。
1.2 主要试剂 CREG一抗、ApoE一抗(英国Abcam公司);Gapdh抗体(美国Cell Signaling Technology);HRP标记的二抗(美国Jackson Immuno Research);逆转录试剂盒(日本TAKARA);蛋白裂解液RIPA(美国Thermofisher Scientific);引物合成(生工生物工程股份有限公司)。
1.3 基因型鉴定 子代小鼠满4周时,分笼并打耳钉进行编号。提取鼠耳基因组DNA,具体方法:将小鼠耳放于裂解液中(含蛋白酶K),55℃水浴锅2 h,95℃水浴锅5 min终止消化,12 000 r/min离心5 min,上清即为提取的DNA。然后进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,引物见表1。反应体系:gDNA Template 2 μl,10×Taq master mix 10 μl,Primer mix(10 mol/L)1 μl,水补至20 μl。反应条件:(1)95℃、5 min;(2)95℃、30 s;(3)58℃、30 s;(4)72℃、30 s;(2)~(4)共40个循环;(5)72℃、3 min;(6)25℃保持。将扩增后的PCR产物进行1.5%琼脂糖凝胶电泳及基因型鉴定。

表1 ApoE-/-CREGTg小鼠基因型鉴定
1.4 荧光定量PCR检测CREG转基因表达 选取8周龄雄性ApoE-/-小鼠及ApoE-/-CREGTg小鼠各3只,处死后分离各组小鼠脂肪组织和脾组织,采用Trizol法提取脂肪组织和脾组织的总RNA。按照试剂盒说明书进行逆转录反应。CREG正向引物TCTAAAAGACCTAACCGGAA,反向引物ACCGGAACGGCACTGGTCAAC;GAPDH正向引物AGGTCGGTGTGAACGGATTTG,反向引物GGGGTCGTTGATGGCAACA。相对表达量用2-△△CT表示。
1.5 蛋白免疫印迹法检测CREG蛋白表达 选取8周龄雄性ApoE-/-小鼠及ApoE-/-CREGTg小鼠各3只,处死后取20 mg脂肪组织和20 mg脾组织,加入200 μl蛋白裂解液对组织进行裂解,4℃放置30 min,12 000 r/min离心5 min,上清即为提取蛋白。BCA法测定蛋白浓度。采用SDS-PAGE胶对细胞总蛋白进行电泳。一抗采用抗CREG抗体,二抗为HRP标记的抗体,Gapdh为内参基因。一抗4℃孵育过夜,二抗室温孵育1 h后洗膜,再用化学发光试剂ECL对条带进行显影。采用Image-ProPlus 6.0软件对条带进行灰度分析。

2 结果
2.1 ApoE-/-CREGTg小鼠获得情况 共有孕鼠13只,共产仔73只。对子代小鼠进行基因鉴定,共发现6种基因型,分别为ApoE+/+小鼠9只(12.33%),ApoE+/+CREGTg小鼠10只(13.70%),ApoE+/-小鼠19只(26.03%),ApoE+/-CREGTg小鼠16只(21.92%),ApoE-/-小鼠8只(10.95%),ApoE-/-CREGTg小鼠11只(15.07%)。见图1。

图1 小鼠基因型鉴定结果[a.PCR扩增鉴定CREG转基因,CREG引物1=371 bp,引物2=360 bp;b.PCR扩增鉴定ApoE背景,野生型=155 bp,突变型=245 bp;本批次样本中ApoE+/+小鼠:5,7;ApoE+/+CREGTg小鼠:无;ApoE+/-小鼠:3,9;ApoE+/-CREGTg小鼠:6;ApoE-/-小鼠:2;ApoE-/-CREGTg小鼠:1,4,8;对照组:10为C57BL/6J(ApoE+/+)小鼠;11为ApoE-/-CREGTg小鼠;12为水]
2.2 小鼠脂肪组织与脾组织CREG转录水平 ApoE-/-CREGTg小鼠脂肪组织与脾组织的CREG转录水平高于ApoE-/-小鼠,差异均有统计学意义(P<0.05)。见图2。
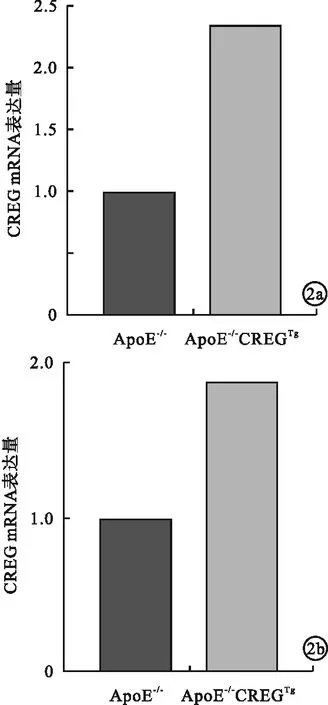
图2 荧光定量PCR检测ApoE-/-CREGTg小鼠脂肪组织与脾组织CREG转录水平(a.脂肪组织;b.脾组织)
2.3 小鼠脂肪组织与脾组织CREG蛋白表达水平 ApoE-/-CREGTg小鼠脂肪组织与脾组织的CREG蛋白表达高于ApoE-/-小鼠,差异均有统计学意义(P<0.05)。见图3。
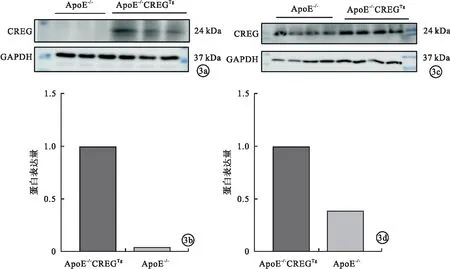
图3 蛋白免疫印迹法检测ApoE-/-CREGTg小鼠脂肪组织与脾组织CREG蛋白表达(a、b.脂肪组织蛋白表达;c、d.脾组织蛋白表达)
由于生物物种具有杂合子优势[17-20],本研究的F2代选取了鉴定后的杂合子小鼠,以提高小鼠品性及子代小鼠的稳定性。通过雄性ApoE+/-小鼠和雌性ApoE+/-CREGTg小鼠交配,成功获得ApoE-/-CREGTg小鼠。荧光定量PCR和蛋白免疫印迹法检测结果显示,ApoE-/-CREGTg小鼠脂肪组织和脾组织的CREG基因转录水平高于ApoE-/-小鼠,差异有统计学意义(P<0.05);ApoE-/-CREGTg小鼠脂肪组织和脾组织的CREG蛋白表达高于ApoE-/-小鼠,差异有统计学意义(P<0.05),进一步验证了该模型的可靠性及转基因效率,提示可繁育ApoE-/-CREGTg小鼠动物模型用于动脉粥样硬化等疾病发病机制的实验研究。
综上所述,本研究成功建立了ApoE-/-CREGTg小鼠模型,为深入阐明CREG对动脉粥样硬化等心血管疾病的调控作用及机制提供了新的实验工具。
3 讨论
ApoE是分子量为34 kD的糖蛋白,参与脂质在不同组织或细胞的分布和再分布,具有抗氧化、抗炎和抗动脉粥样硬化的特性。ApoE蛋白的主要功能是介导血浆或组织间液中脂蛋白或脂质复合物与特定细胞表面受体结合,小鼠ApoE基因缺陷会影响极低密度脂蛋白和乳糜微粒的清除[1,8-10]。Piedrahita等[11]通过同源重组在胚胎干细胞中操纵ApoE基因,在实验室中成功产生了第一个ApoE-/-小鼠品系。与野生型小鼠比较,ApoE-/-小鼠的血浆总胆固醇水平明显升高[12],使其成为动脉粥样硬化疾病及相关药物研发的重要工具。本课题组前期研究发现,CREG能够抑制血管内皮细胞凋亡,促进血管内皮细胞增殖,进而促进冠状动脉支架内皮化[6,13-16]。为进一步探究CREG对动脉粥样硬化等心血管疾病的调控作用及机制,本课题组拟在ApoE-/-小鼠中过表达CREG,从而建立ApoE-/-CREGTg小鼠模型,以便更直接地研究CREG对动脉粥样硬化性疾病的影响。

