玉米钙依赖蛋白激酶全基因组鉴定及抗旱表达分析
陈 果,郝晓燕,高升旗,胡文冉,赵 准,黄全生
(新疆农业科学院核技术生物技术研究所/新疆农作物生物技术重点实验室,乌鲁木齐 830091)
0 引 言
【研究意义】春玉米抽雄、开花期遇干旱是导致玉米减产的主要原因之一。干旱往往伴随着高温天气,新疆南、北疆平原地区春玉米的抽雄、开花期通常处于7 月,极易碰到高温天气,最高气温通常高于35℃,空气干燥,易造成花粉失水干枯,花丝枯萎,受精不全,缺粒秃尖增多,最终影响产量。通过常规育种手段进行玉米耐旱育种,育成了一些能够在新疆以及我国干旱和半干旱地区种 植的优良杂交种。但由于玉米耐旱性状的复杂性,其耐旱机制研究远远不够深入,限制了玉米耐旱种质创新与耐旱新品种培育[1]。因此,在新疆开展玉米耐旱机制研究与耐旱新种质创制具有重要意义。【前人研究进展】近年来在分子水平上了解植物耐旱的调控机制[2]。为了应对这些压力,植物发展了一系列的生存机制。其中,钙离子(Ca2+)是细胞内的第二信使,在各种信号转导通路中发挥着重要作用[3]。瞬态变化的Ca2+浓度是由几个Ca2+传感器或Ca2+结合蛋白。迄今为止,在高等植物中已经发现了3种主要的Ca2+结合蛋白,包括钙依赖蛋白激酶(CDPK)、钙调蛋白(CaM)和CaM类似蛋白(CaML)和钙调磷酸酶B蛋白(CBL)[4]。 CDPK是一种众所周知的Ca2+传感器蛋白激酶并参与环境胁迫抗性,这些激酶在植物和一些原生动物[5],但在动物中没有。CDPK蛋白有四个特征结构域:N端可变区、Ser/Thr激酶催化结构域、自调节/自抑制结构域和calmodulin类似结构域[6]。钙调素类似结构域包含EF-hands用于Ca2+结合。CDPKs不仅在多种非生物和生物胁迫(如干旱、寒冷、盐度、损伤和病原体感染)中发挥重要的作用,而且也在植物激素信号转导中发挥重要的作用[7-9]。拟南芥AtCDPK4和AtCDPK11是2个正调控因子,通过2个ABA响应转录因子ABF1和ABF4磷酸化参与CDPK/Ca2+介导的ABA信号[10]。拟南芥AtCDPK3和AtCDPK6可调节保卫细胞离子通道的活性,并参与ABA调控的气孔信号[11]。此外,过表达AtCDPK6和AtCDPK3的植株对盐/干旱胁迫的耐受性增强,而AtCDPK6突变体的植株没有明显的表型表现[12]。AtCDPK6也正向调控保卫细胞中茉莉酸甲酯(MeJA)信号[13]。AtCDPK21和AtCDPK23突变体对高渗胁迫、干旱和盐胁迫的耐受性增强[14-15]。拟南芥AtCDPK32过表达通过ABF4磷酸化增强了种子萌发过程中的ABA和盐敏感性[16]。拟南芥cpk5/cpk6、cpk5/cpk6/cpk11和cpk5/cpk6/cpk11/cpk4突变体破坏了flg22诱导的反应,包括ROS产生和防御相关基因表达[17]。在水稻中,过表达OsCDPK7的基因被证明可以增强水稻对寒、旱、盐胁迫的抗性[18]。OsCDPK21正向调控ABA信号和盐胁迫[19]。OsCDPK12过表达增加了对盐胁迫的耐受性,并增加了对兼容和不兼容稻瘟病真菌的敏感性[20]。CDPKs是由一个大家族编码的,拟南芥(Arabidopsisthaliana)基因组中有34个CDPK基因[21],水稻(OryzasativaL.)中有31个基因[22],小麦(TriticumaestivumL.)中有20个CDPK基因[23]。烟草(Nicotianatabacum)、大豆(Glycinemax)和番茄(Lycopersiconesculentum)也有多个CDPK基因[24-26]。然而,目前对玉米的CDPK家族知之甚少。只有6个ZmCDPKs(ZmCDPK1,ZmCDPK2,ZmCDPK7,ZmCDPK9,ZmCDPK10和ZmCDPK11)在玉米上被鉴定。低温诱导玉米叶片表达ZmCDPK1[27]。ZmCDPK7和ZmCDPK9的转录本水平在根和黄化叶片中高于绿叶,2个基因可能在光照下表达下调[28]。真菌感染和真菌诱导子处理玉米幼苗后,ZmCDPK10在幼苗生长和发育过程中表达[29]。ZmCDPK11的表达和酶活性被证明受亚麻酸(LA)和MeJA的调控以及参与创伤信号通路[30]。【本研究切入点】干旱胁迫严重影响农作物产量和品质。作物对干旱反应的分子机制仍不清楚,鉴定玉米抗旱基因并将其整合到玉米优质品种中是十分必要的。钙依赖性蛋白激酶(CDPKs)已被证明在各种生理过程中发挥重要作用,包括参与植物生长和发育,非生物和生物胁迫反应以及植物激素信号途径。基于该基因家族对干旱胁迫的研究鲜有报道,需对玉米CDPK基因家族进行全基因组分析,研究其对玉米干旱胁迫反应的能力。【拟解决的关键问题】分析玉米全基因组,筛选并鉴定在玉米中的所有CDPK基因,系统发育分析其进化起源及在玉米干旱胁迫中的表达水平,为进一步研究CDPK基因家族在干旱胁迫下的功能奠定了基础。
1 材料与方法
1.1 材 料
供试材料:玉米自交系B73,实验室自交繁育。
生长条件:在培养室中培养玉米自交系B73幼苗(ZeamaysL. cv) 在25℃/22℃(白天和夜间)条件下,光合有效辐射200 μmol/(m2·s),光周期16/8 h(白天和夜间),持续2~3周。
1.2 方 法
1.2.1 搜索玉米全基因组数据库CDPK基因
从拟南芥信息资源(http://www.Arabidopsis.org/)和水稻基因组注释数据库(http://rice.plantbiology.msu.edu/)或GenBank (http://www.ncbi.nlm.nih.gov/genbank/)分别下载了34个和30个水稻CDPKs的蛋白质序列。玉米基因组数据库的序列从(http://www.maizesequence.org/ index.html)下载。为鉴定玉米CDPK基因家族,拟南芥和水稻的CDPKs蛋白序列分别用检索玉米基因组和NCBI数据库BLASTP。序列的一个自BLAST被执行到删除冗余。所有假定的候选基因均通过InterProScan程序(http://www.ebi.ac.uk/Tools/pfa/iprscan/)手工验证,以确认激酶结构域的存在。使用Pfam (http://pfam.sanger.ac.uk/search)和SMART (http://smart.embl-heidelberg.de/)资源进一步检查所有获得的蛋白质序列。
1.2.2 玉米CDPK系统发育及重复分析
采用Clustal X比对多个氨基酸序列,利用MEGA5.0程序建立系统发育树。按照定义基因重复的标准:比对长度包括>80%的长基因;比对区域有身份>80%;紧密连接基因只计算一次重复事件,研究玉米B73中CDPK基因的重复,将所有在玉米基因组中发现的相关基因用Clustal X比对,用MEGA v5.0进行计算。
1.2.3 干旱胁迫处理
当玉米幼苗在28℃的培养室中生长至三叶期(大概14 d左右)进行干旱胁迫处理。处理后按不同时间间隔采集样品,立即冷冻于N2液体并放置在-80℃冰箱中备用。
1.2.4 RNA分离和实时定量RT-PCR表达分析
利用Trizol试剂和从玉米幼苗(不同干旱时间处理后)的根部按照说明书(Invitrogen公司,Carlsbad,CA,USA)提取总RNA。第一链cDNA用First strand cDNA Synthesis kit (Fermentas,USA)合成。实时定量RT-PCR反应在Bio-RAD MyiQTM实时PCR检测系统(Bio-RAD,美国)中进行,使用TransStart Top Green qPCR SuperMix (TransGen,中国),并根据制造商的说明进行。每个PCR反应(20 μL)含2 × real-time PCR Mix(含SYBR Green I) 10 μL,每个引物0.5 μL和适当的稀释的cDNA。热循环条件为95℃ 30 s,然后为95℃ 15 s,55~60℃ 30 s,72℃ 15 s。所有qRT-PCR分析均以Zmactin基因为内参。每个处理独立进行,共3次重复。根据系统的2-ΔΔCt方法计算相对基因表达量,所使用的引物均列在附件表S1中。
2 结果与分析
2.1 玉米CDPK基因家族成员的全基因组鉴定
研究表明,玉米中含有39个推定的CDPK基因,分别命名为ZmCDPK1-ZmCDPK39,包括6个已知的CDPKs。虽然玉米基因组(~2 300 Mb)远大于拟南芥(125 Mb)和水稻(389 Mb),但玉米CDPK基因总数与拟南芥和水稻的相近。39个CDPKs均具有保守的CDPK结构域,包括N端可变结构域、1个蛋白激酶结构域、1个自抑制结构域和1个钙调素类似结构域。在拟南芥、水稻和小麦中,许多CDPKs在其高度可变N端结构域的开头具有与膜关联的潜在豆蔻酰化基序,在第二位置有1个Gly残基。39个玉米CDPKs中的19个被预测为膜关联的豆蔻酰化基序。其中,15个CDPKs在3、4或5位点上至少有1个Cys残基,这是潜在的棕榈酰化位点。大多数玉米CDPKs含有4个EF基团,而ZmCDPK24有3只EF手。表1
2.2 玉米CDPK基因家族系统发育
研究表明,从完整的CDPK氨基酸序列中构建了1个无根树,39个ZmCDPKs可以分为4组,属于CDPK家族。第I组含有15个来自玉米的CDPKs,11个来自水稻,10个来自拟南芥。ZmCDPK5和ZmCDPK6与OsCDPK13高度相似,ZmCDPK5和ZmCDPK6可能参与了非生物胁迫。第二类包含11个玉米CDPKs,8个水稻CDPKs,13个拟南芥CDPKs。ZmCDPK29与OsCDPK12相似性达100%。第III组含有10个玉米CDPKs,8个水稻CDPKs和8个拟南芥CDPKs。ZmCDPK38与OsCDPK21的氨基酸序列同源性接近100%。第IV组包含3个来自玉米,2个来自水稻,3个来自拟南芥。ZmCDPK18与AtCDPK28在氨基酸水平上有91%的相似性。 大多数玉米-水稻同源基因具有相似的N-肉豆素化基序,EF手数和基因结构。图1
2.3 玉米CDPK基因结构组织和染色体定位
研究表明,根据预测序列确定玉米CDPK基因的外显子-内含子结构。同一组中的大多数成员具有相似的外显子-内含子结构。玉米I - III组的CDPKs包含2~9个外显子,而IV组CDPKs包含11~12个外显子,与拟南芥和水稻CDPKs的外显子数一致。在所有3个物种中,每个类群中都存在着保守的外显子-内含子结构。对CDPKs的染色体定位显示,其中39个CDPKs分布在玉米的全部10个染色体上。在拟南芥和水稻中,34个拟南芥CDPK和30个水稻CDPK基因也分布在各自基因组的全部染色体上,CDPK基因广泛分布在植物基因组中。CDPK基因在玉米每条染色体上的分布是非随机的,一些CDPKs似乎聚集在特定的染色体上,包括染色体1、2、3、4、5、7、8和10。6号染色体有2个CDPK基因,而9号染色体未发现编码1个CDPK基因。图2,图3
2.4 玉米CDPK基因在干旱胁迫下的表达谱
研究表明,CDPK基因参与了玉米对环境刺激的各种生理适应,而且CDPK基因的表达也受到激素、盐、冷、旱、热和伤等多种刺激的调控。利用qRT-PCR技术检测了39个CDPKs的表达水平。与处理相比除了ZmCDPK2、ZmCDPK3、ZmCDPK9和ZmCDPK32无明显变化外,其它CDPK基因的表达均发生了改变,ZmCDPK6、ZmCDPK11、ZmCDPK12、ZmCDPK14、ZmCDPK15、ZmCDPK19、ZmCDPK22、ZmCDPK25、ZmCDPK28、ZmCDPK31和ZmCDPK37上调,上调幅度为1.2~1.8倍。相反,ZmCDPK4、ZmCDPK5、ZmCDPK6、ZmCDPK7、ZmCDPK10、ZmCDPK13、ZmCDPK18、ZmCDPK20、ZmCDPK21、ZmCDPK23、ZmCDPK24、ZmCDPK29、ZmCDPK30、ZmCDPK31、ZmCDPK34和ZmCDPK36明显下调。 图3

表1 玉米CDPKs的特征
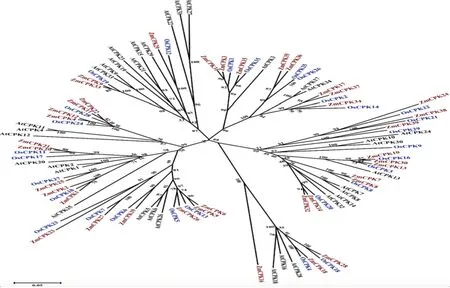
注:利用39个玉米、29个水稻和34个拟南芥的CDPK蛋白全长序列,使用MEGA5.0程序建立玉米CDPK基因的系统发育树。棕色代表玉米CDPK基因;蓝色代表水稻CDPK基因,黑色代表拟南芥CDPK基因
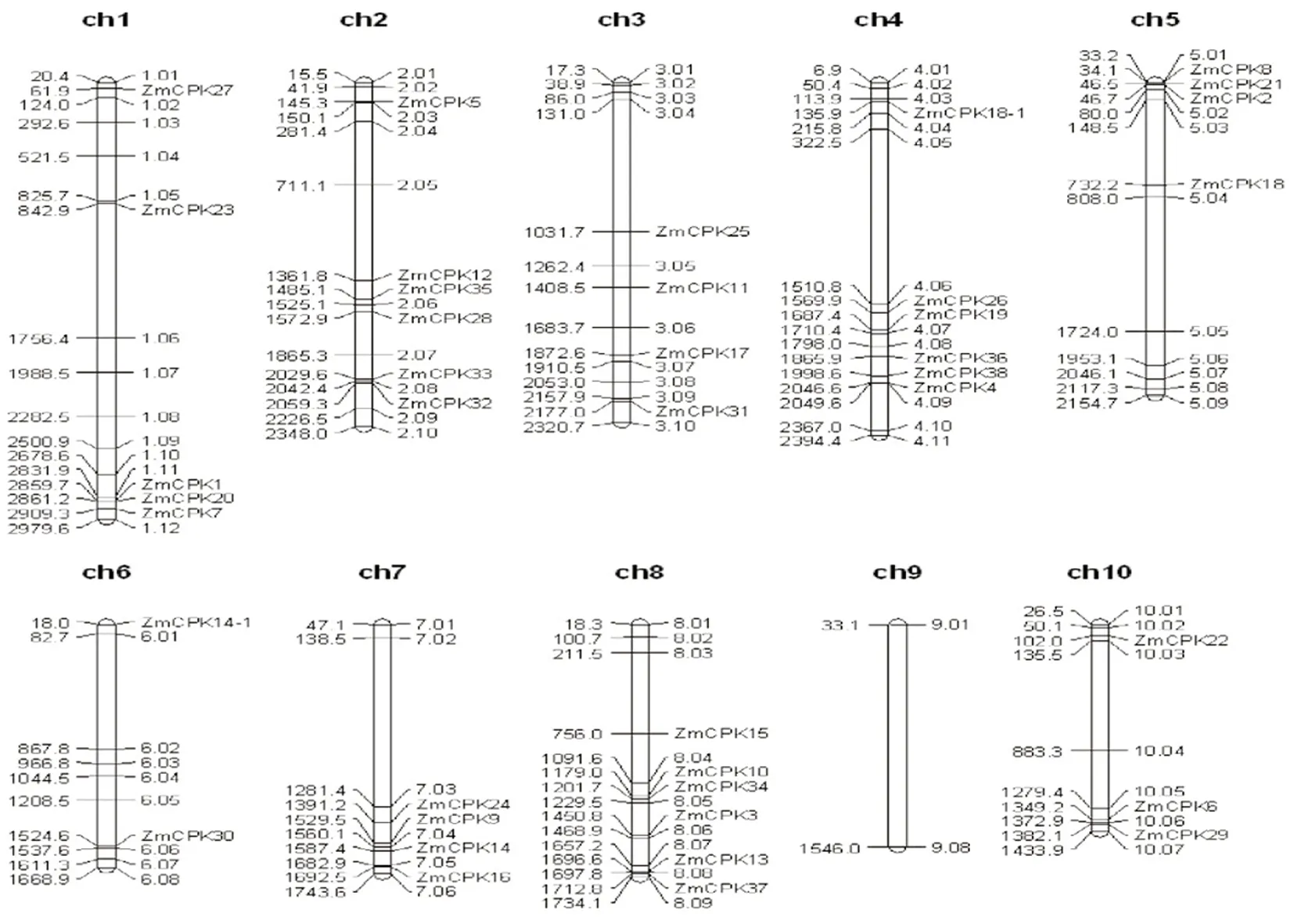
注:染色体编号在每个染色体表示法的顶部标明
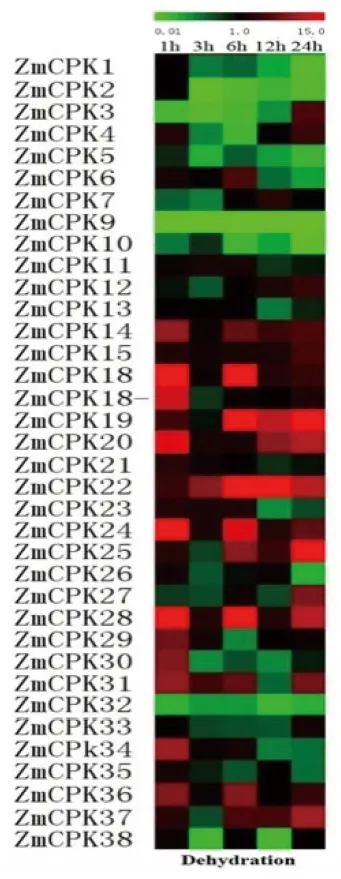
注:图中所示数字表示相对信号强度值,采用了分层聚类进行数据分析
3 讨 论
玉米基因组已经完成测序[31,32],OsCDPK13已表明与低温、干旱和盐胁迫的响应[18]有关,OsCDPK12为耐盐调节因子和抗稻瘟病负调控因子[20],OsCDPK21对水稻具有的耐盐性[19],AtCDPK28通过改变NAC转录因子和赤霉素稳态调节因子的表达来调节植物茎的伸长和维管的发育[32]。拟南芥以及其他物种的CDPKs已经有了报道[21-26]。根据拟南芥CDPKs和水稻CDPKs全基因组分析发现的34个CDPK基因和29个CDPK基因,推测CDPKs在玉米中是由1个大的多基因家族编码的[21,22]。只有少数玉米CDPK家族成员被鉴定[27-30]。由于玉米全基因组的基因草图序列已经完成,进行了玉米数据库搜索,利用之前已识别的玉米CDPKs的整个氨基酸序列和编码CDPKs的玉米全长cDNA克隆来识别玉米基因组中的CDPK家族基因。运用TBLASTN算法评分为>90的基因组序列作为候选序列,采用BLASTX程序和基序扫描对候选序列进行分析,以区分CDPKs与其他相关蛋白激酶。通过分析确定了在玉米基因组中含有39个推测的玉米CDPK基因,根据CDPK基因的命名方法命名为ZmCDPK1-ZmCDPK39。这些玉米CDPK基因都具有CDPK基因家族的典型结构,包括N端可变结构域、蛋白激酶结构域、自抑制结构域和钙调蛋白样结构域。将39个玉米CDPKs分为4个不同的类,所有的玉米CDPK基因分布在除9号染色体外的所有染色体上。然而,在玉米基因组中没有观察到CDPK基因的串联导向簇。因此,CDPK基因在玉米基因组中没有发生串联复制。
玉米CDPK基因对某些刺激的反应有调控作用,并从这些数据推断其功能。研究荧光定量逆转录聚合酶链式反应(qRT-PCR)的结果表明,大多数玉米CDPK基因的表达在干旱逆境胁迫下都有改变并表现出不同的表达模式。由于Ca2+作为一种通用的第二信使,这些玉米CDPK基因的改变在干旱等非生物胁迫的信号转导途径中发挥作用。
在玉米全基因组中鉴定出39个CDPK基因,大多数CDPKs及其相关蛋白激酶的功能仍不清楚。探明该基因家族成员的功能差异,还需要采用多种方法进行进一步的研究。
4 结 论
4.1从玉米中鉴定出了39个CDPK基因。
4.2由于有共同的蛋白质基序和外显子-内含子结构,每个群体的成员可能有最近的共同的进化起源关系,并锚定在特定的玉米染色体上。
4.3在干旱胁迫下,大多数玉米CDPK基因的表达在干旱逆境胁迫下都有改变并表现出不同的表达模式。大多数玉米CDPK基因家族成员可能是干旱胁迫信号通路中的调控因子。

