禽致病性大肠杆菌clpV基因缺失对雏鸡气管黏膜细胞因子-细胞因子受体相互作用通路的影响
蒋胡艳,肖福泉,龚柳菲,薛新颖,邵 颖,涂 健,祁克宗,宋祥军
禽致病性大肠杆菌基因缺失对雏鸡气管黏膜细胞因子-细胞因子受体相互作用通路的影响
蒋胡艳,肖福泉,龚柳菲,薛新颖,邵 颖,涂 健,祁克宗,宋祥军*
(安徽农业大学动物科技学院,合肥 230036)
为探究基因在禽致病性大肠杆菌(Avian pathogenic, APEC)感染雏鸡气管黏膜过程中发挥的作用及机制。将APEC野生株(DE17)及其基因缺失株(DE17Δ)感染7日龄雏鸡气管,12、24 h后收集雏鸡气管黏膜细胞进行转录组学测序,筛选野生株和缺失株的差异表达基因,进行GO和KEGG富集分析。结果显示,在感染12 h后,共筛选到108个差异表达基因(36个上调,72个下调);在感染24 h后,共筛选到59个差异表达基因(34个上调,25个下调)。GO分析表明,差异表达基因主要富集在细胞内信号转导、RNA聚合酶Ⅱ的转录正调控等生物学过程;蛋白质结合、ATP合成、DNA结合等分子功能类;生物膜及膜的组成成分、细胞质等细胞组分功能;KEGG分析表明,差异表达基因主要富集在紧密连接通路、内质网中的蛋白质加工通路、细胞因子与细胞因子受体相互作用通路、内吞通路、Wnt信号通路等。结论为基因缺失后,会使部分差异表达基因的表达量下调,对细胞因子-细胞因子受体相互作用等通路产生影响。
禽致病性大肠杆菌;VI型分泌系统;基因;转录组学测序;气管黏膜细胞
禽致病性大肠杆菌 (Avian pathogenic, APEC) 属于肠道外致病性大肠杆菌,可引起局部或全身性感染[1],从而导致禽类多系统损伤,主要发病类型有气囊炎、肝周炎、卵黄性腹膜炎、输卵管炎等,严重可导致胚胎和幼雏死亡[2],不仅对养禽业的发展有巨大的影响,而且威胁人类的健康。APEC的致病机制十分复杂,有研究表明多种毒力因子是促进禽类肠道外疾病的起因。已发现的毒力因子包括:黏附素、溶血素、侵袭素、二元调控系统、群体感应系统和分泌系统等[3],多种因子能协调运作,增强APEC的致病力。其中,分泌系统能够将各种效应蛋白运送至胞外或直接注入宿主细胞内[4],在细菌侵入宿主感染机体的过程中发挥重要作用。
VI 型分泌系统 (type VI secretion system,T6SS) 是一种新型的细菌蛋白分泌系统,广泛的存在于革兰氏阴性菌中,可以介导致病菌与宿主的相互作 用[5],在APEC 的致病过程中扮演重要角色。T6SS是一种多功能的蛋白质注射装置,核心组分是13种蛋白和若干附属组件[6],主要由膜复合物,尾部复合物和基座复合物三部分组成[7]。T6SS通过跨双层膜管道以注射器的形式将分泌效应蛋白从胞质转运到靶细胞或胞外环境中[8],以接触依赖的方式主要靶向竞争菌以参与菌间竞争或靶向真核宿主从而致病[9]。T6SS的核心组分包括溶血素共调节蛋白(Hcp)、缬氨酸谷氨酸重复蛋白 (VgrG)、细胞器运输蛋白 (DotU)、ATP 水解酶 (ClpV) 等[10]。Hcp和VgrG既是T6SS的效应蛋白又是分泌蛋白,Hcp形成六聚环结构延伸至VgrG穿刺装置将效应蛋白注射到细胞内[11]。分子伴侣ClpV是T6SS中的能量结合蛋白,为T6SS 的运行提供能量[12]。
ClpV属于ATP酶超家族,与VgrG和Hcp蛋白结合形成复合物,进而为 T6SS分泌效应蛋白提供 ATP[13]。T6SS 基因簇编码的 ClpV蛋白在对 T6SS 提供能量过程中占主导地位,与整个系统能量供给相关。其与ATP结合后,利用水解获得的能量以六聚体形式水解底物蛋白,拆解T6SS,完成T6SS的回收和组装[14]。有研究发现,Hcp1的分泌需要ClpV AAA- 1结构域水解ATP,ClpV是在Hcp分泌过程中所必需的[15]。
在APEC感染宿主的过程中,细菌侵入并附着在禽类的呼吸道,黏附气管是APEC感染过程的一个重要步骤[16]。APEC感染雏鸡气管可导致气管黏膜发生病理变化,并导致细胞因子与细胞因子受体相互作用通路基因表达量发生变化[17]。有研究发现,基因缺失后,上清中无法检测到效应蛋白Hcp和VgrG,从而导致 APEC的T6SS功能的缺失[18]。基因对APEC的致病性有着重要作用,但基因在APEC感染禽气管黏膜过程中发挥的具体作用尚不清楚。基于此,本研究将基因缺失株通过气管感染雏鸡,并筛选气管黏膜细胞差异表达的mRNA,进行生物学信息分析。探究基因对雏鸡气管黏膜上皮细胞的调控作用,为进一步探究T6SS在APEC致病过程发挥的作用奠定基础。
1 材料与方法
1.1 供试材料
禽致病性大肠杆菌野生株 (DE17) 和基因缺失株DE17Δ前期已由实验构建得到[19],由安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室保存。试验雏鸡为购于安徽省安禽禽业有限公司的罗曼蛋鸡(1日龄)。
1.2 主要试剂
酵母提取物,购自上海生工公司;氯化钠、氯霉素、氨苄青霉素,卡那霉素购自上海生工公司;其他试剂有无菌PBS、液氮等。
1.3 雏鸡气管注射
将∆DE17以1∶100的比例进行转接,37 ℃培养至OD=1.0,无菌PBS洗涤菌液3遍,调整菌液浓度为1×106cfu·mL-1。购入的1日龄雏鸡同等条件下饲养至7日龄,将7日龄雏鸡分成4组(野生株2组,缺失株2组),每组3只。将处理好的菌液分别通过气管注射DE17和∆的方式感染7日龄雏鸡,按照50 μL、1×108cfu·mL-1的剂量感染,对照组注入等量的PBS。
1.4 雏鸡气管黏膜细胞转录组学测序
1.4.1 组织样品准备 分别于感染后的12、24 h刮取气管黏膜,收集气管黏膜上皮细胞,液氮冷冻后于﹣80 ℃保存,样品送至杭州联川生物公司,利用Illumina Novaseq™ 6000进行转录组测序。对测序的原始数据使用cutadap去除带接头 (Akdaptor) 的、无法确定碱基信息的比例大于5%的、低质量的reads,统计原始测序量,对有效测序量,Q20(质量大于20的碱基占总被测碱基的比值),Q30(质量大于 30的碱基占总被测碱基的比值),GC含量(基因中鸟嘌呤 (G) 和胞嘧啶 (C) 的总量在双股DNA 的4种碱基中的占比)进行综合测评,利用Hisat对预处理后的数据进行参考基因组比对。
1.4.2 差异表达基因的筛选 根据FPKM (fragments per kilobase of exon per million fragments mapped) 算法度量基因表达的丰度值,进行样本间差异分析,以|log2foldchange|≥ 1,≤ 0.05为标准对差异表达基因进行筛选。
1.4.3 GO与KEGG的富集分析 根据筛选出的差异基因,进行GO和KEGG富集分析,计算GO和KEGG数据库中各个条目映射的差异表达基因数目,并进行超几何检验。对比整个基因组,筛选出差异表达基因显著富集的GO条目和KEGG条目。
2 结果与分析
2.1 差异表达基因的筛选
以|log2fold change| ≥ 1,≤ 0.05为筛选标准,与野生株DE17相比,∆在感染气管的不同时间段均获得差异表达基因。在感染12 h后,共筛选到108个差异表达基因,其中,36个基因表达量上调,72个基因表达量下调,结果如图1(a)所示;在感染24 h后,共筛选到59个差异表达基因,其中,34个基因表达量上调,25个基因表达量下调,结果如图1(b)所示。根据筛选出的差异表达基因,得到感染∆组部分差异表达基因,结果如表1所示。
2.2 GO功能分析结果
对差异表达基因进行生物信息学分析,GO分析结果(表2)可得知,在感染Δ菌株12 h后,108个差异表达基因主要富集在RNA聚合酶Ⅱ的转录正调控、DNA转录调控、信号转导等生物学过程;蛋白质结合、ATP合成等分子功能类;生物膜及膜的组成成分、细胞质等细胞组分功能。在感染Δ菌株24 h后,59个差异表达基因主要富集在细胞内信号转导、RNA聚合酶Ⅱ的转录正调控等生物学过程;蛋白质结合、ATP合成、DNA结合等分子功能类;生物膜及膜的组成成分、细胞质等细胞组分功能。
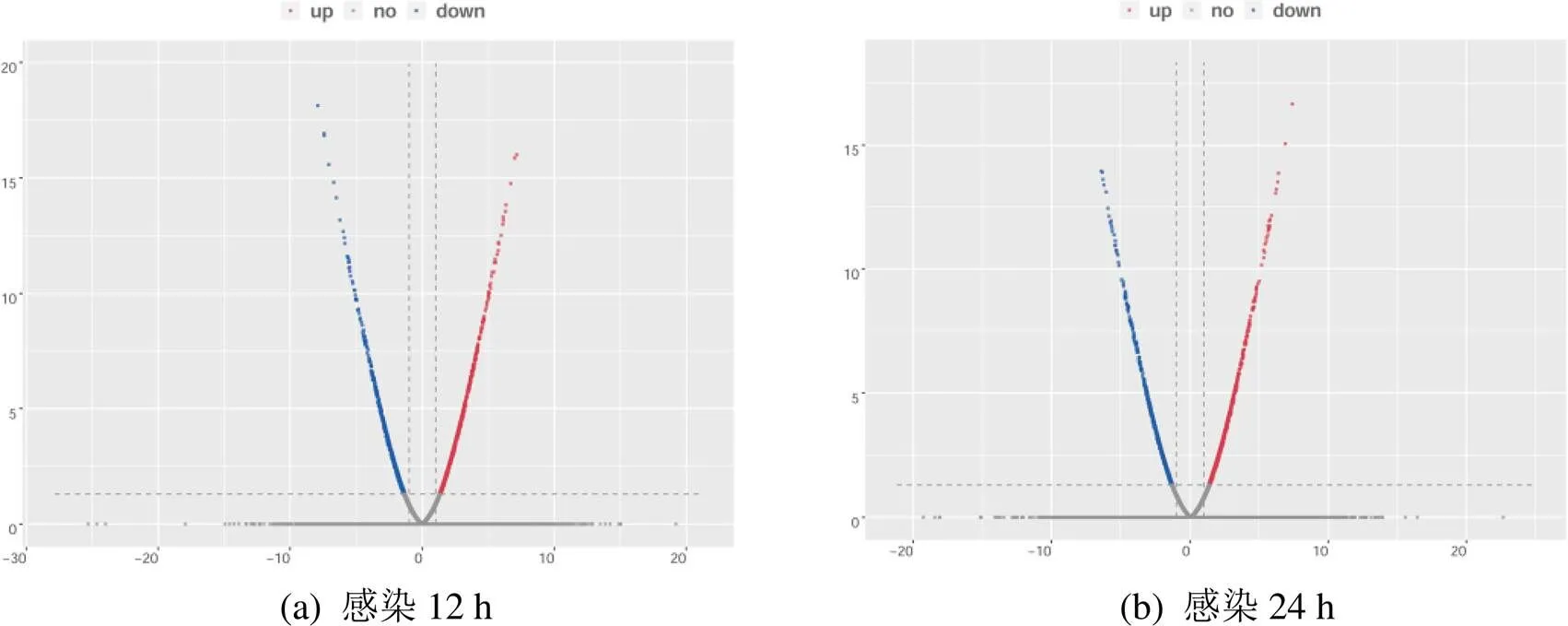
图1 差异表达基因的筛选
Figure 1 Screening of differentially expressed genes

表1 感染∆clpV组部分差异表达基因
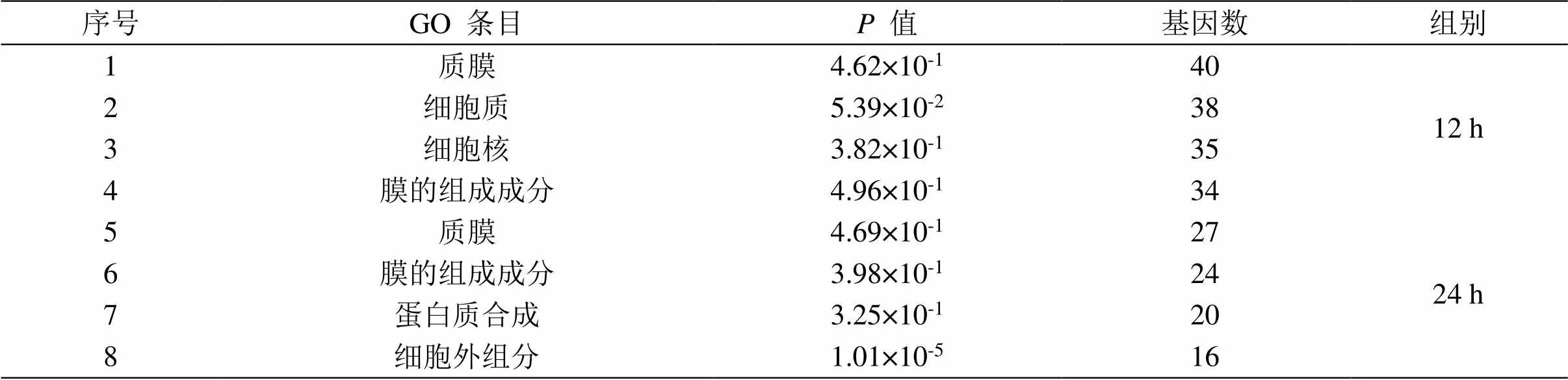
表2 感染∆ clpV组GO条目富集列表

图2 感染∆clpV组KEGG功能分析
Figure 2 KEGG function analysis of group infected by ∆
2.3 KEGG富集分析结果
通过计算差异表达基因,对其进行KEGG富集分析。横轴为Rich factor(富集因子),纵轴为pathway name(通路名称)。KEGG分析结果表明感染∆菌株12 h后,差异表达基因主要富集在细胞因子与细胞因子受体相互作用通路、内质网中的蛋白质加工通路等,如图2(a)所示。在感染∆菌株24 h后,差异表达基因主要富集在内吞通路、紧密连接通路、Wnt信号通路等,如图2(b)所示。
3 讨论与结论
禽致病性大肠杆菌是禽大肠杆菌病的主要病原菌,禽的大肠杆菌病是目前禽类最为常见的细菌性传染疾病之一[20],世界各地的养禽业都受到它的严重威胁。T6SS在APEC的竞争和致病过程中发挥着重要作用。2006年,在铜绿假单胞菌和霍乱弧菌中首次发现T6SS,并且T6SS首次作为新型的细菌蛋白分泌系统被定义[21]。T6SS类似于噬菌体尾鞘结构,通过膜相关的复合物锚定在细菌的细胞表面,细胞质内鞘的收缩推动由 Hcp蛋白组成的内管道通过由VgrG和PAAR组成的刺穿装置顶向靶细胞,与这个收缩结构相关的效应因子因此被转运到宿主细胞[22]。一旦效应因子被传递至靶细胞,收缩鞘就会在ClpV的作用下拆解。ClpV是AAA+蛋白家族成员[23],是六聚体ATP酶,位于细胞质内。ClpV 的N端无催化活性,C端具有ATP 结合结构域,为T6SS提供 ATP,但其对APEC的调控作用目前尚不清楚[24]。
禽致病性大肠杆菌感染宿主首先要黏附定殖于宿主细胞表面,黏附素是病原菌重要的毒力因子,位于细菌的表面,通过结合宿主细胞表面受体避免被宿主清除到体外[25]。因此,本研究将∆菌株以气管注射的方式感染雏鸡,以注射菌株DE17为对照组,研究基因缺失后对鸡气管黏膜细胞mRNA表达谱的影响。注射∆菌株12 h、24 h后,差异表达基因主要富集在内质网中的细胞因子与细胞因子受体相互作用通路、蛋白质加工通路、紧密连接通路等。前期已有试验发现APEC感染影响鸡气管内细胞因子-细胞因子受体相互作用通 路[26],本试验在此基础上,重点关注基因缺失后,对雏鸡气管内细胞因子-细胞因子受体相互作用通路的影响。
细胞因子是由免疫细胞及相关细胞产生的一类多功能蛋白多肽分子,种类繁多,可分为白细胞介素、干扰素、趋化因子等,它们与细胞因子受体结合才能发挥作用。细胞因子-细胞因子受体相互作用通路具有免疫调节和免疫效应相关功能,在细菌感染宿主的炎症过程中发挥重要调控作用[27]。分析测序结果总结发现,在感染12 h和24 h后,富集在细胞因子与细胞因子受体通路的差异表达基因分别为4个 (、、、) 和3个 () ,且表达量均显著下调。CCL5通过与其受体CCR1、CCR3、CCR4等结合时,发挥趋化活性[28],参与免疫反应。IL1β作为IL-1的重要成员之一,是由上皮细胞、单核细胞等产生的促炎细胞因子,可在细胞增殖、分化、凋亡等过程中发挥作用[29]。当IL1β与其受体结合后,即可诱发一系列炎症介质及相关趋化因子的释放,从而引发炎症反应。IL1β不仅可以通过旁分泌的方式作用于局部,还可以通过内分泌的方式引起全身免疫反应,同时IL1β还可以诱导其他细胞因子如IL6、IL8的表达[30]。基因缺失之后,导致、表达量的下调,降低了机体炎症反应的发生。
在真核细胞中,内质网作为蛋白质折叠、转录后修饰和转运的重要细胞器,参与蛋白质的加工以及运输。当机体受到外源抗原侵袭时,机体需要大量的抗体来应对抗原,机体产生抗体的过程中需要大量蛋白质。在感染∆菌株12 h后,富集在内质网中的蛋白质加工通路的差异表达基因表达量均上调,如等,这些基因参与蛋白质的翻译、折叠、转运和降解改变,从而导致内质网蛋白加工异常,宿主细胞发生病变[31]。大量的差异表达基因的上调,使得蛋白质输出增多,抗体增加,应对外源抗体,加快机体的恢复。这为深入研究基因在APEC致病中的作用提供思路。
紧密连接位于相邻细胞之间,维持着上皮细胞屏障和上皮细胞极性,是上皮和内皮细胞间的重要屏障结构[32]。细胞之间的紧密连接闭合了相邻上皮细胞之间的间隙,阻止了病原微生物和抗原物质进入黏膜的固有层以激活免疫细胞,并维持了黏膜屏障功能的稳定性[33]。在感染∆菌株24 h后,紧密连接通路中有3个基因上调表达和2个基因下调表达,这说明基因可能通过影响紧密连接功能进而导致黏膜屏障功能受损。
综上所述,禽致病性大肠杆菌基因缺失株可以通过细胞因子-细胞因子受体相互作用等通路影响机体的炎症反应和免疫过程。本研究初步探究了基因缺失后感染雏鸡后影响气管黏膜细胞的mRNA表达,差异表达基因主要富集在细胞因子-细胞因子受体相互作用通路,为深入研究 T6SS 的功能及防控禽致病性大肠杆菌提供了参考。
[1] CROXEN M A, FINLAY B B. Molecular mechanisms ofpathogenicity[J]. Nat Rev Microbiol, 2010, 8(1): 26-38.
[2] GONG J S, XU M, ZHU C H, et al. Antimicrobial resistance, presence of integrons and biofilm formation ofisolates from Eastern China (1962-2010)[J]. Avian Pathol, 2013, 42(3): 290-294.
[3] HVISTENDAHL M. Public health. China takes aim at rampant antibiotic resistance[J]. Science, 2012, 336(6083): 795.
[4] 林清鹏. 病原菌中六型分泌系统相关蛋白Hcp的结构与功能研究[D]. 合肥: 中国科学技术大学, 2017.
[5] 于菲菲. 六型分泌系统在猪源肠外致病性大肠杆菌引起宿主天然免疫过程中的作用研究[D]. 武汉: 华中农业大学, 2018.
[6] MA J L, BAO Y L, SUN M, et al. Two functional type VI secretion systems in avian pathogenicare involved in different pathogenic pathways[J]. Infect Immun, 2014, 82(9): 3867-3879.
[7] NAVARRO-GARCIA F, RUIZ-PEREZ F, CATALDI Á, et al. Type VI secretion system in pathogenic: structure, role in virulence, and acquisition[J]. Front Microbiol, 2019, 10: 1965.
[8] BOYER F, FICHANT G, BERTHOD J, et al. Dissecting the bacterial type VI secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?[J]. BMC Genomics, 2009, 10: 104.
[9] DURAND E, CAMBILLAU C, CASCALES E, et al. VgrG, Tae, Tle, and beyond: the versatile arsenal of Type VI secretion effectors[J]. Trends Microbiol, 2014, 22(9): 498-507.
[10] 连丽燕, 宋祥军, 蒋胡艳, 等. Ⅵ型分泌系统分泌蛋白ClpV对禽致病性大肠杆菌生物学特性的影响[J]. 中国预防兽医学报, 2021, 43(8): 848-853.
[11] 刘新. 禽致病性大肠杆菌Ⅵ型分泌系统2核心组分VgrG致病作用及调控研究[D]. 扬州: 扬州大学, 2016.
[12] 王栋, 王少辉, 徐凤, 等. Ⅵ型分泌系统2核心组分ClpB对禽致病性大肠杆菌生物学特性及致病性的影响[J]. 中国兽医科学, 2016, 46(7): 834-840.
[13] 岑雪, 丁雪燕, 娄昆鹏, 等. 细菌分泌系统研究进展[J]. 中国预防兽医学报, 2019, 41(3): 317-322, 327.
[14] HO B T, DONG T G, MEKALANOS J J. A view to a kill: the bacterial type VI secretion system[J]. Cell Host Microbe, 2014, 15(1): 9-21.
[15] 罗国栋. 嗜水气单胞菌Ⅵ型分泌系统分子伴侣蛋白ClpV基因的克隆及生物信息学分析[D]. 泰安: 山东农业大学, 2018.
[16] PIZARRO-CERDÁ J, COSSART P. Bacterial adhesion and entry into host cells[J]. Cell, 2006, 124(4): 715-727.
[17] SONG S J, JIANG H Y, QI Z, et al. APEC infection affects cytokine–cytokine receptor interaction and cell cycle pathways in chicken trachea[J]. Res Vet Sci, 2020, 130: 144-152.
[18] MA J L, BAO Y L, SUN M, et al. Two functional type VI secretion systems in avian pathogenicare involved in different pathogenic pathways[J]. Infect Immun, 2014, 82(9): 3867-3879.
[19] 连丽燕, 宋祥军, 蒋胡艳, 等. Ⅵ型分泌系统分泌蛋白ClpV对禽致病性大肠杆菌生物学特性的影响[J]. 中国预防兽医学报, 2021, 43(8): 848-853.
[20] 郭良富. 禽大肠杆菌病及其中西医防治[J]. 山东畜牧兽医, 2021, 42(3): 27-29.
[21] JANI A J, COTTER P A . Type VI secretion: not just for pathogenesis anymore[J]. Cell Host Microbe, 2010, 8(1): 2-6.
[22] 刘新. 禽致病性大肠杆菌Ⅵ型分泌系统2核心组分VgrG致病作用及调控研究[D]. 扬州:扬州大学, 2016.
[23] PIETROSIUK A, LENHERR E D, FALK S, et al. Molecular basis for the unique role of the AAA+chaperone ClpV in type VI protein secretion[J]. J Biol Chem, 2011, 286(34): 30010-30021.
[24] 宋祥军, 沈啸, 蒋胡艳, 等. 禽致病性大肠杆菌Hcp2b对雏鸡气管黏膜细胞因子-细胞因子受体相互作用通路的影响[J]. 畜牧兽医学报, 2021, 52(3): 742-751.
[25] 刘新, 王少辉, 孟庆美, 等. VI型分泌系统2核心组分VgrG对禽致病性大肠杆菌致病性的影响[J]. 微生物学通报, 2016, 43(9): 2106-2113.
[26] ONG S J, JIANG H Y, QI Z, et al. APEC infection affects cytokine–cytokine receptor interaction and cell cycle pathways in chicken trachea[J]. Res Vet Sci, 2020, 130: 144-152.
[27] 肖勘, 涂治骁, 黄菲菲, 等. 细胞因子信号传导抑制因子1在双氧水诱导的IPEC-1细胞炎症和损伤中的作用[J].中国畜牧杂志, 2021, 57(7): 159-163.
[28] GLASS W G, ROSENBERG H F, MURPHY P M. Chemokine regulation of inflammation during acute viral infection[J]. Curr Opin Allergy Clin Immunol, 2003, 3(6): 467-473.
[29] DONG M C, YANG L L, QU M L, et al. Autocrine IL-1β mediates the promotion of corneal neovascularization by senescent fibroblasts[J]. Am J Physiol Cell Physiol, 2018, 315(5): C734-C743.
[30] STORR S J, SAFUAN S, AHMAD N, et al. Macrophage-derived interleukin-1beta promotes human breast cancer cell migration and lymphatic adhesion[J]. Cancer Immunol Immunother, 2017, 66(10): 1287-1294.
[31] MOL N, PENG L C, ESNAULT E, et al. Avian pathogenicinfection of a chicken lung epithelial cell line[J]. Vet Immunol Immunopathol, 2019, 210: 55-59.
[32] 牛亚楠, 高宇, 何倚帆, 等. 上皮细胞黏附分子增强细胞间紧密连接促进乳腺癌细胞耐药[J]. 中国生物化学与分子生物学报,2022,38(6):809-815.
[33] 朱鹏. 十二指肠贾第虫组织蛋白酶B对肠上皮细胞紧密连接功能和抗菌肽表达的影响[D]. 哈尔滨:东北农业大学, 2021.
Effect of avian pathogenicgene deletion on the cytokine-cytokine receptor interaction pathway in chick tracheal mucosa
JIANG Huyan, XIAO Fuquan, GONG Liufei, XUE Xinying, SHAO Ying, TU Jian, QI Kezong, SONG Xiangjun
(School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036)
To investigate the role and mechanism of thegene in the process of Avian pathogenic(APEC) infection of the chicks racheal mucosa. In this study, 7-day-old chicks were infected with the wild strain (DE17) and the deletion strain (DE17Δ) of APEC, and the chicks' tracheal mucosa cells were collected 12 and 24 h later for transcriptomic sequencing to screen the differentially expressed genes of the wild strain and the deletion strain. The results showed that a total of 108 differentially expressed genes (36 up-regulated and 72 down-regulated) were screened 12 h after infection and 59 differentially expressed genes (34 up-regulated and 25 down-regulated) were screened 24 h after infection. GO analysis showed that the differentially expressed genes were mainly enriched in biological processes such as intracellular signal transduction, positive regulation of RNA polymerase II transcription; protein binding, ATP synthesis, DNA binding and other molecular functional classes; cellular component functions such as biofilm and membrane components, cytoplasm. KEGG analysis showed that the differentially expressed genes were mainly enriched in the tight junction pathway, protein processing pathway in the endoplasmic reticulum, cytokine-cytokine receptor interaction pathway, endocytosis pathway and Wnt signalling pathway, etc. It was concluded that deletion of thegene resulted in the down-regulation of the expression of some of the differentially expressed genes, with effects on pathways such as cytokine-cytokine receptor interactions.
avian pathogenic; type VI secretion system;gene; transcriptome sequencing; tracheal mucosal cells
S852.612
A
1672-352X (2023)02-0255-06
10.13610/j.cnki.1672-352x.20230511.007
2023-05-12 10:17:39
2022-04-29
安徽省大学生创新创业训练计划项目(S202110364034),国家级大学生创新创业训练计划项目(202110364009)和安徽省大学生创新创业训练计划项(202110364027)共同资助。
蒋胡艳,硕士研究生。E-mail:1678207529@qq.com 肖福泉,本科生。E-mail:2044548530@qq.com
通信作者:宋祥军,博士,副教授。E-mail:sxj@ahau.edu.cn
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20230511.1152.014.html

