接种炭疽病菌对不同抗性 核桃品种/品系生理指标的影响
翟蒙蒙 李学强 丁文轩 梁家乐 李秀珍 陈苏丹


摘 要: 【目的】炭疽病是目前危害核桃產业发展的严重病害之一,为了探究被炭疽病侵染后核桃的生理变化以及比较该病原对不同核桃品种/品系致病性的差异而进行了该试验,以期为今后在核桃的生产栽培上选育出抗病性的品种/品系提供理论支持。【方法】以抗性不同的5个核桃品种/品系果实为材料,测定了接种前后过氧化物酶(POD)、超氧化物歧化酶(SOD)、多酚氧化酶(PPO)、丙苯氨酸解氨酶(PAL)、几丁质酶(CHI)、肉桂酸4-羟基化酶 (C4H)等防御酶活性及发病率、病斑直径等指标。【结果】不同品种/品系核桃接种炭疽病菌后发病程度有差异,其中3个品种/品系表现高抗,多数防御酶在0~3 d时间段内达到峰值,0~3 d POD酶活变化量与发病率显著负相关,说明防御酶活性变化量越大,发病率越低,采用隶属函数法对每个品种/品系0~3 d酶活变化量综合评价,结果得出隶属函数平均值与发病率极显著负相关。【结论】单一的酶活性变化并不能作为品种抗性强弱的依据,而品种抗性是由0~3 d多种防御酶活性变化共同作用决定的。
关键词: 核桃;炭疽病;发病率;抗性评价;酶活性
文章编号:2096-8108(2023)01-0007-06 中图分类号:S664.1 文献标识码:A
Effects of Inoculation of Anthrax on Physiological Indexes of
Walnut Cultivars/Strains with Different Resistance
ZHAI Mengmeng, LI Xueqiang, DING Wenxuan, LIANG Jiale, LI Xiuzhen, CHEN Sundan
(College of Horticulture and Plant Protection, Henan University of Science and Technology, Luoyang 471023, China)
Abstract: 【Objective】Anthrax is one of the serious diseases that harm the development of walnut industry at present, in order to explore the physiological changes of anthrax infected walnut and the difference of pathogenicity of different walnut cultivars/strains were carried out this experiment, in order to provide theoretical support for the future production and cultivation of walnut breeding cultivars/strains resistant to disease.【Methods】5 cultivars/strains of walnut fruits with different resistance were used as materials. The activities of peroxidase (POD), superoxide dismutase (SOD), polyphenol oxidase (PPO), alanine ammonia lyase (PAL), chitinase (CHI), cinnamate 4-hydroxylase (C4H) and other defense enzymes were determined.【Results】The incidence of anthrax was different in different cultivars/strains of walnuts inoculated with anthrax. Three varieties/strains showed high resistance. Most of the defense enzymes reached the peak value in the period of 0~3 days, and the change of POD activity in 0~3 days was significantly negatively correlated with the incidence of the disease, indicating that the greater the change of defense enzyme activity, the lower the incidence of the disease. the mean value of membership function was significantly negatively correlated with the incidence of disease. 【Conclusion】Indicating that the change of single enzyme activity could not be used as the basis for the resistance of cultivar, but was determined by the joint action of the change of various defense enzyme activities during 0~3 days.
Keywords: walnut; anthrax; incidence of a disease; resistance evaluation; enzymatic activity
核桃( Juglans regia L.),又称胡桃和羌桃,胡桃科胡桃属落叶乔木,是世界上重要的木本油料树种,与腰果、榛子、扁桃被公认为“四大干果”[1],具有很高的营养价值和经济价值。据《本草纲目》记载,核桃具有润肺、补血、安神、健脾等功效[2]。我国是核桃的起源地之一,栽培面积和产量居世界之首[3]核桃生产区主要分布于新疆、陕西、安徽、山东、河北等地。近年来随着桃核栽培集约化规模的不断扩大,病虫害问题的发生日趋严重。炭疽病是目前危害核桃产业发展的主要病害之一。该病作为一种真菌性病害,寄主范围非常广,包括葡萄、柑橘、苹果、猕猴桃等大部分果树,以及辣椒、黄瓜、西红柿、茶树、花卉等多数经济作物,对农作物、经济林等植物造成极大危害。该病害在田间发病过程中具有潜伏期长、发病时间短、爆发性强等特点[4],对于管理粗放的果园严重时病果率高达80%[5],一旦大面积爆发,对核桃的品质和产量会造成不可预估的影响。该病病原菌通过空气、雨水、昆虫等媒介传播,从自然孔口或伤口侵入[6]。华中及华东地区一般于春季4月初左右孢子开始扩散,6月中下旬开始发病,7—8月开始爆发达到发病高峰,且雨水充足温度高的年份发病率高,10月中旬开始逐渐停止发病进入休眠准备越冬,主要以菌丝、分生孢子盘或分生孢子等形式在核桃的病叶、病果、枝条上越冬。一般以危害核桃的叶片和果实为主,叶片受侵染时发病部位出现不规则的褐色病斑,叶脉周围枯黄色,严重时蔓延至整个叶片。果实感病后呈现黑褐色近圆状或不规则形病斑,周边有小黑点,病斑中心软腐稍凹陷,不断扩大后最终致使全果变黑干缩脱落。空气湿度大时,在叶片或果实病斑周围出现橘红色粘稠状的分生孢子[7]。许多研究表明,植物受到病害胁迫后表现出一系列生理生化反应,在这个过程中,一些酶活性变化起着重要的调控作用[8]。目前,对于核桃炭疽病与寄主之间的互作机制有关研究甚少。因此,该研究通过测定分析接种炭疽病菌对5个核桃品种/品系致病性的差异,以期为今后在核桃的生产栽培上选育出抗病性核桃品种的选育提供理论支持。
1 材料与方法
1.1 试验材料及病原菌
供试材料为‘沁优1号‘沁优2号‘沁优3号‘钻石1号‘辽核1号5个核桃品种/品系的果实,其中‘沁优1号‘沁优2号‘沁优3号 果实采摘于河南科技大学沁陽核桃试验基地,‘钻石1号‘辽核1号果实采摘于洛阳沃塬农业有限公司的核桃丰产园。每个品种/品系选6株树龄相近、生长健壮的核桃树,每株采10个无病虫害的健康果实。供试炭疽病菌来自沁阳核桃试验基地病果上的致病菌株(HT),河南科技大学果树栽培生理实验室内将其分离、纯化,经分析鉴定为暹罗炭疽菌(Colletotrichum siamense)。
1.2 试验方法
将核桃果实先用自来水冲洗干净,晾干后进行处理。采用菌饼接种的方法,将分离纯化的菌株28 ℃活化培养7 d,用打孔器制成直径5 mm菌饼若干个,在健康核桃果肩部(果柄两侧)对称接种4个菌饼,每个接种点针刺5个梅花状孔,菌饼有菌丝一面紧贴接种点,接种完使用喷壶均匀喷洒少量无菌水,用无菌水润湿的脱脂棉包住叶果柄后装入自封袋密封保湿,重复3次,接种空白培养基为对照,放入28 ℃恒温气候箱中培养,在果实接种后的第3 d、6 d、9 d测量4个接种点的病斑最大直径;叶片则在叶脉两侧接种4个菌饼,重复3次。在叶片接种后的第3 d、5 d、7 d测量4个接种点的病斑最大直径。
1.3 项目测定
病情指数:在果实接种9 d后开始病害调查,参考王丰等[9]的方法略加改良,进行病情分级,计算病情指数(Disease index, DSI)。植株病情分为5级,病情0级:未发病;1级:病斑长度<2 mm;2级:病斑长度2~4 mm;3级:病斑长度4~6 mm;4级:病斑长度6 mm以上。
DSI= ∑(Sini) MN ×100
公式中,S表示果实发病级别,n表示该级别果实数,i表示病情级别,M表示最高发病级别,N表示调查果实总数。
抗性评价:核桃炭疽病抗性评价参照周主贵等[10]的方法,并加以修改,分为6个等级,根据病情指数划分,1级:免疫,DSI=0;2级:高抗,0
生理指标测定:在果实接种炭疽菌后第3 d、6 d、9 d分别取样。先去掉果实上打的菌饼,取样时取病斑周围果实,用剪刀剪碎后用锡箔纸分装9小包,液氮速冻后放入-20 ℃冰箱中保存。SOD活性测定采用氮蓝四唑(NBT)光化还原法[11];PPO、POD活性采用曹建康等[12]的方法;PAL活性参考段艳婷等[13]的方法;CHI活性参考王雪[14]的方法;C4H活性测定参照陈建业[15]的方法并加以修改。
隶属函数法对酶活性综合评价:采用公式U(Xij)=(Xij-Xjmin)/(Xjmax-Xjmin)计算不同品种酶活性隶属函数值,并求其平均值即为该品种的平均隶属函数值。
U(Xij)指i品种j指标的隶属函数值;Xij为i品种j指标的相对值;Xjmax是不同品种j指标的最大值;Xjmin是不同品种j指标的最小值。
1.4 数据处理与分析
采用Excel 2019进行数据统计、IBM SPSS Statistics 21软件进行数据处理及分析。
2 结果与分析
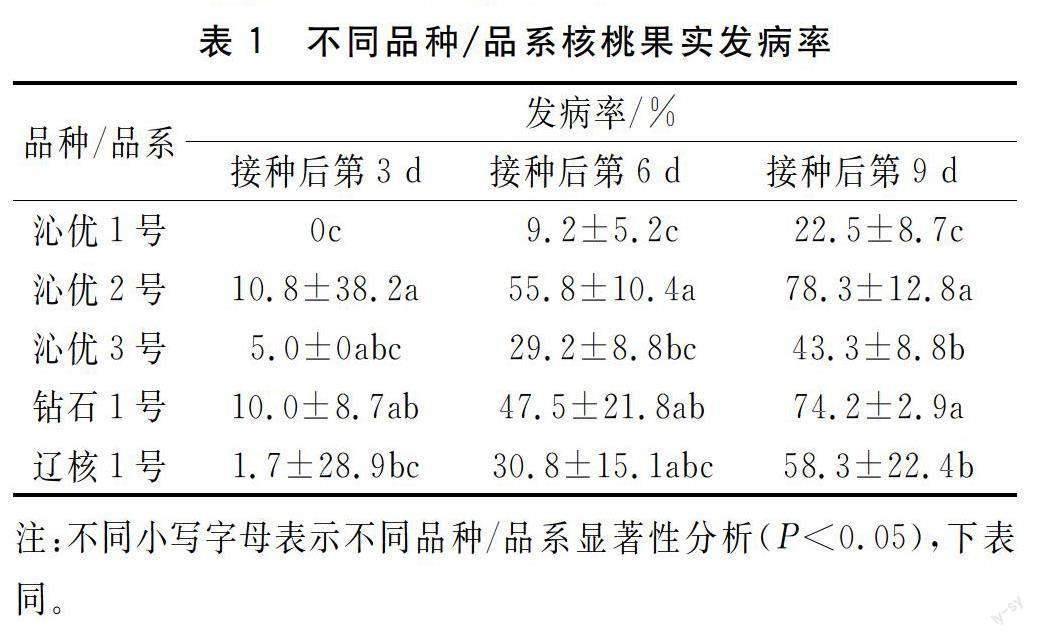
2.1 果实接种炭疽病菌后发病率变化
如表1所示,5个核桃品种/品系果实接种炭疽病菌后,‘沁优1号接种后第6 d开始发病,其余品种均在接种后第3 d发病,发病后各品种随时间变化发病率表现为持续上升趋势,但上升幅度因品种不同有所差异。处理期间,5个核桃
品种/品系
的发病率从高到低依次为‘沁优2号‘钻石1号‘辽核1号‘沁优3号‘沁优1号‘沁优2号钻石1号的发病率在接种后第9 d分别高达78.3%、74.2%,可见其发病程度严重,受病菌胁迫后极易发病,而‘沁优1号的发病率仅为22.5%,说明该品种/品系抗炭疽病能力较其他品种强。
2.2 果实接种炭疽病菌后病斑长度变化
对不同核桃品种/品系果实接种炭疽病,病斑长度统计结果如表2所示,病斑长度随时间变化不断扩大。处理期间,‘沁优2号接种炭疽病菌后病斑长度始终最大,到9 d达到5.534 mm,显著高于其余品种/品系,‘钻石1号和‘沁优3号次之,病斑长度分别为2.795 mm和2.136 mm。‘沁优1号前3 d未发病,到6 d受到侵染,病斑长度大于‘辽核1号。
2.3 果实接种炭疽病菌第9 d病情指数分析
病情指数是检验发病率与严重度的综合指标,通过计算病情指数能够得出不同品种核桃的抗性强弱。结果从表3看出,‘沁优1号的病情指数仅为8.8,属于高抗品系;‘钻石1号和‘辽核1号果实病情指数次之,分别为15.2、14.8,根据病情指数分级标准也属于高抗品系;‘沁优2号果实病情指数达到47.5,属于中抗品系;‘沁优3号果实病情指数为30.6,属于抗品系。
2.4 果实接种炭疽病菌后保护酶活性变化
由表4看出,接种后不同核桃品种/品系果实中不同酶活性变化达到的峰值时间有所不同。SOD活性变化为‘沁优1号‘沁优2号‘钻石1号‘辽核1号在接种6 d时达到最大值,‘沁优3号在接种3 d达到峰值,之后显著下降。PPO酶指标中,‘沁优1号在接种炭疽病菌后3 d就迅速达到最大值,之后显著下降,‘沁优2号‘辽核1号在第9 d PPO活性仍在保持上升,而‘沁优3号‘钻石1号在处理时间出现2次峰值,均出现在3 d、9 d。POD活性变化中,‘沁优3号‘钻石1号‘辽核1号在接种3 d后POD活性达到峰值,之后不同程度下降,‘沁优1号‘沁优2号在6 d 到达最大值,在第9 d又显著下降。PAL活性变化为‘沁优1号‘钻石1号接种后3 d达到峰值,‘沁优3号‘辽核1号在第6 d达到峰值,而‘沁优2号在9 d中出现2次峰值,分别在第3 d和第9 d。CHI活性变化中,在果实接种病菌后3 d达到峰值的有‘沁优1号‘沁优2号‘钻石1号‘沁优3号和‘辽核1号则分别在6 d、9 d升到最高。C4H酶活性变化中,‘沁优1号‘沁优2号在接种后3 d就到达峰值,之后C4H活性又显著下降,而‘沁优3号‘钻石1号‘辽核1号3个品种则在6 d达到高峰,之后显著下降。
2.5 接种炭疽病菌酶活性变化量与发病率、病情指数相关性分析
各种酶活变化量与发病率相关性如表5所示。
0~3 d PPO酶活变化量与发病率呈正相关,与病情指数呈负相关,SOD、POD、PAL、CHI、C4H活性与发病率、病情指数均呈负相关,且POD酶活变化与發病率呈显著负相关,说明POD活性变化量越大,核桃果实的发病率就越低。
2.6 隶属函数法对核桃果实酶活性进行综合评价
计算5个品种/品系核桃果实0~3 d酶活性变化量的隶属函数值,从而计算其平均值对每个品种0~3 d酶活性变化量进行综合评价。结果如表6所示,隶属函数平均值与果实发病率、病情指数相关系数分别达到-0.978、-0.741,且与发病率呈极显著负相关,表明果实0~3 d酶活性变化量与发病率密切相关,且酶活性变化越大,发病率就越低。
3 讨论与结论
核桃是我国重要的经济作物和木本油料树种[16],近年来,关于作物上抗病
品种的选育屡见不鲜,研究不同品种接种病原菌后的病斑直径、发病率,计算病情指数来比较品种之间的抗性成为生产栽培上选育抗性品种常用的手段。李亚[17]等使用核桃黄单胞单菌接种于4个核桃品种叶片,发现‘大泡核桃和‘三台核桃属于中抗和抗病品种;‘云新云林‘扎343属于感病品种。孙俊[18]采用喷雾、针刺喷雾、针刺涂抹叶片和针刺喷雾、针刺涂抹新梢等5种方法接种菌体悬浮液,结果得出‘辽宁7号的发病率最低,为3.33%,其次是‘礼品1号11.67%。杨汉波等[19]以18个核桃品种为材料,采用针刺接种炭疽病菌孢子悬浮液,结果得到‘辽核等12个高抗病材料,且‘蜀江1号与‘川早1号的病情指数为0,对炭疽病菌产生了极高的抗性。该研究中分析的‘辽核1号也属于高抗品系,但病情指数与杨汉波等试验有所差异,可能因本试验材料采集的地理位置、生长环境等与之有所差异所导致的抗性略有不同。‘沁优1号的病情指数为8.8,属于高抗品种,与‘大泡核桃的病情指数相似,但病情指数未达到0,且该研究中没有发现对炭疽病免疫的材料,应该是由于该研究采用的是室内离体接种,发病情况没有田间表现的抗性强。
植物抗病机制是一系列复杂的过程。把病原菌接种于植物后,植物体内的活性氧迅速增多,进而抑制孢子萌发及菌丝的生长,从而达到抵抗病菌的效果,这是植物最快也是最直接防御病菌的一道响应过程[20]。SOD、POD是植物体内重要的活性氧清除剂,与植物抗性关系密切[21],SOD是植物体清除活性氧的第一道防护线,促进超氧化物歧化反应,提升植物在逆境胁迫下的耐受程度,此外,POD还与木质素催化合成相关,木质素可以使接种病菌处细胞组织木质化,从而抵御病菌传播扩散[22]。当植物受到病害侵染时会导致PPO基因表达上调,产生醌类化合物使酶活升高,从而抑制病原菌的扩散,达到抵御病害侵染的目的。
PAL和C4H是主导和限制苯丙烷类代谢过程的关键酶,苯丙烷代谢是植物关键的次生代谢途径,该途径与木质素、酚酸、肉桂酸等抗病相关的次生代谢物合成有关,影响着植物的抗性水平[23]。CHI是类黄酮生物合成途径中的关键酶,与多酚和类黄酮合成相关,影响植物抗病能力[24]。多酚是植物体内重要的次生代谢物,在植物生长发育过程中作为信号分子和化感物质,影响着植物的生理代谢和发育[25]。温欣[26]利用丁香假单胞杆菌接种于不同品种软枣猕猴桃后研究其防御酶活性变化,发现接种后‘魁绿酶活性显著高于‘徐香和‘红阳,POD、PPO、PAL酶活性均不同程度上升,抗病品种酶活性高于感病品种。林英等[27]对不同抗性品种花生接种褐斑病菌,高抗品种‘鲁花11号叶片PPO活性含量于7 d达到最大值,而高感品种‘粤油7号在15 d达到峰值,且上升幅度小,得出品种抗性越强防御酶活性越高。曾祥国等[28]选用草莓新品种‘晶玉材料,对其接种炭疽病菌后发现绿原酸、木质素、阿魏酸、总酚、PPO、PAL均与‘晶玉抗病能力有关,且这些生理因子含量的增加可能是抗病机制之一。该研究通过对不同品种/品系核桃果实接种后其防御酶活性的变化进行测定和分析,不同核桃品种果实中多数酶活性含量的变化均呈现出先小幅上升后下降的趋势, 少数酶活性出现两次峰值,且抗性品种/品系中‘沁优1号POD、CHI活性,‘钻石1号PAL、C4H活性,‘辽核1号SOD、PPO的含量相对较高, 在接种后3 d ‘沁优1号果实中的PPO、PAL、CHI、C4H活性含量即达到最大值, 而‘沁优2号PPO活性出现高峰的时间相对滞后。同时,高抗品种/品系‘沁优1号‘钻石1号果实的多个酶活性在3 d达到峰值。相关性分析得出0~3 d POD活性与发病率呈显著负相关,隶属函数法对6个酶活变化进行相对评价,并综合这些评价值从而得出各品种/品系的整体评价值[29],发现果实接种炭疽菌0~3 d时6个酶活变化量的隶属函数平均值与发病率有关,说明品种抗性强弱是由在多种酶共同作用下决定的,单一的酶活变化量并不能作为品种抗性强弱的依据。该研究发现,抗性越强的核桃品种接种后防御酶活性达到峰值越快,高抗品种的防御酶活性高于其他中抗、抗性品种。
参考文献
[1] 袁文良.养生保健话核桃[J].健康向导,2022,28(1):62.
[2] 李时珍.本草纲目(下冊)[M].北京:人民卫生出版社,1982:1084.
[3] 张力思,陈新,徐丽,等.核桃种质资源工作现状与展望[J].落叶果树,2017,49(6):17-21.
[4] 郑灿平,王玉存.核桃炭疽病的综合防治[J].泰山学院学报,2018,40(3):107-109.
[5] 武红霞.2015—2019年核桃炭疽病发生情况调研[J].烟台果树,2020(1):49.
[6] 曾绍贵.核桃炭疽病及防治方法研究进展[J].四川林业科技,2017,38(1):108-110.
[7] 孙静.核桃炭疽病发病症状与防治措施[J].果农之友,2019(7):30,40.
[8] 宋瑞芳,丁永乐,宫长荣,等.烟草抗病性与防御酶活性间的关系研究进展[J].中国农学通报,2007(5):309-314.
[9] 王丰,马跃,高秀岩,等.草莓品种对炭疽病抗性的鉴定技术研究[J].果树学报,2008(4):542-547.
[10] 周主贵,黄昌艳,王晓国,等.不同种金花茶对炭疽病的自然抗性评价[J].中国植保导刊,2019,39(10):14-19.
[11] 阎秀峰,李晶,祖元刚.干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,1999,19(6):850-854.
[12] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:102-104.
[13] 段艳婷,李学强,耿杰,等.‘优选1号欧李果叶涩味物质变化[J].北方园艺,2020(24):8-15.
[14] 王雪.欧李与桃嫁接亲和性的解剖及生理基础研究[D].河南:河南科技大学,2016.
[15] 陈建业.葡萄酒中酚酸及葡萄果实苯丙烷类代谢途径研究[D].北京:中国农业大学,2005.
[16] 种伟.我国核桃主要产区优势良种分布及其生产利用[J].林业科技通讯,2018(9):60-63.
[17] 李亚,韩颖,杨斌,等.黄单胞杆菌侵染后不同品种核桃抗病性相关生理指标的测定[J].福建农林大学学报(自然科学版),2020,49(4):453-458.
[18] 孙俊.核桃不同品种(系)对细菌性黑斑病的抗性鉴定[J].湖北农业科学,2014,53(5):1058-1060.
[19] 杨汉波,曹广黎,韩珊,等.核桃对炭疽病菌抗性相关的生理生化响应差异研究[J].四川农业大学学报,2020,38(4):463-470.
[20] BIBHUTI B.MISHRA,SATYENDRA GAUTAM,ARUN SHARMA.Purification and characterization of polyphenol oxidase (PPO) from eggplant (Solarium melongena)[J]. Food Chemistry,2012,134(4):1855-1861.
[21] Li M,Hong Y,Wang X.Phospholipase D-and phosphatidic acidmediated signaling in plants[J].Biochimica Et Biophysica Acta Molecular & Cell Biology of Lipids,2009, 1791(9):927-935.
[22] 王丽,王万兴,索海翠,等.植物中多酚氧化酶基因研究进展[J].分子植物育种,2020,18(14):4629-4636.
[23] 曹晶晶,于子超,张颖,等.外源褪黑素对苹果采后灰霉病的防效及防御酶活性的影响[J].植物生理学报,2017,53(9):1753-1760.
[24] 唐亚琴,梅抗抗,陈瑶,等.油橄榄类黄酮生物合成相关酶的研究进展[J].基因组学与应用生物学,2018,37(5):2110-2117.
[25] M.RUDNICKA, M.POLAK, W.KARCZ.Cellular responses to naphthoquinones:juglone as a case study[J].Plant Growth Regulation:An International Journal on Natural and Synthetic Regulators,2014,72(3):239-248.
[26] 温欣.软枣猕猴桃种质资源溃疡病抗性评价及抗性生理研究[D].中国农业科学院,2020.
[27] 林英,张海东,谢瑾卉,等.花生褐斑病菌侵染对不同抗性花生活氧代谢及防御酶的影响[J].湖北农业科学,2018,57(16):51-56.
[28] 曾祥国,张鹏,韩永超,等.草莓新品种‘晶玉抗炭疽病相关的生理因子分析[J].中国农学通报,2016,32(34):113-118.
[29] 薛惠芬,于晓池,付鹏跃,等.黄心梓木优良无性系评价与初选[J].西北林学院学报,2022(2):1-7.

