橡胶狗尾草平脐蠕孢叶斑病病原菌鉴定及生物学特性研究
刘一贤 施玉萍 戴利铭 李岚岚 蔡志英

摘要 为明确采自西双版纳景洪地区疑似橡胶麻点病的病原菌,采用组织分离法进行病原菌分离,活体接种法进行致病性测定,通过形态学观察结合rDNA-ITS和GAPDH两个核苷酸片段序列分析,将病原菌确定为狗尾草平脐蠕孢Bipolaris setariae。通过单因子变量试验,对病原菌进行生物学特性研究,结果表明:菌丝生长最适温度为30℃,最适pH为7~8,最适培养基为PDA,菌丝致死温度为53℃,10 min。该病原菌能有效利用多种碳源和氮源,碳源以可溶性淀粉利用率最高,最适氮源为蛋白胨。24 h黑暗条件下培养更有利于菌丝生长。分生孢子萌发的最适温度为28~35℃,最适pH为7~8,28℃黑暗培养2 h后萌发率达到最大,为95.5%,分生孢子致死温度为60℃,10 min。
关键词 橡胶树; 叶斑病; 狗尾草平脐蠕孢; 生物学特性
中图分类号: S 436.85
文献标识码: A
DOI: 10.16688/j.zwbh.2021676
Abstract In order to identify the pathogen of suspected rubber tree leaf spot disease with symptoms similar to the disease caused by Bipolaris heveae, the samples were collected from Jinghong, Xishuangbanna, and the tissue isolation method was used to isolate and culture the pathogen, and the in vivo inoculation method was used to determine its pathogenicity. The pathogen was identified as Bipolaris setariae according to the morphological characteristics and analysis of rDNA-ITS and GAPDH gene sequences. The single-factor variable experiments were carried out to determine the optimum conditions for its mycelial growth and spore germination. The results showed that the optimum temperature for mycelium growth was 30℃, and the optimum pH value was 7-8. PDA was the optimal medium for hyphal growth and the lethal temperature for the mycelium was 53℃ for 10 min. A lot of carbon and nitrogen resources could be used by the pathogen, and the most suitable carbon and nitrogen sources were starch and peptone. Full dark treatment was more favorable for mycelium growth. In addition, the optimum temperature for conidial germination was 28-35℃ and the optimum pH value was 7-8. The germination rate (95.5%) was the highest after culture for 2 h at 28℃ in dark. The lethal temperature for the conidia was 60℃ for 10 min.
Key words rubber tree; leaf spot disease; Bipolaris setariae; biological characteristic
橡膠树是热带地区重要经济作物,其产生的天然橡胶是工业上的重要原材料,广泛用于交通、国防、医疗和日常生活等领域,是一种重要的战略资源[1]。橡胶树病虫害是制约橡胶产业发展的一大难题,据联合国粮农组织报道,由病虫害导致的橡胶减产约占总产量的25%[2]。目前已经报道的橡胶病害有近百种,我国有91种,对橡胶生产造成严重危害的叶部病害主要有橡胶白粉病、炭疽病、棒孢霉落叶病、季风性落叶病[3]。
橡胶叶斑病是橡胶树上最常见的病害,随着全球气候变暖,农业气候带移动[4],橡胶树种植年限增加,胶园缺乏管理等问题,出现了一些新的病害。近几年报道了由链格孢Alternaria spp.[5]、可可毛色二孢Lasiodiplodia theobromae[6]、嘴突凸脐蠕孢Exserohilum rostratum[7]和新拟盘多毛孢属的Neopestalotiopsis aotearoa[8]等病原菌引起的叶斑病。笔者在中国橡胶主产区云南省西双版纳州开展橡胶树病害调查过程中,在景洪农场增殖苗圃‘云研77-4上发现一种新叶斑病,染病叶片病斑呈红褐色小点或黑色小点,小点直径为0.2~3 mm,周围伴有黄色晕圈,病斑小而多。其症状特点与橡胶树平脐蠕孢Bipolaris heveae引起的橡胶麻点病[9]相似,在田间易混淆,麻点病在橡胶树接近老化的叶片上只出现深褐色小点,病斑小而多。此次调查发现,该病害目前主要在橡胶苗圃中危害橡胶嫩叶。为了探究该病害的病原菌,本研究对采集到的病样进行组织分离,柯赫氏法则验证,病原菌形态观察结合分子鉴定,从而确定病原菌的分类地位;在此基础上,对其生物学特性进行研究,为了解该病害的发生规律以及病害的有效控制提供参考依据。
1 材料与方法
1.1 病样采集
在云南省西双版纳州景洪农场‘云研77-4橡胶苗圃基地采集具有典型症状的病叶标本,装于自封袋内并做好标记。带回实验室后分离病原菌,观察记录发病情况,测量病斑大小。
1.2 病原菌分离与纯化
采用组织分离法分离病原菌。取病健交界处组织,用75%乙醇浸泡30 s,0.1%升汞溶液消毒1 min,无菌水漂洗3次,滤纸吸干水分后置于PDA培养基上。于28℃暗培养3 d后,挑取菌落边缘菌丝转接,用平板稀释法进行单孢分离获得纯培养菌株,于4℃和-80℃保存。
1.3 分离菌株的致病性测定
孢子悬浮液的制备。选取纯化后的代表性菌株JH1a,于PDA培养基上28℃培养7 d。用无菌水冲洗孢子,无菌纱布过滤菌丝后制成浓度为104个/mL的孢子悬浮液。
田间接种试验。采用古铜期的‘云研77-4橡胶苗叶片进行无伤接种。处理组每株喷雾10 mL菌株JH1a孢子悬浮液,以喷雾接种无菌水为对照,每处理接种3株,重复3次。接种后植株用塑料袋套袋保湿2 d后去掉塑料袋,继续定期观察。待植株出现症状后,采集感病叶片再进行病原的分离鉴定。
1.4 病原菌鉴定
1.4.1 病原菌形态观察
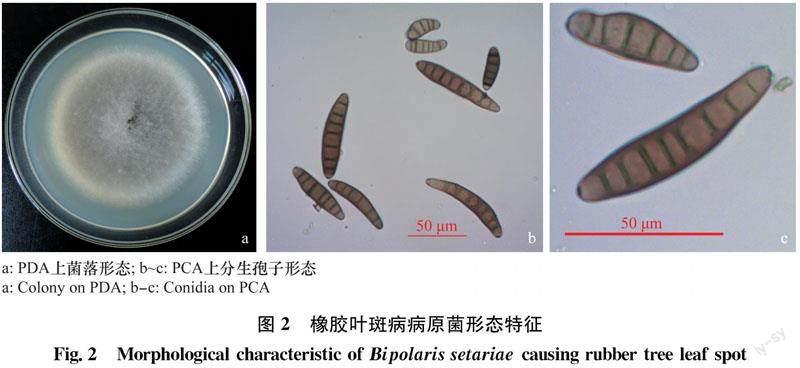
将菌株JH1a接种在PDA培养基上,28℃暗培养4 d,观察菌落形态并测量菌落直径。将菌株接种到PCA(马铃薯200 g,胡萝卜200 g,琼脂20 g,蒸馏水1 000 mL)平板上28℃暗培养5 d,从接种点附近挑取小块培养基,制作玻片[10]。使用Axio Lab. A1型蔡司显微镜拍照记录产孢结构及分生孢子特征,脐点特征,测量分生孢子大小,记录隔膜数等。
1.4.2 分子鉴定
采用基因组DNA提取试剂盒(康为世纪生物科技股份有限公司)提取菌株JH1a基因组DNA。采用核糖体内转录间隔区rDNA-ITS通用引物ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[11]和3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)编码基因引物GDF1(5′-GCCGTCAACGACCCCTTCATTGA-3′)/GDR1(5′-GGG-TGGAGTCGTACTTGAGCATGT-3′)[12]分别扩增ITS和GAPDH核苷酸片段,PCR产物经琼脂糖凝胶电泳检测后送北京六合华大基因科技有限公司广州分公司进行测序。
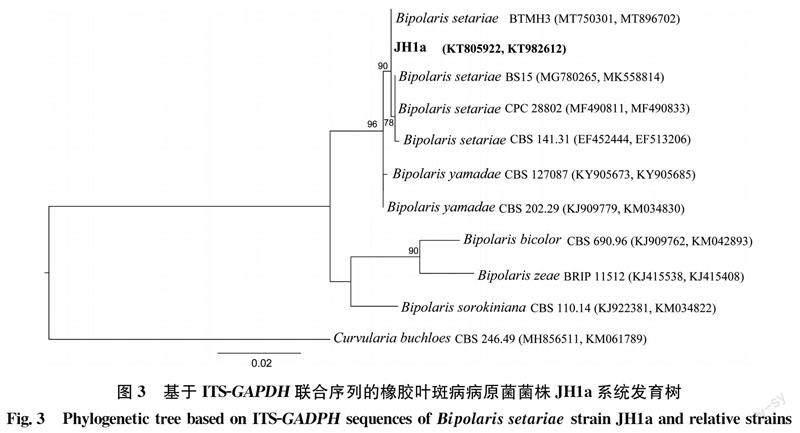
测序结果经BLAST比对后,从GenBank数据库中筛选下载相关菌株序列。采用最大似然法对ITS-GAPDH序列进行系统发育分析,以Curvularia buchloes CBS 246.49作为外群,ML分析采用MEGA 6.0,bootstrap重复值为1 000次。
1.5 病原菌JH1a菌株生物学特性测定
1.5.1 不同条件对菌丝生长的影响
培養基:将活化的菌株JH1a分别接种于不同培养基上,V8汁培养基(市售V8汁200 mL、CaCO3 3 g、琼脂20 g,定容至1 000 mL)、Czapek (NaNO3 3 g/L,K2HPO4 1 g/L,KCl 0.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO4 0.01 g/L,蔗糖20 g/L,琼脂20 g/L)、YEPD(酵母浸膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L)、SNA(KH2PO4 1.0 g/L,KNO31.0 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,葡萄糖0.2 g/L,蔗糖0.2 g/L,琼脂20 g/L)、OA(燕麦30 g/L,葡萄糖20 g/L,琼脂20 g/L)、PCA、PDA 7种培养基, pH自然。重复3次。28℃黑暗培养4 d后观察病原菌生长情况,用十字交叉法测量菌落直径。
温度:将活化的菌株JH1a接种在PDA培养基上, pH自然,设置培养温度为5、10、15、20、25、28、30、35℃。重复3次。黑暗培养4 d后用十字交叉法测量菌落直径。
pH:设置PDA培养基灭菌后的pH为3、4、5、6、7、8、9、10、11,制成不同pH的PDA平板。重复3次。28℃黑暗培养4 d后用十字交叉法测量菌落直径。
碳源:用葡萄糖、麦芽糖、乳糖、果糖、半乳糖、可溶性淀粉、山梨醇、木糖、甘露醇、鼠李糖、甘油等11种碳源等量代替Czapek培养基中的蔗糖,制成不同碳源的培养基,pH自然。重复3次。28℃黑暗培养4 d后用十字交叉法测量菌落直径。
氮源:用L-天冬酰胺、酪氨酸、甘氨酸、牛肉浸膏、蛋白胨、尿素、L-丙氨酸、NaNO2、NH4Cl、胱氨酸、色氨酸、L-精氨酸、酵母浸膏、(NH4)2SO4等14种氮源等量代替Czapek培养基中的NaNO3, pH自然,制成不同氮源培养基。重复3次。28℃黑暗培养4 d后用十字交叉法测量菌落直径。
光照:设置24 h黑暗、24 h光照、L∥D=12 h∥12 h,3种光照条件。采用PDA培养基,pH自然,重复3次。28℃培养4 d后用十字交叉法测量菌落直径。
致死温度:在试管中加入无菌水,挑取菌丝块放入试管中,设置水浴锅温度为40、45、50、55、60、65℃,将试管置于不同温度下处理10 min后,挑取菌丝块置于PDA培养基上。获得菌丝致死温度范围后,以1℃温度差设置温度梯度,明确菌丝致死温度。
1.5.2 不同条件对孢子萌发率的影响
光照:采用悬滴法[13]测定孢子萌发率。菌株分生孢子悬浮液配制方法同1.3,下同。取少量无菌水配制的孢子悬浮液,置于载玻片上,设置黑暗、光照两种条件,28℃培养,测定2、4、6 h的分生孢子萌发率。
温度:设置培养箱温度为5、10、15、20、25、28、30、35、40℃,取少量无菌水配制的孢子悬浮液,置于不同温度下,黑暗培养2 h后观察分生孢子萌发率。
pH:采用pH为3、4、5、6、7、8、9、10、11的磷酸缓冲液配制孢子悬浮液,28℃黑暗培养2 h后观察分生孢子萌发率。
孢子致死温度:设置水浴锅温度为40、45、50、55、60、65、70、75℃,将孢子悬浮液置于不同温度下处理10 min后进行涂板,获得孢子致死温度范围后,以1℃温度差设置温度梯度,明确分生孢子致死温度。
每处理重复3次,随机镜检100个孢子统计萌发率。
1.6 数据分析
利用Excel 2003和SAS 9.2软件对试验数据进行统计分析和GraphPad Prism 8.0软件作图,并应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 病原菌分离及致病性测定
从云南省西双版纳州景洪农场橡胶‘云研77-4叶片上共分离得到4个菌株,通过对菌株形态和培养特征观察,确定为同种真菌,选取具有代表性的菌株,编号为JH1a,进行后续试验。活体接种菌株JH1a孢子悬浮液5 d后橡胶叶片上病斑呈红褐色小点或黑色小点,直径为0.2~3 mm,周围有黄色晕圈,与在田间观察到的病害特征一致(图1),而对照组叶片没有出现发病症状。对人工接种的发病叶片进行再次分离,分离得到的菌株其培养特征和分生孢子形态与JH1a菌株一致,确认JH1a菌株为橡胶叶斑病的病原菌。
2.2 病原菌形态特征
病原菌在PDA培养基上培养4 d菌落直径为7.55 cm,菌落初为白色,逐渐变为青灰色,边缘白色,菌落平展,气生菌丝发达(图2a)。显微镜下观察分生孢子梗单生或簇生,浅褐色至中度褐色,顶端色淡,多个隔膜,上部常作屈膝状弯曲,宽4.60~7.36 μm。分生孢子浅黄褐色至中度黄褐色,多数呈纺锤形,常略弯曲,极少直,光滑,4~10个假隔膜,孢子大小为(34.48~82.28) μm ×(9.93~15.55) μm,平均(53.64 × 11.75) μm,脐点略突出,基部平截(图2b~c)。形态特征与狗尾草平脐蠕孢Bipolaris setariae[10]相符。
2.3 菌株JH1a的分子生物学系统发育分析
经ITS1和ITS4引物对菌株JH1a进行PCR扩增并测序,得到了长度为507 bp的rDNA-ITS序列(GenBank登录号: KT805922)。其与狗尾草平脐蠕孢Bipolaris setariae(KR183790.1、MT750297.1、MT750301.1、MT750303.1)的一致性为100%。对菌株GAPDH基因的部分序列进行扩增并测序,得到591 bp的序列(GenBank登录号: KT982612)。该序列与B.setariae (MF490833.1、MW473722.1、MT896702.1、MK558814.1、EF513206.1)的GAPDH基因序列一致性为100%。ITS-GAPDH序列系统发育树显示,JH1a菌株与B.setariae聚在同一分支(图3),综合以上信息,证明JH1a菌株为狗尾草平脐蠕孢Bipolaris setariae (Sawada) Shoemaker。
2.4 不同环境条件对病原菌JH1a菌丝生长的影响
2.4.1 温度对菌丝生长的影响
由图4可以看出,菌株JH1a在10~35℃范围内均可生长,在5℃条件下停止生长。菌丝生长适宜温度范围为25~30℃,最适温度为30℃,35℃时菌丝生长受到显著抑制。
2.4.2 酸堿度对菌丝生长的影响
菌株JH1a对酸碱度的适应范围较广,在pH 3~11范围内均可生长,最适宜菌丝生长的pH为7~8,pH小于5或高于10时,菌丝生长受到显著抑制(图5)。
2.5.2 温度对孢子萌发的影响
菌株JH1a的分生孢子萌发温度范围较广,5~40℃黑暗培养2 h 都可萌发(图9),最适合孢子萌发的温度范围为28~35℃。28℃、30℃和35℃下的萌发率无显著差异。当培养温度低于28℃时,分生孢子萌发率显著降低。JH1a的分生孢子对低温有一定的耐受能力,5℃时萌发率为18.79%;对高温较敏感,当温度为40℃时萌发率急剧下降,仅为9.95%。
2.5.3 酸碱度对孢子萌发的影响
菌株JH1a的分生孢子在pH 4~11范围内黑暗培养2 h都能萌发(图10)。当pH小于5或大于8时,分生孢子萌发受到显著抑制,在pH为3时分生孢子停止萌发。分生孢子萌发最适pH为7~8,pH 7.0时,萌发率达到最高,为86.20%。
2.5.4 分生孢子致死温度
菌株JH1a分生孢子悬浮液在55℃水浴锅中处理10 min能形成新的菌落,60℃处理相同时间后不能形成新菌落。进一步以1℃为梯度设置5个温度处理,发现59℃处理10 min能形成新的菌落,60℃处理相同时间不能形成新菌落。说明分生孢子的致死温度为60℃,10 min,高于菌丝致死温度。
3 结论与讨论
平脐蠕孢属Bipolaris真菌是分类学上一个较大的类群,包含约60个已知种[14]。该属真菌是重要的植物病原菌,在世界范围内广泛分布,能引起多种禾本科植物病害,同时对其他种类的植物也有致病性,如:苦瓜Momordica charantia[15]、牧草[16]、青苹果竹芋Calathea rotundifolia cv. fasciata[17]、椰子Cocos nucifera等[18],对农业生产造成巨大威胁[19]。狗尾草平脐蠕孢Bipolaris setariae于1912年被首次记录为Helminthosporium setariae Sawada,1959年被正式命名为Bipolaris setariae[14]。该菌主要危害禾本科杂草[20],除此之外还能引起木薯叶斑病[21]、椰子叶斑病[22]、玉米叶斑病[23]、多枝臂形草叶枯病[24-25]、杉木叶枯病[26]等多种植物病害。对平脐蠕孢属真菌的鉴定目前多采用多基因序列联合分析,5.8S rDNA-ITS区的DNA序列为该类真菌在GenBank中信息量最大的序列,在该类真菌鉴定中作为首选分子标记,其次GAPDH基因扩增效率较高且较为保守,也常用作该类真菌的分子标记。EF-1α、CAL等可作为补充基因[27]。本研究中选用ITS-GAPDH 进行分析,结合形态特征将分离到的JH1a菌株鉴定为狗尾草平脐蠕孢Bipolaris setariae。平脐蠕孢属的橡胶树平脐蠕孢B.heveae[9]、双色平脐蠕孢B.bicolor[28]也能引起橡胶叶斑病,尤其橡胶树平脐蠕孢引起的麻点病和狗尾草平脐蠕孢引起的叶斑病在田间症状极为相似,其共同点是病斑小而多,区别在于橡胶麻点病病斑后期中央灰白色易穿孔[9],而狗尾草平脐蠕孢引起的叶斑病不易形成穿孔。
本研究對狗尾草平脐蠕孢的生物学特性测定结果表明,菌丝在10~35℃条件下均可以生长,最适生长温度为30℃,在5℃时停止生长,菌丝的致死温度为53℃,10 min。菌丝生长的最适pH为7~8,与橡胶上发现的嘴突凸脐蠕孢研究结果一致[29]。平脐蠕孢和凸脐蠕孢的分生孢子同为蠕形,是从长蠕孢属Helminthosporium Link划分出来的[27],因此在同一寄主上的生长特性较为相似。本研究比较了菌株对14种氮源和11种碳源的利用情况,发现该菌株对碳源、氮源利用范围较广泛,最适合菌丝生长的氮源为蛋白胨,碳源为可溶性淀粉,病原菌对营养物质的要求不高。最适合菌丝生长的培养基为PDA。绝大多数蠕形分生孢子真菌在PDA培养基上都生长良好,因此PDA培养基适合用于此类菌株分离和菌落形态观察,但PDA培养基上分生孢子形态变异较大,进行孢子形态观察时应选用营养相对贫乏的培养基[10]。该菌株分生孢子萌发对pH较敏感,仅在pH 6~8范围内萌发率较高,但菌丝生长对pH不敏感,在过酸(pH=3)和过碱(pH=11)的环境中均可以生长,说明该病原菌对环境具有较强的适应能力。分生孢子萌发的最适温度范围为28~35℃,35℃时分生孢子的萌发率仍能达到91.6%,而菌丝在35℃时生长明显受限,且分生孢子的致死温度为60℃,10 min,明显高于菌丝致死温度(53℃,10 min),说明分生孢子对高温耐受能力较强,可能跟其所处的热带高温环境有关。黑暗条件更有利于菌丝生长和分生孢子萌发。本研究结果与牛晓庆等[22]在寄主椰子上分离到的狗尾草平脐蠕孢、时涛等[30]在木薯上分离到的狗尾草平脐蠕孢生物学特性存在一定的差异,环境适应可能是导致该现象的主要原因。海南文昌和云南景洪虽同属热带地区,但是两地直线距离1 000 km以上,且气候类型存在较大的差异(分别为热带季风岛屿型气候和热带湿润季风气候),在长期的环境适应过程中,两地的狗尾草平脐蠕孢菌株的生物学特性产生了差异;其次,寄主差异也是导致病原菌生物学特性不同的原因之一,分离自不同寄主(玉米Zea mays、燕麦Avena sativa、牛筋草Eleusine indica)的麦根腐平脐蠕孢的最适合生长温度、碳氮源利用情况等均存在一定的差异[31-33]。
狗尾草平脐蠕孢引起的橡胶叶斑病目前在田间为零星发生,为了避免该病害进一步发生流行,本文研究了病原菌的生物学特性,为预测病害的发生流行规律和病害防控技术的研究提供了依据。
参考文献
[1] 李一鲲. 世界主要天然橡胶生产国生产概况及发展趋势和认识[J]. 热带农业科技, 2003(S1): 37-45.
[2] 庞启洪. 橡胶树常见病虫害的防治[J]. 绿色科技, 2010(9): 79-81.
[3] 郑服丛. 我国橡胶植保科技的现状与展望[J]. 中国热带农业, 2011(4): 37-40.
[4] 白蕤, 李宁, 刘少军, 等. 气候变化背景下橡胶树白根病在全球的适生区预测[J]. 植物保护, 2021, 47(4): 66-72.
[5] CAI Zhiying, LIU Yixian, SHI Yuping, et al. Alternaria yunnanensis sp. nov., a new Alternaria species causing foliage spot of rubber tree in China [J]. Mycobiology, 2019, 47(1): 66-75.
[6] 蔡志英, 施玉萍, 刘一贤, 等. 橡胶树毛色二孢叶斑病的病原菌[J]. 云南农业大学学报(自然科学), 2018, 33(2): 224-232.
[7] LIU Yixian, SHI Yuping, CAI Zhiying. et al. A first report of rubber tree leaf spot caused by Exserohilum rostratum in China [J]. Plant Disease, 2016, 100(10): 2167.
[8] 李博勋, 刘先宝, 时涛, 等. 国内新发危险性橡胶树拟盘多毛孢叶斑病鉴定及其病原学研究[J]. 热带作物学报, 2020, 41(8): 1616-1624.
[9] 蔡志英, 李国华. 橡胶树常见病害诊断及其防治[M]. 北京:中国农业科学技术出版社, 2017: 43-45.
[10]张天宇. 中国真菌志: 第30卷 蠕形分生孢子真菌[M]. 北京: 科学出版社, 2010: 77-79.
[11]WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]∥PCR protocols: A guide to methods and applications. New York: Academic Press, 1990: 315-322.
[12]TEMPLETON M D, RIKKERINK E A, SOLON S L, et al. Cloning and molecular characterization of the glyceraldehyde-3-phosphate dehydrogenase encoding gene and cDNA from the plant pathogenic fungus Glomerella cingulata [J]. Gene, 1992, 122(1): 225-230.
[13]方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 152-153.
[14]SCHOCH C L, CIUFO S, DOMRACHEV M, et al. NCBI Taxonomy: a comprehensive update on curation, resources and tools [J/OL]. Database (Oxford), 2020: baaa062. DOI: 10.1093/database/baaa062.
[15]秦健, 黄如葵, 黄熊娟, 等. 苦瓜双色平脐蠕孢叶斑病病原菌的生物学特性及其抑菌药剂筛选[J]. 热带作物学报, 2020, 41(12): 2507-2512.
[16]杨成德, 陈秀蓉, 薛莉, 等. 牧草根际狗牙根平脐蠕孢菌的研究[J]. 草业学报, 2008(3): 86-92.
[17]陈灿钿, 麦章龙, 游春平, 等. 青苹果竹芋平脐蠕孢叶斑病病原菌的鉴定[J]. 植物病理学报, 2021, 51(5):817-821.
[18]NIU X Q, YU F Y, ZHU H, et al. First report of leaf spot disease in coconut seedling caused by Bipolaris setariae in China [J]. Plant Disease, 2014, 98(12): 1742.
[19]MANAMGODA D S, CAI Lei, MCKENZIE E H C, et al. A phylogenetic and taxonomic re-evaluation of the Bipolaris-Cochliobolus-Curvularia complex [J]. Fungal Diversity, 2012, 56(1): 131-144.
[20]赵杏利, 邓晖, 牛永春.一种狗尾草病原真菌的鉴定及菌株致病性研究[J]. 菌物学报, 2010, 29(2): 172-177.
[21]SHI T, LI C P, LI J F, et al. First report of leaf spot caused by Bipolaris setariae on cassava in China [J]. Plant Disease, 2010, 94(7): 919.
[22]牛晓庆, 余凤玉, 朱辉, 等. 椰子平脐蠕孢叶斑病病原鉴定及生物学特性测定[J]. 热带作物学报, 2015, 36(3): 581-586.
[23]XIAO S Q, ZHANG D, ZHAO J M, et al. First report of leaf spot of maize (Zea mays) caused by Bipolaris setariae in China [J]. Plant Disease, 2020, 104(2): 582.
[24]RAMESH G V, PALANNA K B, VINAYKUMAR H D, et al. Occurrence and characterization of Bipolaris setariae associated with leaf blight of browntop millet (Brachiaria ramosa) in India [J]. Journal of Phytopathology, 2021, 169(10): 613-622.
[25]RAMESH G V, PAlANNA K B, PRAVEEN B, et al. First confirmed report of leaf blight on browntop millet caused by Bipolaris setariae in Southern Peninsular India [J]. Plant Disease, 2021, 105(5): 1561.
[26]CUI Wenli, BIAN Jinyue, LI Dewei, et al. First report of leaf blight on Chinese fir (Cunninghamia lanceolata) caused by Bipolaris setariae in China [J]. Plant Disease, 2020, 104(9): 2523.
[27]谢淑娜. 利用多基因聚合分析进行平脐蠕孢属及其近似属的分子系统学研究[D].郑州: 河南农业大学, 2012.
[28]LIANG Xiaoyu, PENG Yun, LIU Yanchao, et al. First report of Bipolaris bicolor causing a leaf spot disease on rubber tree [J]. Journal of Phytopathology, 2019, 167: 553-567.
[29]戴利铭, 熊延林, 李发昌, 等. 10种杀菌剂对橡胶树嘴突凸脐蠕孢菌的室内毒力测定[J]. 热带农业科技, 2020, 43(3): 13-15.
[30]时涛, 李超萍, 蔡吉苗, 等. 木薯新叶斑病病原鉴定及其生物学特性[J]. 热带作物学报, 2010, 31(3): 457-463.
[31]杨叶, 王兰英, 胡美姣. 牛筋草离孺孢生物學特性及代谢产物活性测定[J]. 微生物学通报, 2009, 36(5): 666-671.
[32]何苏琴, 荆卓琼, 丁文娇, 等. 西藏秋播燕麦苗期褐斑病病原鉴定及生物学特性研究[J]. 草原与草坪, 2011, 31(5): 30-33.
[33]郭宁, 胡清玉, 刘粤阳, 等. 玉米叶斑病菌麦根腐平脐蠕孢的生物学特性及其对杀菌剂的敏感性[J]. 华北农学报, 2019, 34(S1): 289-295.
(责任编辑:田 喆)

