Fusarium graminearum sensu stricto和F.asiaticum在玉米秸秆和水稻秸秆上子囊壳形成的比较
茹艳艳 谢淑娜 刘佳中 李保叶 孙静 郝俊杰


摘要 為探究麦田前茬作物玉米秸秆和水稻秸秆上中国小麦赤霉病菌的两个优势种Fusarium graminearum sensu stricto (F.graminearum)和F.asiaticum子囊壳形成和发育成熟过程的差异,分别选择3株F.graminearum菌株(SE81,3-ADON型;LcA-2,15-ADON型;HX5-1,NIV型)和2株F.asiaticum菌株(M4A,3-ADON型;M31-2,NIV型),用其孢子悬浮液接种玉米秸秆和水稻秸秆,放置于花泥和地表两种环境条件下,比较接种不同菌株秸秆上子囊壳的形成和发育成熟情况及5个菌株对‘郑麦366(高感小麦赤霉病品种)的致病力。结果表明:花泥环境下产生子囊壳的速度要快于地表,以玉米秸秆为载体子囊壳产生速度比水稻秸秆快且多数密度大,3个F.graminearum菌株(SE81、LcA-2和HX5-1)在同种秸秆相同环境下比2个F.asiaticum菌株(M4A和M31-2)产生子囊壳的速度快且子囊壳密度大。5个菌株在不同环境的不同秸秆上产生的子囊壳的成熟度均无规律,接种‘郑麦366后其病情指数间有极显著差异(P<0.01),在花泥和地表的玉米秸秆和水稻秸秆上3次调查的子囊壳密度与‘郑麦366的病情指数呈显著正相关,不同环境条件下的子囊壳产生速度(AUPGC)与‘郑麦366的病情指数呈极显著正相关。本研究将为阐明F.graminearum和F.asiaticum在中国小麦赤霉病上表现区域性地理分布的原因提供参考依据。
关键词 Fusarium graminearum sensu stricto; F.asiaticum; 玉米秸秆; 水稻秸秆; 子囊壳
中图分类号: S 435.121.4
文献标识码: A
DOI: 10.16688/j.zwbh.2021718
Abstract The objective of this study is to explore the difference in the development and maturity of perithecia produced by Fusarium graminearum sensu stricto (F.graminearum) and F.asiaticum on maize and rice stalks in winter wheat fields. Five strains were selected, i.e., SE81 (F.graminearum, 3-ADON), LcA-2 (F.graminearum, 15-ADON), HX5-1 (F.graminearum, NIV), M4A (F.asiaticum, 3-ADON) and M31-2 (F.asiaticum, NIV). Maize and rice stalks were inoculated with the spore suspensions of the five strains. The development and maturity of perithecia produced on maize and rice stalks were compared under two environment conditions (on flower mud surface and soil surface). The pathogenicity of the five strains on ‘Zhengmai366 (highly susceptible to wheat head blight) was compared. The results showed that the expansion rate of perithecia produced on flower mud surface was greater than that on soil surface, and the expansion rate and density of perithecia on maize stalks inoculated with the same strain under the same environment was mostly greater than that on rice stalks. The expansion rate and the number of perithecia per square centimeter on the same kind of stalks inoculated with F.graminearum strains (SE81, LcA-2 and HX5-1) were higher than with F.asiaticum strains (M4A and M31-2) under the same environment. The maturity of the perithecia of the five strains was irregular, and there was a significant difference in the disease index among the five strains inoculated to ‘Zhengmai366 (P<0.01), and the number of perithecia per square centimeter of the five strains on flower mud surface and soil surface in three surveys was positively correlated with the disease index of ‘Zhengmai366, and the expansion rate of perithecia was significantly positively correlated with the disease index of ‘Zhengmai366. These results provide a reference for elucidating the reasons for the regional geographical distribution of F.graminearum and F.asiaticum causing wheat head blight in China.
Key words Fusarium graminearum sensu stricto; F.asiaticum; maize stalk; rice stalk; perithecium
禾谷镰孢复合种Fusarium graminearum species complex (FGSC)是农业生产中常见的病原真菌,能引起多种作物根腐病、茎腐病和穗腐病,不仅影响作物产量,而且可产生多种真菌毒素,严重威胁食品安全和人畜健康[1]。目前,已经明确FGSC包含至少16个系统发育种[2-5],其中禾谷镰孢F.graminearum sensu stricto (F.graminearum)和亚洲镰孢F.asiaticum在我国呈现区域性的分布特征,西南和长江流域以F.asiaticum为主;长江流域和淮河流域的多数省份F.graminearum和F.asiaticum共存,但从南到北表现由F.asiaticum到F.graminearum的渐变;东北和黄淮海地区以F.graminearum为主,整体上F.graminearum和F.asiaticum分别是我国北方和南方小麦赤霉病的优势种[6-9]。
FGSC产生的单端孢霉烯族毒素可分为A型和B型,其中B型有3-ADON、15-ADON和NIV 3种菌株特异化学型[10-11],而产A型毒素NX-2的F.graminearum菌株目前只在北美被报道[12-14]。我国,F.graminearum主要产15-ADON型毒素,F.asiaticum主要产3-ADON或NIV型毒素[8-9]。
FGSC在作物秸秆残体上越冬可产生两种类型孢子:一种是无性的分生孢子,借助雨水飞溅传播,侵染小麦叶片并可扩展到穗,扩散距离有限;另一种是有性的子囊孢子,在温暖潮湿的天气条件下,从发育成熟的子囊壳中迸发喷射到空气中,借助气流、雨水进行较远距离的扩散传播[15-16]。多项研究表明,小麦扬花期前后冠层内多数是FGSC的子囊孢子,在侵染小麦穗后可产生分生孢子进行二次侵染,因此,秸秆残体上子囊壳释放的子囊孢子是小麦赤霉病的主要初侵染源[17-21]。温度和湿度是影响子囊壳数量的两个重要环境因子[21],调查麦田秸秆残体上的子囊壳数量可作为预测预报小麦赤霉病的重要指标[22]。
与欧美一年一熟的种植制度不同,一年两熟的黄淮海小麦-玉米轮作和长江流域小麦-水稻轮作是中国特色的耕作制度。F.graminearum和F.asiaticum在中国呈现区域性地理分布受到气温、耕作制度等的影响[23-25],在麦田前茬作物玉米秸秆和水稻秸秆上F.graminearum和F.asiaticum子囊壳的形成和发育成熟情况是否有差异,是否会影响到F.graminearum和F.asiaticum在中国的地理分布目前还不明确。本研究选择不同毒素型F.graminearum和F.asiaticum菌株,比较在不同环境条件下其在玉米秸秆和水稻秸秆上子囊壳形成和发育成熟的差异,以期阐明F.graminearum和F.asiaticum在中国小麦赤霉病上表现区域性地理分布的原因,并为相关病害的发生、预测预报和防控提供借鉴。
1 材料与方法
1.1 材料
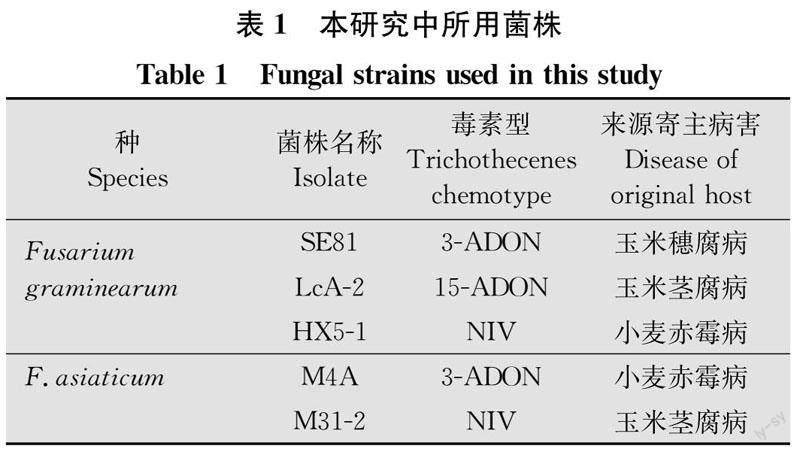
供试菌株:基于种和毒素型,从本实验室保存的FGSC菌源库中,选择F.graminearum不同毒素型菌株3株:SE81(3-ADON型,Fg-3A)、LcA-2(15-ADON型,Fg-15A)和HX5-1(NIV型,Fg-NIV),选择F.asiaticum不同毒素型菌株2株:M4A(3-ADON型,Fa-3A)和M31-2(NIV型,Fa-NIV),共5株不同基因型FGSC菌株(表1)。
1.2 方法
1.2.1 秸秆的接种
本试验用5个菌株的孢子悬浮液分别接种玉米和水稻秸秆并置于不同环境(花泥和地表)来比较F.graminearum和F.asiaticum子囊壳形成和发育成熟度的差异。
各菌株在PDA上,26℃黑暗培養3~5 d,打取直径2 mm的菌丝块,接种于5%绿豆汤培养基,26℃、180 r/min振荡培养3~5 d,用4层纱布过滤菌丝,将孢子悬浮液浓度调为104~105个/mL,备用。
河南省现代农业研究开发基地(即河南省农业科学院原阳基地)试验田的玉米(‘郑单958)和水稻(‘黄金晴)收获后,挑选大小一致的玉米茎秆(直径约为1.4 cm)和水稻茎秆(直径约为0.5 cm),截成15 cm长的小段,在蒸馏水中浸泡12 h后,捞出沥水,121℃、20 min灭菌两次后备用。在超净台中,将灭菌的玉米秸秆和水稻秸秆分别放在各菌株的孢子悬浮液中浸泡2 min,捞出后放入灭菌的托盘内(规格60 cm×40 cm×4.8 cm),用4层无菌纱布覆盖,26℃培养7 d(图1a),直到菌丝几乎布满秸秆备用(图1b),以收集的上季感茎腐病的玉米秸秆、健康株的玉米秸秆和水稻秸秆为对照。
1.2.2 田间放置
在河南省新乡市平原示范区河南省现代农业研究开发基地(35°0′N,113°42′E),选择正常管理的小麦田,于2016年2月19日将接种后长满菌丝的玉米秸秆和水稻秸秆及对照放置麦田垄间。设置两种不同的环境,一是将秸秆平置于花泥表面(花泥放在有水的塑料盒子里吸水保湿,塑料盒规格30 cm×20 cm×10 cm,花泥规格20 cm×10 cm×8 cm)(图1c),盒子内水面和花泥上表面基本持平,并定期续水,模拟100%的相对湿度环境,然后将盒子置于麦田垄间地表(图1d~f);二是在自然环境下,将秸秆直接平置于麦田垄间地表(图1e~g)。为避免田间灌溉等农事操作干扰秸秆的放置,均用铁丝(直径0.6 mm,长度30 cm左右)将秸秆轻微固定。
在花泥和地表两种环境下放置的秸秆均按照随机区组设计,3次重复,每小区放置玉米秸秆10根,水稻秸秆20根。同一区组置于同一麦垄,区组间相隔5 m左右,区组内不同小区间相隔0.5~1 m。
1.2.3 子囊壳密度及成熟度的调查
3月底,调查发现部分秸秆上开始形成极少量子囊壳(图2a),于4月7日、4月14日和4月28日分别调查秸秆上子囊壳的密度和成熟度。子囊壳密度调查方法为每个小区随机取5根玉米秸秆和水稻秸秆,首先肉眼估算每根秸秆上形成子囊壳面积占整个秸秆表面积(把整个秸秆看成圆柱体,此处的秸秆表面积特指为圆柱体的侧面积)的比例,然后用相机对秸秆上着生子囊壳有代表性的位置(能代表秸秆上子囊壳形成情况且可清楚计数子囊壳)进行拍照,并以记录本上的蓝线格作为标尺(0.7 cm×0.7 cm)(图2c~f),拍完照后将秸秆放回原位置。室内利用Image J软件计算子囊壳的密度[26]。
以种群增长曲线下面积(area under the population growth curve,AUPGC)来计算子囊壳产生速度[27],AUPGC=∑[(Xi+1+Xi)/2] (ti+1-ti),式中:Xi表示第i次调查时的秸秆上子囊壳形成的面积,ti表示第i次调查时的时间(以秸秆放置田间后天数表示)。秸秆上子囊壳形成面积=估算的秸秆上形成子囊壳面积占整个秸秆表面积的比例×秸秆实际表面积,秸秆实际表面积=π×秸秆直径×秸秆长度,玉米秸秆实际表面积=3.14×1.4×15=65.94 cm2,水稻秸秆实际表面积=3.14×0.5×15=23.55 cm2。
子囊壳成熟度的调查分级参照Dufault等的方法[28],每次调查子囊壳面积结束后,随机选取5根秸秆并挑取20个子囊壳,室内制片压碎镜检,确定子囊壳的成熟度级别。子囊壳成熟指数的计算方法参照小麦赤霉病测报技术规范(GB/T 15796-2011)[29],子囊壳成熟指数=∑(各级子囊壳成熟数×各级代表值)/(调查总子囊壳数×最高级代表值)×100。
1.2.4 供试菌株的致病力测定
选择高感赤霉病的小麦品种‘郑麦366,在小麦扬花期采用喷雾法接种小麦赤霉病菌。用小喷壶(规格50 mL)将30 mL浓度为1×104个/mL的孢子悬浮液喷洒在30穗小麦穗上,无菌水作为对照,3次重复。所有接种的小麦穗套袋保湿48 h,21 d后调查记录每穗的病级,病级标准参照《小麦抗病虫性评价技术规范 第4部分:小麦抗赤霉病评价技术规范》(NY/T1443.4—2007)[30]中土表接种法的严重度分级:0级,无发病小穗;1级,零星小穗发病,发病小穗占总小穗数的25.0%以下;2级,发病小穗占总小穗数的25.0%~50.0%;3级,发病小穗占总小穗数的50.1%~75.0%;4级,发病小穗占总小穗数的75.0%以上。病情指数=∑(各级病穗数×病级数值)/(调查总穗数×4)×100。
1.3 数据分析
数据采用SAS 9.4统计分析软件(SAS Institute,Cary,NC)进行方差分析,采用LSD法(least significant differences)进行多重比较(α=0.05)。
2 结果与分析
2.1 子囊壳形成
秸秆在田间放置40 d左右(3月底),花泥表面的玉米秸秆上出现极少量子囊壳(图2a),而地表的秸秆没有发现子囊壳(图2b);50 d左右,在地表秸秆发现有零星子囊壳形成,最初只出现在秸秆、地表及秸秆与空气交界位置。4月7日第1次调查,发现花泥表面的玉米秸秆和水稻秸秆上均已形成较多的子囊壳,而地表存放的玉米秸秆和水稻秸秆上仅分布有少量子囊壳。4月14日第2次调查,发现花泥表面的秸秆上子囊壳的面积占比明显增加,但地表两种秸秆上子囊壳的面积占比变化不大。4月28日第3次调查,发现在花泥和地表两种环境下秸秆上均形成大量子囊壳(图2c~f)。阳性对照玉米茎腐病秸秆表面也形成较多的子囊壳,而阴性对照灭菌的玉米秸秆和水稻秸秆没有子囊壳产生。
对花泥和地表存放的秸秆上形成的子囊壳AUPGC进行方差分析,结果表明不同环境下不同秸秆上不同菌株产生子囊壳的速度均有显著差异(P<0.05)(表2)。相同环境下接种同一菌株时,花泥表面和地表放置的玉米秸秆上产生的子囊壳AUPGC分别是水稻秸秆的3.04~6.25倍和3.55~5.90倍;對同种菌株,放在花泥表面的玉米秸秆和水稻秸秆上产生的子囊壳AUPGC分别是地表环境的1.73~4.75倍和2.17~6.34倍。以上结果表明花泥环境下子囊壳产生速度大于地表,以玉米秸秆为载体的子囊壳的产生速度要大于水稻秸秆,说明湿度对子囊壳的产生具有重要的影响。在花泥和地表,3个F.graminearum菌株(SE81、LcA-2、HX5-1)接种同种秸秆形成子囊壳的AUPGC大于2个F.asiaticum菌株(M4A、M31-2)。
2.2 子囊壳密度
由于前2次调查时地表秸秆上只产生零星子囊壳,只在第3次调查时对其拍照及进行子囊壳密度的统计。对于花泥表面放置的秸秆,完成了3次拍照及子囊壳密度的统计。
对花泥和地表不同秸秆上形成的子囊壳密度进行方差分析,结果表明不同环境下不同秸秆上不同菌株产生的子囊壳密度均有显著差异(P<0.05)(表3)。3次统计数据显示,F.asiaticum菌株中,M31-2接种秸秆产生的子囊壳密度最小,并且与M4A间差异不显著。F.graminearum菌株中,放置在花泥表面的水稻秸秆上,3个菌株间子囊壳密度差异不显著;玉米秸秆,在4月7日时3个菌株差异不显著,4月14日时SE81和HX5-1产生的子囊壳密度差异不显著,但显著多于LcA-2;地表秸秆上,SE81产生的子囊壳密度最大(玉米秸秆和水稻秸秆上分别为336.6个/cm2和143.2个/cm2),且显著大于LcA-2(玉米秸秆和水稻秸秆上分别为155.5个/cm2和65.4个/cm2)和HX5-1(玉米秸秆和水稻秸秆上分别为159.8个/cm2和70.9个/cm2)。以上结果表明,在相同环境条件下同一菌株接种玉米秸秆产生的子囊壳密度多数大于水稻秸秆,3个F.graminearum菌株(SE81、LcA-2、HX5-1)接种同种秸秆产生子囊壳的密度明显大于2个F.asiaticum菌株(M4A、M31-2)。
对同一菌株,F.asiaticum菌株中,M31-2接种同种秸秆产生的子囊壳密度由大到小依次为4月28日花泥>4月28日地表>4月14日花泥>4月7日花泥;M4A接种玉米秸秆时其在4月7日花泥中产生的子囊壳密度最大,且与4月28日花泥和地表环境下的子囊壳密度均无显著差异;接种水稻秸秆时其在4月28日花泥中產生的子囊壳密度最大,且与其他时间测得的该菌株在两种环境下的子囊壳密度无显著差异。F.graminearum菌株(SE81、LcA-2、HX5-1)接种同种秸秆产生的子囊壳密度由大到小依次为4月28日地表>4月28日花泥>4月14日花泥>4月7日花泥,同一日期调查的子囊壳密度为玉米秸秆>水稻秸秆。结果表明,所有菌株接种玉米秸秆在4月28日地表环境产生子囊壳较多。
2.3 子囊壳的成熟度
在合适的温度(5~30℃)、相对湿度(75.5%~100%)条件下,菌株在秸秆上不断形成子囊壳,在相对湿度大于85%的条件下,秸秆上产生的子囊壳不断成熟释放子囊孢子,同时秸秆上又有新的子囊壳不断形成。对3次调查的秸秆上子囊壳成熟度进行方差分析,结果表明,除了4月28日地表水稻秸秆上不同菌株产生子囊壳的成熟度差异不显著以外(P>0.05),其他同一菌株在不同环境不同秸秆上或不同菌株在同种秸秆上产生子囊壳的成熟度均有显著差异(P<0.05)(表4)。
菌株M31-2接种秸秆产生的子囊壳最少,4月7日、14日子囊壳成熟指数为0,4月28日花泥和地表的玉米秸秆上子囊壳成熟指数分别为72.8、68.6;水稻秸秆上子囊壳成熟指数分别为71.3、96.8,除地表的水稻秸秆外,其余均显著小于同种环境条件下接种同种秸秆的其他菌株;其他4个菌株接种的玉米秸秆在花泥和地表及水稻秸秆在花泥条件下,3次调查的子囊壳成熟指数间多数差异不显著,为65.4~100;4月7日、14日地表水稻秸秆上只有菌株SE81产生零星子囊壳,成熟指数分别为24.6和48.3,其他菌株接种处理的子囊壳成熟指数均为0。以上结果表明,在花泥和地表,5个菌株接种玉米秸秆和水稻秸秆产生子囊壳的成熟度没有规律,秸秆载体对F.graminearum和F.asiaticum产生子囊壳的成熟度没有影响。
2.4 子囊壳密度及产生速度和菌株致病力的相关分析
5个菌株接种高感小麦赤霉病的品种‘郑麦366后其病情指数间有极显著差异(P<0.01)(表5)。其中菌株HX5-1所致病情指数最高(97.3),菌株M31-2所致病情指数最低(75.1),菌株SE81、LcA-2和M4A所致病情指数间差异不显著。
将不同环境条件下5个菌株在玉米秸秆和水稻秸秆上的子囊壳密度及产生速度(AUPGC)和接种‘郑麦366后的病情指数进行相关性分析表明:4月7日花泥玉米秸秆、4月28日地表玉米秸秆及4月28日花泥和地表水稻秸秆上的子囊壳密度与接种‘郑麦366的病情指数呈显著正相关,相关系数分别为0.531、0.581、0.595和0.524(P<0.05);4月14日、28日花泥玉米秸秆和4月7日、14日花泥水稻秸秆上的子囊壳密度与接种‘郑麦366的病情指数呈极显著正相关,相关系数分别为0.662、0.670、0.723和0.663(P<0.01)。
不同环境条件下的子囊壳产生速度(AUPGC)与接种‘郑麦366的病情指数呈极显著正相关,相关系数分别为0.845、0.753、0.796和0.740(P<0.01)。
(表6)。以上结果表明,F.graminearum和F.asiaticum菌株在秸秆上的子囊壳密度及产生速度(AUPGC)与其在感病品种上的致病力呈显著正相关。
3 结论与讨论
禾谷镰孢复合种(FGSC)中的F.graminearum和F.asiaticum分别是中国北方和南方小麦赤霉病菌的优势种,其中F.graminearum主要产15-ADON型毒素,F.asiaticum主要产3-ADON或NIV型毒素[8-9]。
由于FGSC菌株个体间表型差异较大,本研究选择的5株菌株不能完全代表种及毒素化学型,但本研究发现F.graminearum和F.asiaticum菌株在玉米和水稻秸秆上的子囊壳密度及产生速度与其在感病品种上的致病力呈显著正相关,为后续研究中菌株选择提供了参考依据。
本研究中,相同环境下3个F.graminearum菌株(SE81、LcA-2和HX5-1)在同种秸秆上产生子囊壳的速度比2个F.asiaticum菌株(M4A和M31-2)快且密度大,这与菌株本身的产子囊壳能力有关,还受到环境的影响。低温条件(年平均温度为15℃或更低)有利于F.graminearum菌株的生存,温暖气候(年平均温度高于15℃)对F.asiaticum菌株的生存更有利[6],而2016年2月下旬至4月底,试验地平均温度只有12.7℃,可能更有利于F.graminearum菌株在秸秆上产生子囊壳。
子囊壳形成的适宜温度为5~30℃(最适温度为21.7℃),适宜相对湿度为75.5%~100%,而子囊壳成熟则需要在20~25℃(最适温度为21.1℃)、85%~100%的相对湿度条件下发育14 d,温度过高或过低则无法发育成熟[21]。本研究选择了花泥(在盒子里定期续水保湿,模拟100%的相对湿度环境)和地表(自然环境,湿度主要依靠田间灌溉和降雨)两种环境条件。2月下旬至4月底,试验地白天温度为5~24℃,虽然晚上温度稍低(-3~14℃),但已满足秸秆上子囊壳形成和发育成熟所需的温度条件。菌株先在花泥玉米秸秆上形成少量子囊壳,随后(4月7日、14日)在花泥玉米秸秆和水稻秸秆上均形成较多子囊壳;地表秸秆上一直到4月28日才形成了较多的子囊壳,这是由于2月下旬至4月14日,试验地田间降水量不超过20 mm,4月17日试验地麦田人工浇水(大水漫灌1 h),4月25、26日小雨,27日中雨,连续阴雨天气使试验地田间降水量超过35 mm,达到了90%以上的相对湿度,满足了子囊壳形成和发育成熟所需的条件,表明湿度在子囊壳的形成和发育成熟过程中起着至关重要的作用,与Manstretta等[21]的研究结果一致。另外,子囊壳最初产生的位置是在秸秆、地表或者花泥与空气的交界位置[31],而秸秆覆盖在地表或者花泥表面的那部分并不能形成子囊壳,这是由于子囊壳的形成除了需要适宜的温度和湿度,还需要光照[32-33]。
本研究发现,同一菌株接种的秸秆放在花泥表面比地表子囊壳产生速度快,可能是由于花泥环境提供了秸秆上子囊壳形成所需的湿度,而前期麦田地表湿度非常小,因此地表秸秆上的子囊壳产生速度较慢。4月28日,菌株M31-2接种的玉米秸秆放在两种环境条件下子囊壳密度几乎一样(花泥:2.0个/cm2;地表:1.9個/cm2),其他处理中地表玉米秸秆上子囊壳密度是花泥的1.2~3.5倍(地表∶花泥=1.22~3.33∶1),这可能是花泥环境下,玉米秸秆上的子囊壳发育成熟后不断释放子囊孢子,造成花泥玉米秸秆上的子囊壳密度并不大;地表条件下,前期降水量少,4月27日中雨,28日调查时所有地表秸秆上刚开始形成子囊壳,同时发育成熟释放子囊孢子的子囊壳较少,因此多数地表玉米秸秆的子囊壳密度较花泥大。而M31-2接种的水稻秸秆放在花泥表面时子囊壳密度(3.6个/cm2)显著大于放在地表(1.0个/cm2),其他处理中水稻秸秆在花泥和地表间的子囊壳密度差异不显著,这可能是由于菌株M31-2在水稻秸秆上产子囊壳需要更大的湿度。
黄淮麦区的小麦-玉米轮作和长江中下游麦区的小麦-水稻轮作是中国特色的耕作制度,子囊壳的形成过程也受到秸秆载体的影响[21],因此本研究选择麦田前茬作物玉米秸秆和水稻秸秆作为产子囊壳的载体。研究发现,放置环境相同时,同一菌株在玉米秸秆上子囊壳产生速度比水稻秸秆上快且多数密度大,这与玉米秸秆和水稻秸秆的C/N比不同有关,C/N比高的作物残茬,更有利于子囊壳的形成,玉米秸秆的平均C/N比为60∶1[20, 34],而水稻秸秆的C/N比为43∶1[35],这与Khonga等[36]发现的在C/N比高的作物残茬上更易迅速形成子囊壳的结果一致。
在农业生产中,连续多年的秸秆还田、简耕免耕、跨区机收等耕作方式造成了田间秸秆残茬上病原菌的不断积累。小麦赤霉病是我国黄淮区域和长江流域冬麦区常发、易发的气候性病害,越冬秸秆残茬上的子囊壳在适宜的温度和湿度条件下释放出成熟的子囊孢子,成为小麦赤霉病的主要初始侵染源。2016年试验地小麦田,4月20日开始扬花,24日扬花50%,28日扬花达到95%,扬花期(4月24日-28日),期间未出现极端低温天气(4月16日、17日低温为8℃和9℃,其他日期低温均高于10℃),但前期田间降水量不足,秸秆残茬上形成的子囊壳密度较小;25日-27日试验地连阴雨天气,秸秆残茬上形成较多子囊壳且部分发育成熟并释放子囊孢子,但此后一周田间未有降雨,气候条件不利于子囊孢子在小麦穗上的萌发及侵染扩展,根据试验地麦田秸秆残茬上子囊壳的形成情况,结合小麦扬花期前后的天气,预测当年试验地麦田小麦赤霉病发生较轻,与实际发病情况基本一致。
本研究只选择了豫北(河南省新乡市)一个地点,后续研究气温对F.graminearum和F.asiaticum子囊壳形成的影响时,应选择优势种群(15-ADON型F.graminearum菌株和3-ADON型F.asiaticum菌株)中对感赤霉病的小麦品种致病力没有显著差异的菌株,在不同纬度条件下或者南北不同地区进行。
参考文献
[1] MILLER J D,GREENALGH R,WANG Yuzhong,et al. Trichothecene chemotype of three Fusarium species [J]. Mycologia,1991,83(2):121-130.
[2] ODONNELL K,WARD T J,GEISER D M,et al. Genealogical concordance between the mating type locus and seven other nuclear genes supports formal recognition of nine phylogenetically distinct species within the Fusarium graminearum clade [J]. Fungal Genetics and Biology,2004,41(6):600-623.
[3] ODONNELL K,WARD T J,ABERRA D,et al. Multilocus genotyping and molecular phylogenetics resolve a novel head blight pathogen within the Fusarium graminearum species complex from Ethiopia [J]. Fungal Genetics and Biology,2008,45(11):1514-1522.
[4] STARKEY D E,WARD T J,AOKI T,et al. Global molecular surveillance reveals novel Fusarium head blight species and trichothecene toxin diversity [J]. Fungal Genetics and Biology,2007,44(11):1191-1204.
[5] SARVER B A J,WARD T J,GALE L R,et al. Novel Fusarium head blight pathogens from Nepal and Louisiana revealed by multilocus genealogical concordance [J]. Fungal Genetics and Biology,2011,48(12):1096-1107.
[6] QU Bo,LI Heping,ZHANG Jingbo,et al. Geographic distribution, and genetic diversity of Fusarium graminearum and F.asiaticum on wheat spikes throughout China [J]. Plant Pathology,2008,57(1):15-24.
[7] ZHANG Jingbo,LI Heping,DANG Fujun,et al. Determination of the trichothecene mycotoxin chemotypes and associated geographical distribution and phylogenetic species of the Fusarium graminearum clade from China [J]. Mycological Research,2007,111(8):967-975.
[8] ZHANG Hao,VAN DER LEE T,WAALWIJK C,et al. Population analysis of the Fusarium graminearum species complex from wheat in China show a shift to more aggressive isolates [J/OL]. PLoS ONE,2012,7(2):e31722. DOI:10.1371/journal.pone.0031722.
[9] HAO Junjie,XIE Shuna,SUN Jing,et al. Analysis of Fusarium graminearum species complex from wheat-maize rotation regions in Henan (China) [J]. Plant Disease,2017,101(5):720-725.
[10]GOSWAMI R S,KISTLER H C. Pathogenicity and in planta mycotoxin accumulation among members of the Fusarium graminearum species complex on wheat and rice [J]. Phytopathology,2005,95(12):1397-1404.
[11]WARD T J,BIELAWSKI J P,KISTLER H C,et al. Ancestral polymorphism and adaptive evolution in the trichothecene mycotoxin gene cluster of phytopathogenic Fusarium [J]. Proceedings of the National Academy of Sciences,2002,99(14):9278-9283.
[12]LIANG J M,XAYAMONGKHON H,BROZ K,et al. Temporal dynamics and population genetic structure of Fusarium graminearum in the upper midwestern United States [J]. Fungal Genetics and Biology,2014,73:83-92.
[13]VARGA E,WIESENBERGER G,HAMETNER C,et al. New tricks of an old enemy: isolates of Fusarium graminearum produce a type A trichothecene mycotoxin [J]. Environmental Microbiology,2015,17(8):2588-2600.
[14]KELLY A C,CLEAR R M,ODONNELL K,et al. Diversity of Fusarium head blight populations and trichothecene toxin types reveals regional differences in pathogen composition and temporal dynamics [J]. Fungal Genetics and Biology,2015,82:22-31.
[15]ROSSI V,LANGUASCO L,PATTORI E,et al. Dynamics of airborne Fusarium macroconidia in wheat fields naturally affected by head blight [J]. Journal of Plant Pathology,2002,84(1):53-64.
[16]TRAIL F. For blighted waves of grains: Fusarium graminearum in the postgenomics ear [J]. Plant Physiology,2009,149(1):103-110.
[17]SUTTON J C. Epidemiology of wheat head blight and maize ear rot caused by Fusarium graminearum [J]. Canadian Journal of Microbiology,1982,4:195-209.
[18]SCHMALE III D G,LESLIE J F,ZELLER K A,et al. Genetic structure of atmospheric populations of Gibberella zeae [J]. Phytopathology,2006,96(9):1021-1026.
[19]SCHMALE III D G,ROSS S D,FETTERS T T,et al. Isolates of Fusarium graminearum collected 40-320 meters above ground level cause Fusarium head blight in wheat and produce trichothecene mycotoxins [J]. Aerobiologia, 2012, 28:1-11.
[20]PRUSSIN A J,SZANYI N A,WELLING P I,et al. Estimating the production and release of ascospores from a field-scale source of Fusarium graminearum inoculum [J]. Plant Disease,2014,98(4):497-503.
[21]MANSTRETTA V,ROSSI V. Effects of temperature and moisture on development of Fusarium graminearum perithecia in maize stalk residues [J]. Applied and Environmental Microbiology,2016,82(1):184-191.
[22]張平平,宋金东,冯小军,等. 关中麦田产壳玉米秸秆密度与小麦赤霉病穗率的关系[J]. 麦类作物学报,2015,35(7):1022-1028.
[23]LEE J,CHANG I Y,KIM H,et al. Genetic diversity and fitness of Fusarium graminearum populations from rice in Korea [J]. Applied and Environmental Microbiology,2009,75:3289-3295.
[24]LEE J,KIM H,JEON J J,et al. Population structure and mycotoxin production by Fusarium graminearum from maize in South Korea [J]. Applied and Environmental Microbiology,2012,78:2161-2167.
[25]SUGA H,KARUGIA G W,WARD T,et al. Molecular characterization of the Fusarium graminearum species complex in Japan [J]. Phytopathology,2008,98:159-166.
[26]茹艳艳,郝俊杰,谢淑娜,等. 一种调查田间秸秆残茬上禾谷镰刀菌子囊壳数量的方法:202111120796.0[P]. 2021-12-14.
[27]袁军海,赵美琦,姚裕琪,等. 马铃薯晚疫病菌寄生适合度测定方法的研究[J]. 中国马铃薯,2001,15(1):9-13.
[28]DUFAULT N S,DE WOLF E D,LIPPS P E,et al. Role of temperature and moisture in the production and maturation of Gibberella zeae perithecia [J]. Plant Disease,2006,90(5):637-644.
[29]姜玉英,曾娟,张芳,等. 小麦赤霉病测报技术规范:GB/T 15796-2011 [S]. 北京: 中国标准出版社, 2011.
[30]中华人民共和国农业部. 小麦抗病虫性评价技术规范—第4部分:小麦抗赤霉病评价技术规范: NY/T 1443.4-2007 [S]. 北京:中国标准出版社,2007: 1-6.
[31]郝俊杰, 谢淑娜, 茹艳艳, 等. 一种预测小麦赤霉病初始侵染源丰富度的方法: CN2019/1192831.2 [P]. 2020-02-04.
[32]TSCHANZ A T,HORST R K,NELSON P E. The effect of environment on sexual reproduction of Gibberella zeae [J]. Mycologia,1976,68:327-340.
[33]吴基日,刘宪虎,许明子,等. 麦类赤霉病菌子囊壳形成所需环境条件的研究[J]. 延边大学农学学报,1997,19(2):69-73.
[34]孙守如,杨秋生,董晓宇,等. 玉米秸有机栽培基质矿质营养及理化性质分析[J]. 农业工程学报,2008,24(6):41-44.
[35]单玉华, 蔡祖聪, 韩勇, 等. 淹水土壤有机酸积累与秸秆碳氮比及氮供应的关系[J]. 土壤学报, 2006, 43(6): 941-947.
[36]KHONGA E B,SUTTON J C. Inoculum production and survival of Gibberella zeae in maize and wheat residues [J]. Canadian Journal of Plant Pathology,1988,10:232-239.
(责任编辑:杨明丽)

