基于PPARγ信号通路探讨安脑平冲方极化M2型小胶质细胞减轻脑出血后神经炎症的作用机制
张瑛 高晓峰 郭纯 张宇星 周德生

〔摘要〕 目的 探討安脑平冲方极化M2型小胶质细胞减轻脑出血(intracerebral hemorrhage, ICH)后神经炎症的作用机制。方法 采用氯化血红素干预BV2细胞模拟体外ICH模型。第一部分实验分3组[对照组、模型组、安脑平冲方含药血清组(A-HYXQ组)],对照组为正常生长的BV2细胞,模型组及A-HYXQ组采用氯化血红素干预BV2细胞,24 h后模型组给予10%空白血清干预,A-HYXQ组给予10% A-HYXQ干预。采用免疫荧光和Western blot法检测Ym-1、白细胞介素-10(interleukin-10, IL-10)、诱导型一氧化氮合酶(iductible nitric oxide synthase, iNOS)、白细胞介素-6(interleukin- 6, IL-6)表达量。第二部分实验分为对照组、模型组、A-HYXQ组、A-HYXQ+GW9662组,对照组、模型组、A-HYXQ组处理同第一部分实验,A-HYXQ+GW9662组在给予10% A-HYXQ前1 h给予10 μmol/L的GW9662,采用免疫荧光、Western blot和qRT-PCR法检测过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors γ, PPARγ)、精氨酸酶-1(arginase-1, Arg-1)和白细胞介素-4(interleukin-4, IL-4)的表达量;采用Western blot、qRT-PCR和ELISA法检测白细胞介素-1β(interleukin-1β, IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)。结果 第一部分:与对照组比较,模型组Ym-1和IL-10平均荧光强度和蛋白表达量明显下降(P<0.05),而iNOS和IL-6平均荧光强度和蛋白表达量明显上升(P<0.05);与模型组相比,A-HYXQ组Ym-1和IL-10平均荧光强度和蛋白表达量明显上升(P<0.05),而iNOS和IL-6平均荧光强度和蛋白表达量明显下降(P<0.05)。第二部分:与对照组比较,模型组PPARγ、Arg-1和IL-4平均荧光强度、蛋白及mRNA表达量明显下降(P<0.05),而TNF-α和IL-1β蛋白和上清液表达量明显上升(P<0.05);与模型组相比,A-HYXQ组PPARγ、Arg-1和IL-4平均荧光强度、蛋白及mRNA表达量明显上升(P<0.05),而TNF-α和IL-1β蛋白和上清液表达量明显下降(P<0.05);与A-HYXQ组相比,A-HYXQ+GW9662组PPARγ、Arg-1和IL-4平均荧光强度、蛋白及mRNA表达量下降(P<0.05),而TNF-α、IL-1β蛋白和上清液表达量上升(P<0.05)。结论 安脑平冲方可能通过激活PPARγ信号通路极化M2型小胶质细胞,减轻氯化血红素干预BV2细胞的炎症反应。
〔关键词〕 脑出血;神经炎症;小胶质细胞;过氧化物酶体增殖物激活受体γ;安脑平冲方
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.007
Mechanism of Annao Pingchong Formula on polarization of M2 microglia in alleviating neuroinflammation after intracerebral hemorrhage based on PPARγ signaling pathway
ZHANG Ying1, GAO Xiaofeng2, GUO Chun3, ZHANG Yuxing1, ZHOU Desheng2*
1. Graduate School of Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Department of Encephalopath (I), The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 3. Center for Medical Innovation, The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To explore the mechanism of Annao Pingchong Formula on polarization of M2 microglia in alleviating neuroinflammation after intracerebral hemorrhage (ICH). Methods The ICH model in vitro was simulated by the intervention of hemin on BV2 cells. The first part of the experiment (Part Ⅰ) was divided into three groups: control group, model group, and serum containing Annao Pingchong Formula group (A-HYXQ group). The control group was made up of BV2 cells with normal growth. The model group and A-HYXQ group were treated with hemin. Then after 24 h, the model group was treated with 10% blank serum, while the A-HYXQ group was treated with 10% A-HYXQ. Immunofluorescence and Western blot were used to detect the expression of Ym-1, interleukin-10 (IL-10), inducible nitric oxide synthase (iNOS) and interleukin-6 (IL-6). The second part (Part Ⅱ) of the experiment was divided into control group, model group, A-HYXQ group and A-HYXQ+GW9662 group. The treatment of the control, model and A-HYXQ groups was the same as that of Part Ⅰ. The A-HYXQ+GW9662 group was given GW9662 (10 μmol/L) 1 h before administration of 10% A-HYXQ. The expression of peroxisome proliferator-activated receptor-γ (PPAR γ), arginase-1 (Arg-1) and interleukin-4 (IL-4) was detected by immunofluorescence, Western blot and qRT-PCR, while tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) were detected by Western blot, qRT-PCR and ELISA. Results Part Ⅰ: Compared with the control group, the average fluorescence intensity and protein expression of Ym-1 and IL-10 in the model group were reduced significantly (P<0.05), while those of iNOS and IL-6 were significantly higher (P<0.05); compared with the model group, the average fluorescence intensity and protein expression of Ym-1 and IL-10 in the A-HYXQ group were significantly higher (P<0.05), while those of iNOS and IL-6 were reduced significantly (P<0.05). Part Ⅱ: Compared with the control group, the average fluorescence intensity, protein and mRNA expression of PPARγ, Arg-1 and IL-4 in the model group were significantly lower (P<0.05), however, the protein expression of TNF-α and IL-1β and the supernatant expression were significantly higher (P<0.05); compared with the model group, the average fluorescence intensity, protein and mRNA expression of PPARγ, Arg-1 and IL-4 in the A-HYXQ group were significantly higher (P<0.05), while the protein expression of TNF-α and IL-1β and the supernatant expression were reduced significantly (P<0.05); compared with the A-HYXQ group, the average fluorescence intensity, protein and mRNA expression of PPARγ, Arg-1 and IL-4 in the A-HYXQ+GW9662 group were reduced significantly (P<0.05), while the protein expression of TNF-α, IL-1β and the supernatant expression were significantly higher (P<0.05). Conclusion Annao Pingchong Formula may activate PPARγ signaling pathway to polarize M2-microglia, thus reducing the inflammatory reaction of BV2 cells after hemin intervention.
〔Keywords〕 intracerebral hemorrhage; neuroinflammation; microglia; peroxisome proliferators-activated receptors-γ; Annao Pingchong Formula
脑出血(intracerebral hemorrhage, ICH)指非创伤性脑内血管破裂,导致血液在脑实质内聚集,具有高发病率、高死亡率、高致残率的特点,给社会和家庭造成沉重的负担[1-4]。ICH后的脑损伤是通过血肿对周围组织的直接压迫效应产生的原发性损伤和血肿及其代谢产物产生的继发性损伤,包括脑水肿、炎症和血液裂解产物产生的生化毒性[5]。近年来,随着微创技术及术后并发症管理技术的不断提高,ICH后的病死率有所下降,但是并未改善ICH患者的长期神经功能预后[6]。因此,需重视干预ICH后的继发性损伤。
神经炎症是ICH后继发性损伤的主要驱动环节[7],其在ICH后数小时内即可发生,并可持续数周[8]。活化的小胶质细胞是细胞因子、趋化因子、前列腺素和其他免疫调节分子的主要来源,所以,活化的小胶质细胞可加重ICH后继发性损伤,并参与随后的脑修复过程[9]。根据小胶质细胞对神经炎症的作用效应,可分为M1型小胶质细胞(促炎/细胞毒性机制)和M2型小胶质细胞(抗炎/神经保护机制)[10]。调节小胶质细胞表型能促进ICH后血肿和水肿的吸收,减轻继发性脑损伤,促进脑组织修复[11-12]。过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ, PPARγ)属于核受体超家族,在抑制神经炎症、抗氧化、延缓神经退行性变过程中均发挥着重要作用[13-14]。近年来,有研究表明,在ICH后通过激活PPARγ可极化M2型小胶质细胞、加速血肿吸收和改善神经功能预后[15]。
ICH属于中医学“中风”的范畴。肝肾亏虚为本,冲气不敛,冲气随肝气上逆是其主要病因病机之一,镇肝息风、平冲降逆是临床治疗ICH的基本思路[16]。“玄府”为人体津液化生、输布、代谢提供终极通道和至微结构[17],在脑内分布丰富,与血脑屏障有着密切的相关性[18]。因此,调节玄府功能为中医治疗ICH的新思路。安脑平冲方是湖南中医药大学第一附属医院脑病一科周德生教授团队依据ICH病因病机及玄府理论创制的治疗中风的科室协议方,已在临床安全使用十余年。课题组前期临床研究发现,安脑平冲方可减轻脑出血患者的脑水肿,有利于患者的神经功能康复[19];实验研究也证实,安脑平冲方可减少ICH大鼠血清白细胞介素-1β(interleukin, IL-1β)表达量[20],改善ICH大鼠神经功能缺损,抑制ICH后炎症反应,保护神经功能[21]。但是安脑平冲方在ICH后通过调节小胶质细胞表型减轻神经炎症的作用机制尚未被研究。因此,本研究将脑玄府理论与神经炎症相结合,旨在探讨安脑平冲方含药血清(A-HYXQ)调节炎症的内在机制。
1 材料
1.1 动物
健康清洁级雄性大鼠36只,体质量180~220 g,购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。本次动物试验获得湖南中医药大学第一附属医院实验动物伦理委员会批准(伦理审批号:ZYFY20210427)。大鼠放置于清洁级实验动物房饲养,温度20~25 ℃,濕度45%~55%。
1.2 BV2细胞
小鼠小胶质细胞系BV2细胞由湖南中医药大学中西医结合实验室细胞中心提供。
1.3 药物
安脑平冲方组成:生龙骨(先煎)30 g,生牡蛎(先煎)30 g,川牛膝15 g,白蒺藜12 g,钩藤(后下)12 g,泽泻12 g,牡丹皮12 g,栀子12 g,黄芩12 g,白芍12 g,生大黄(后下)9 g,甘草6 g。购于湖南中医药大学第一附属医院门诊中药房。经两次提取过滤及水浴浓缩后熬制成含生药4.5 g/mL的溶液,无菌玻璃瓶分装,贮存于4 ℃冰箱备用。PPARγ抑制剂GW9662购买于美国MedChemExpress公司(批号:HY-16578)。
1.4 主要试剂
一抗Ym-1、诱导型一氧化氮合酶(inductible nitric oxide synthase, iNOS)、白细胞介素-6(interleukin, IL-6)(英国abcam公司,批号:ab192029、ab178945、ab233706);β-actin、PPARγ、精氨酸酶-1(arginase-1, Arg-1)、白细胞介素-4(interleukin, IL-4)、白细胞介素-10(interleukin, IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin, IL-1β)(武汉三鹰生物技术有限公司,批号:20536-1-AP、16643-1-AP、16001-1-AP、17590-1-AP、60269-1-Ig、17590-1-AP、16806-1-AP);超纯总RNA提取试剂盒(杭州新景生物试剂开发有限公司,批号:5003050);IL-1β、TNF-α ELISA试剂盒(江苏晶美生物科技有限公司,批号:J2923-B、J3056-B);CCK-8试剂盒(北京兰杰柯科技有限公司,批号:BS350A);氯化血红素(上海阿拉丁生化科技股份有限公司,批号:16009-13-5);BV2专用细胞培养基(武汉普诺赛生物有限公司,批号:CM-0493)。
1.5 主要仪器
超灵敏多色荧光分析仪(美国ProteinSimple公司,型号:FluorChem R);荧光定量PCR仪器(德国艾本德仪器有限公司,型号:Realplex2);多功能酶标仪(雷杜生命科学股份有限公司,型号:Enspire);激光扫描共聚焦显微镜(美国蔡司公司,型号:LSM800)。
2 方法
2.1 含药血清制备
健康清洁雄性大鼠适应性喂养1周后连续3 d予以安脑平冲方灌胃,每日2次。末次给药后1 h腹主动脉采血,收集血清,空白血清采用相同动物,不给药同法收集血清,0.22 μm滤膜过滤,56 ℃水浴灭活30 min,分装于-20 ℃冰箱保存。
2.2 细胞培养
经复苏后,BV2细胞添加BV2细胞专用培养基,将其放置在37 ℃、5% CO2的湿润培养箱中。
2.3 细胞增殖测定
根据CCK-8试剂盒说明书,将细胞按照5000个/孔铺板至96孔板,处理完毕后,每孔加入10 μL CCK-8,放置在37 ℃、5% CO2的湿润培养箱中2 h后,用酶标仪测定在450 nm处的吸光值。
2.4 模型建立及分组
利用氯化血红素干预BV2小胶质细胞模拟ICH体外模型[22]。实验第一部分分为3组,分别为对照组、模型组、安脑平冲方含药血清组(A-HYXQ组);第二部分分为4组,分别为对照组、模型组、A-HYXQ组、A-HYXQ+GW9662组。细胞铺板至6孔板或24孔板,造模方法為60 μmol/L的氯化血红素干预BV2小胶质细胞24 h。对照组为正常生长的BV2细胞,模型组造模24 h后给予10%空白血清,A-HYXQ组造模24 h后给予10% A-HYXQ,A-HYXQ+GW9662组造模24 h后,在给10% A-HYXQ前1 h给予10 μmol/L的GW9662。
2.5 免疫荧光
细胞铺板至6孔板,经干预后,予以4%多聚甲醛固定,5% Triton X-100通透,经山羊血清封闭后,放置湿盒中4 ℃孵育一抗Ym-1(1∶200)、IL-10(1∶300)、iNOS(1∶250)、IL-6(1∶100)、PPARγ(1∶300)、Arg-1(1∶200)、IL-4(1∶300)过夜。第2天避光孵育对应二抗Alexa Fluor■ 647(1∶500)、山羊抗小鼠IgG FITC(1∶400)50 min,滴加DAPI复染细胞核后,在激光扫描共聚焦显微镜下观察并拍照。每张图片选取3个视野,每个视野选取5个细胞测量相应抗体的平均荧光强度。
2.6 Western blot法
将细胞铺至6孔板,干预后,提取总蛋白,测定蛋白浓度,配制10%分离胶,上样后进行电泳、转膜,用5%脱脂牛奶封闭1 h,TBST清洗3次,分别加入一抗Ym-1(1∶5000)、IL-10(1∶10 000)、iNOS(1∶1000)、IL-6(1∶1000)、PPARγ(1∶3000)、Arg-1(1∶1000)、IL-4(1∶2000)、TNF-α(1∶1500)、IL-1β(1∶1000)、β-actin(1∶8000),经4 ℃冰箱孵育过夜,第2天加入相应二抗山羊抗小鼠IgG HRP(1∶10 000)、山羊抗兔IgG HRP(1∶10 000),室温摇床孵育1 h,最后进行显色曝光,用Image J软件分析条带灰度值。
2.7 qRT-PCR法
根据试剂盒说明书从6孔板中分离纯化总RNA,合成cDNA后,使用荧光定量PCR仪进行PCR 扩增。采用2-ΔΔCt法计算各组相应的mRNA表达水平。引物由武汉金开瑞生物工程有限公司合成,详见表1。
2.8 ELISA法
细胞铺板至6孔板,经干预后,收集上清液1 mL,经高速冷冻离心机4 ℃,3000 r/min离心10 min(离心半径15 cm),留取上清液至-80 ℃保存,按照ELISA试剂盒说明书操作。
2.9 统计学方法
采用GraphyPad Prism 8对数据进行统计学分析。数据符合正态性和方差齐性时,采用One-Way
ANOVA检验比较各组间差异,不符合则采用秩和检验,P<0.05提示差异具有统计学意义。
3 结果
3.1 造模及给药条件
3.1.1 氯化血红素对BV2细胞存活率的影响 选取30、60、90 μmol/L氯化血红素干预BV2细胞,结果显示,与0 μmol/L比较,30、60、90 μmol/L氯化血红素BV2细胞存活率均降低(P<0.05)。考虑90 μmol/L氯化血红素细胞存活率过低,因此,选择60 μmol/L作为后续处理细胞的氯化血红素浓度。详见图1A。
3.1.2 A-HYXQ对细胞存活率的影响 与对照组相比,模型组、A-HYXQ组(5%、10%、15%)细胞存活率下降(P<0.05);与模型组相比,A-HYXQ组(10%、15%)细胞存活率明显上升(P<0.05);10%与15% A-HYXQ组细胞存活率差异无统计学差异(P>0.05)。因此,选择10%浓度作为细胞后续处理的A-HYXQ浓度。详见图1B。
3.1.3 GW9662对BV2细胞存活率的影响 选取5、10、15 μmol/L的GW9662,在加入10% A-HYXQ前1 h干预BV2细胞。结果显示,与0 μmol/L相比,10、15 μmol/L的GW9662可明显减少BV2细胞存活率(P<0.05);10 μmol/L与15 μmol/L GW9662细胞存活率差异无统计学意义(P>0.05)。因此,选择10 μmol/L作为细胞后续处理的GW9662浓度。详见图1C。
3.2 各组Ym-1和IL-10平均荧光强度及蛋白表达量比较
与对照组相比,模型组Ym-1和IL-10的平均荧光强度及蛋白表达量均明显下降(P<0.05);与模型组相比,A-HYXQ组的Ym-1和IL-10的平均荧光强度及蛋白量均显著上升(P<0.05)。详见图2—3。
3.3 各組IL-6和iNOS平均荧光强度及蛋白表达量比较
与对照组相比,模型组的IL-6和iNOS平均荧光强度及蛋白量均明显上升(P<0.05);与模型组相比,A-HYXQ组的IL-6和iNOS的平均荧光强度及蛋白量均显著下降(P<0.05)。详见图4—5。
3.4 各组PPARγ、Arg-1和IL-4平均荧光强度、蛋白及mRNA表达量比较
与对照组相比,模型组PPARγ、Arg-1和IL-4的平均荧光强度、蛋白及mRNA表达量均明显下降(P<0.05);与模型组相比,A-HYXQ组PPARγ、Arg-1和IL-4的平均荧光强度、蛋白及mRNA表达量均显著上升(P<0.05);与A-HYXQ组相比,A-HYXQ+GW9662组PPARγ、Arg-1和IL-4平均荧光强度、蛋白及mRNA表达量下降(P<0.05)。详见图6—8。
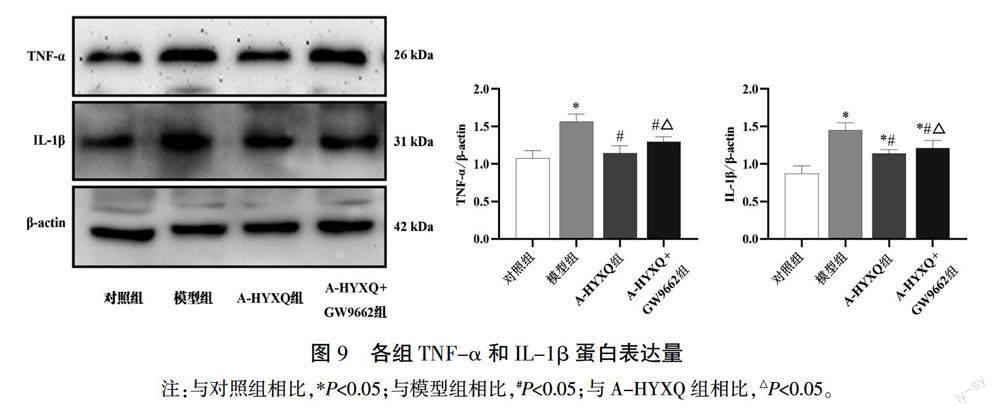
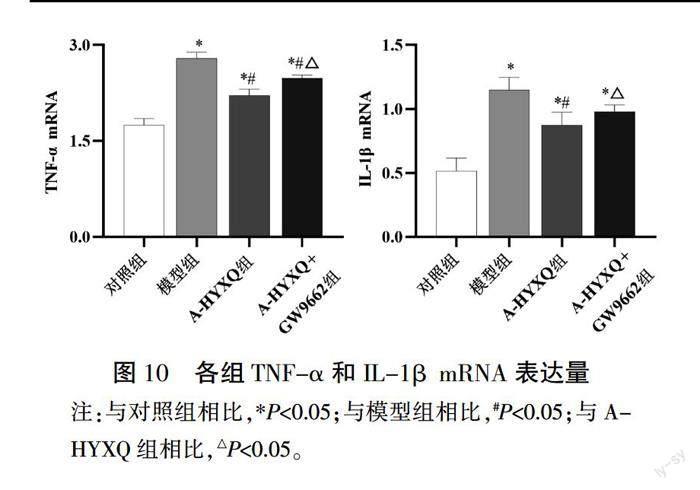
3.5 各组TNF-α和IL-1β蛋白、mRNA、上清液含量比较
与对照组相比,模型组TNF-α和IL-1β蛋白、mRNA、上清液含量均明显上升(P<0.05);与模型组相比,A-HYXQ组的TNF-α和IL-1β蛋白、mRNA、上清液含量均明显下降(P<0.05);与A-HYXQ组相比,A-HYXQ+GW9662组TNF-α和IL-1β蛋白、mRNA、上清液含量上升(P<0.05)。详见图9—11。
4 讨论
ICH后血肿周围继发性神经炎症是导致ICH神经功能预后欠佳的主要原因之一,减轻ICH后神经炎症反应可以改善ICH患者的功能预后[7]。ICH归属于中医学“中风”范畴,根据冲脉及玄府理论创制的安脑平冲方具有潜摄冲脉、通调气血的功效。小胶质细胞是大脑损伤后最先被激活的胶质细胞,其有M1和M2两种表型[12]。本研究发现,A-HYXQ可增加经氯化血红素损伤BV2细胞的Ym-1和IL-10表达、调节小胶质细胞表型、减少炎症因子iNOS和IL-6表达。PPARγ属于核受体超家族,在ICH后可通过激活PPARγ信号通路调节小胶质细胞表型、加速血肿清除、减少神经炎症[23]。为证实A-HYXQ可从多途径、多靶点极化M2小胶质细胞,本研究选用其他M1及M2型小胶质标志物。研究结果证实,A-HYXQ可增加PPARγ、Arg-1和IL-10表达,同时减少IL-6和iNOS表达,调节小胶质细胞表型,使其向M2型小胶质细胞转变,而且PPARγ抑制剂GW9662可部分消除A-HYXQ的保护效应。因此,安脑平冲方可调控小胶质细胞表型的变化,调节玄府开阖,保持血脑屏障的完整性,减少ICH后炎症物质的产生及渗入,发挥神经保护作用。
综上所述,本研究证实安脑平冲方可从多靶点极化M2型小胶质细胞,调节小胶质细胞表型、减轻神经炎症;并发现其保护效应可能是通过激活PPARγ信号通路,促进小胶质细胞向M2型转化而实现。
参考文献
[1] PINHO J, COSTA A S, ARA■JO J M, et al. Intracerebral hemorrhage outcome: A comprehensive update[J]. Journal of the Neurological Sciences, 2019, 398: 54-66.
[2] WU S, WU B, LIU M, et al. Stroke in China: Advances and challenges in epidemiology, prevention, and management[J]. The Lancet Neurology, 2019, 18(4): 394-405.
[3] VAN ASCH C J, LUITSE M J, RINKEL G J, et al. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: A systematic review and meta-analysis[J]. The Lancet Neurology, 2010, 9(2): 167-176.
[4] GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820.
[5] WILKINSON D A, PANDEY A S, THOMPSON B G, et al. Injury mechanisms in acute intracerebral hemorrhage[J]. Neuropharmacology, 2018, 134(Pt B): 240-248.
[6] CAMPBELL B, KHATRI P. Stroke[J]. The Lancet, 2020, 396(10244): 129-142.
[7] XUE M, YONG V W. Neuroinflammation in intracerebral haemorrhage: Immunotherapies with potential for translation[J]. The Lancet Neurology, 2020, 19(12): 1023-1032.
[8] BAI Q, XUE M Z, YONG V W. Microglia and macrophage phenotypes in intracerebral haemorrhage injury: Therapeutic opportunities[J]. Brain, 2020, 143(5): 1297-1314.
[9] WANG J, DOR?魪 S. Inflammation after intracerebral hemorrhage[J]. Journal of Cerebral Blood Flow & Metabolism, 2007, 27(5): 894-908.
[10] TSCHOE C, BUSHNELL C D, DUNCAN P W, et al. Neuroinflammation after intracerebral hemorrhage and potential therapeutic targets[J]. Journal of Stroke, 2020, 22(1): 29-46.
[11] WANG J. Preclinical and clinical research on inflammation after intracerebral hemorrhage[J]. Progress in Neurobiology, 2010, 92(4): 463-477.
[12] ZHANG Z, ZHANG Z, LU H, et al. Microglial polarization and inflammatory mediators after intracerebral hemorrhage[J]. Molecular Neurobiology, 2017, 54(3): 1874-1886.
[13] SCHNEGG C I, ROBBINS M E. Neuroprotective mechanisms of PPARδ: Modulation of oxidative stress and inflammatory processes[J]. PPAR Research, 2011, 2011: 373560.
[14] SKERRETT R, MALM T, LANDRETH G. Nuclear receptors in neurodegenerative diseases[J]. Neurobiology of Disease, 2014, 72: 104-116.
[15] ZHUANG J F, PENG Y C, GU C, et al. Wogonin accelerates hematoma clearance and improves neurological outcome via the PPAR-γ pathway after intracerebral hemorrhage[J]. Translational Stroke Research, 2021, 12(4): 660-675.
[16] 周德生,胡 华,杨 洋,等.冲脉理论与脑出血冲气上逆病机特征之探讨[J].辽宁中医杂志,2013,40(11):2184-2186.
[17] 须 冰,黄 芳,褚湘农.玄府理论及其临床应用探讨[J].上海中医药杂志,2015,49(9):7-9.
[18] 董 丽,李 波,白 雪,等.脑之玄府与血脑屏障的相关性[J].中医杂志,2013,54(22):1969-1971.
[19] 龙运军,吴兵兵,周德生,等.安脑平冲片治疗基底核区脑出血36例临床疗效观察[J].中西医结合心脑血管病杂志,2018,16(6): 798-800.
[20] XU J, CHEN Z Q, YU F, et al. IL-4/STAT6 signaling facilitates innate hematoma resolution and neurological recovery after hemorrhagic stroke in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(51): 32679-32690.
[21] 左玲敏.從P2X7R/NLRP3通路探讨安脑平冲方对脑出血后炎症反应的影响[D].长沙:湖南中医药大学,2020.
[22] 周德生,李煦昀,陈 瑶,等.安脑平冲片联合甘露醇注射液对大鼠脑出血后血肿周围MMP-9及TIMP-1表达的影响[J].中国中医急症,2013,22(7):1113-1116.
[23] XU C R, CHEN H J, ZHOU S J, et al. Pharmacological activation of RXR-α promotes hematoma absorption via a PPAR-γ-dependent pathway after intracerebral hemorrhage[J]. Neuroscience Bulletin, 2021, 37(10): 1412-1426.
〔收稿日期〕2022-07-07
〔基金项目〕国家自然科学基金项目(81874463);中医内科重大疾病防治研究与转化教育部重点实验室开放基金(ZYNK201609);湖南省科技厅科技创新平台与人才计划(2017SK4005);湖南省重点研发计划(2020SK2092)。
〔第一作者〕张 瑛,女,博士研究生,研究方向:中医药防治脑血管病。
〔通信作者〕*周德生,男,博士,主任医师,教授,博士研究生导师,E-mail:2478020529@qq.com。

