关于新型冠状病毒感染若干问题的多学科临床诊疗推荐意见
西安交通大学第二附属医院新冠感染诊疗推荐意见编委会
(西安交通大学第二附属医院,陕西西安 710004)
由新型冠状病毒感染(简称新冠感染)引起的疫情已持续了3年,国内外学者对其病原学、流行病学、发病机制、临床表现、诊断和治疗等已进行了较多研究,并有了一定的认识。但新冠病毒变异性强,目前主流毒株为奥密克戎变异株。尽管这种毒株致病力、致死率明显下降,但其传播力明显增强。自2022年12月以来,新冠感染患者激增。国家卫健委及时推出了第十版《新型冠状病毒感染诊疗方案(试行版)》用于指导临床诊疗。为了更好地发挥其在临床具体实践过程中的指导作用,由西安交通大学第二附属医院呼吸与危重症医学科牵头,组织心血管内科、肾脏内科、风湿免疫科、康复科、中医科、营养科等相关学科,在第十版诊疗方案的基础上,通过复习文献和结合临床经验,对新冠感染诊疗中的一些问题进行了细化和归类,认真讨论,形成了如下推荐意见,供临床参考。
1 新冠感染需重点关注的症状
1.1 概述
面对新冠感染患者,一定要详细询问有无气短、呼吸困难、心慌、胸闷、胸痛、咯血等。若有,需要考虑到可能出现了肺炎或肺栓塞,甚至心肌炎、心肌梗死或心功能不全。这些是患者猝死的主要原因,需重点关注。
1.2 机制
①尽管新冠感染主要累及上呼吸道,但也有部分患者会出现病毒性肺炎,若肺炎范围大或有基础疾病者,则可能发生低氧血症,甚至呼吸衰竭。②新冠感染后容易导致血管内皮细胞损伤;新冠感染后发热及应用退热药物后大量发汗等,造成血液浓缩;新冠感染后部分患者乏力明显,活动少。这些因素都容易导致肺栓塞的形成。③新冠感染后除出现肺部受累外,还容易诱发原有心脏病病情加重,甚至出现心肌梗死、心力衰竭、高血压、恶性心律失常、猝死等;新冠感染也可以累及心肌,造成心肌损伤,如累及心脏传导系统,可出现各种类型心律失常等,严重者可引起暴发性心肌炎、心衰,甚至猝死。
1.3 处理
尽快检查D-二聚体、血气分析(建议门诊医师随身携带指脉氧仪)、胸部CT 以及心电图、心肌损伤标志物(尤其是肌钙蛋白)、脑钠肽(brain natriuretic peptide,BNP)、N-末端前脑钠肽(N-terminal brain natriuretic peptide,NT-proBNP)等。若上述检查有异常,则建议住院诊疗。
2 沉默性缺氧
2.1 概述
沉默性缺氧又称为静默型低氧血症。其主要是由新冠感染引起的缺氧程度与临床表现不符的低氧血症。这类患者在不吸氧时血氧饱和度往往低于93%,甚至部分患者低于80%,但患者并无气短、胸闷及呼吸困难等症状;或者静息状态患者血氧饱和度与基础值变化不大,但日常活动即会引起血氧饱和度下降4%~5%,若不及时治疗,易导致多脏器功能不全,甚至死亡。这些患者可出现肌肉酸痛、乏力、咳嗽、发热及大汗等,特别要注意的是口唇及四肢末梢紫绀。部分老年人可无发热、咳嗽、胸闷、气短等任何不适,或既往慢性疾病的症状无加重,仅表现为食纳及精神差、嗜睡等,但活动后有突然晕厥或猝死的可能。
密切监测血氧饱和度,能够配合的患者可行氧负荷试验,如6 min步行试验。如试验后血氧饱和度较基础值下降4%~5%,提示存在沉默性缺氧。
2.2 机制
目前尚不明。可能与以下因素有关:①新冠感染造成肺小血管收缩,微血栓形成,通气血流比例失调等;②新冠感染导致的肺炎属于间质性肺炎,一般不出现CO2潴留,故患者气促不明显;③沉默性缺氧主要发生在老年人及有严重基础疾病的患者,而这些患者对缺氧往往已耐受或不敏感。
2.3 处理
尽早住院治疗、积极氧疗、心电监护、俯卧位、抗病毒治疗、抗凝治疗、呼吸支持治疗、基础病治疗及防治并发症。
3 细胞因子风暴
3.1 临床特点及意义
细胞因子风暴是指新冠感染机体后,巨噬细胞、中性粒细胞等炎症细胞广泛浸润并产生大量细胞因子 和 趋 化 因 子(TNF-α、IL-1、IL-6、IL-12、IFN-α、IFN-β、IFN-γ、MCP-1和IL-8)的现象,是引起急性呼吸窘迫综合征(ARDS)和多脏器衰竭的重要原因。
细胞因子风暴发生时的临床特点[1]:①患者几乎都有发热症状,可能出现疲劳、厌食、头痛、皮疹、腹泻、关节痛、肌痛和神经精神症状。多数患者有包括咳嗽和呼吸急促等呼吸系统症状,可发展为ARDS,并伴有低氧血症,可能需要机械通气。此外,部分患者可迅速发展为弥散性血管内凝血(DIC),伴有血管闭塞或大出血、呼吸困难、低氧血症、低血压、血管扩张性休克和死亡。②细胞因子风暴发生时,非特异性炎症标志物如C反应蛋白(CRP)普遍升高。部分患者伴有高甘油三酯血症和各种血细胞计数异常,如白细胞变化、贫血、血小板减少,以及铁蛋白和D-二聚体水平升高。通常血清炎症细胞因子(IFN-γ、IL-6、IL-10和sIL-2Rα)水平可显著升高,其中IL-6 是一种功能广泛的多效性细胞因子,可激活JAK-STAT通路,诱导炎症反应并可能形成细胞因子风暴,为ARDS及其他肺外脏器损伤的重要因素。
IL-6水平升高的临床意义[2-3]:①重症及危重症患者早期预警;②预测疾病进展程度,患病期间的最高IL-6水平≥80 pg/m L 时患者发生呼吸衰竭的风险为92%,较IL-6水平较低的患者高出22倍,因此可根据其变化预测呼吸衰竭的发生,并指导机械通气;③死亡的独立危险因素;④指导重型及危重型新冠患者的免疫治疗;⑤指导抗生素的合理使用。
3.2 机制
非免疫细胞(肺泡上皮细胞、血管内皮细胞)的模式识别受体识别新冠病毒后,合成IL-6并激活细胞内NF-κB通路产生TNF-α、sIL-6Rα和EGF,从而激活 肿 瘤 坏 死 因 子 受 体/NF-κB、IL-6R/STAT3 和EGF/NF-κB信号通路;上述炎性级联反应进一步增强了感染细胞内NF-κB 的活性并形成正反馈通路,使受感染的非免疫细胞产生大量IL-6、TNF-α、GM-CSF等细胞因子参与细胞因子风暴的形成[4]。
低水平的干扰素应答可促进受感染的肺泡上皮细胞释放单核细胞趋化因子、趋化因子CCL2 和CCL7,诱导血液中的单核细胞趋化到肺部,激活JAK-STAT 信号通路,使单核细胞分化成巨噬细胞,以巨噬细胞为主导的先天免疫应答被启动,而后巨噬细胞的模式识别受体识别病毒并呈递病毒抗原给T淋巴细胞,进而诱导T淋巴细胞分化成为效应T细胞(辅助性T细胞Th1和Th17)。Th1细胞分泌IL-6、GM-CSF和TNF-α,进一步活化单核细胞和促进炎症因子释放;而Th17细胞分泌的IL-17和IL-1β在炎症反应中发挥重要作用:如IL-17 促进GM-CSF分泌以及趋化中性粒细胞在肺内发挥损伤作用,IL-1β通过发挥促炎功能扩大肺组织中的炎症反应[5]。在上述过程中,除了IL-6、GM-CSF、TNF-α、IL-17和IL-1β等主要的细胞因子之外,还有其他细胞因子如IL-2、CXCL10、MIP-1a等参与细胞因子风暴的损伤过程,这些细胞因子与其受体结合导致肺部炎症反应放大,最终造成患者肺损伤。
3.3 处理[6]
①抗休克治疗:输液保障血容量,应用血管活性药物,必要时机械通气,保护重要脏器功能;②支持和对症治疗:常规输液、维持水电解质及酸碱平衡、营养支持等;③抑制过多的免疫细胞活化和细胞因子产生:临床多采用适当剂量和疗程的糖皮质激素,或非甾体类抗炎药和自由基清除剂(大量维生素C 或维生素E)等治疗措施;④抗体中和细胞因子风暴:如托珠单抗、JAK 抑制剂(见后文的免疫治疗部分)等。
4 淋巴细胞计数变化
4.1 概述
淋巴细胞绝对值为(0.8~4)×109/L。淋巴细胞减少症定义为淋巴细胞绝对计数低于1.0×109/L。虽然淋巴细胞增高常见于病毒感染,但新冠感染患者淋巴细胞却是降低的。低淋巴血症与疾病严重程度及预后密切相关,淋巴细胞计数<500/μL 提示预后差[7]。淋巴细胞亚型低于以下数值与高住院死亡风险相关:CD3+T细胞<200/μL,CD4+T细胞<100/μL,CD8+T细胞<100/μL,B细胞<50/μL[8]。
4.2 机制
目前具体机制还不完全清楚,可能与新冠感染时,为避免被免疫清除,通过各种方式增加抗炎反应,并启动淋巴细胞负调控,抑制淋巴细胞功能,增加淋巴细胞凋亡,甚至淋巴细胞耗竭,导致淋巴细胞下降。而随着病情好转,病毒对免疫损伤减少,淋巴细胞会回升。
既往研究表明,新冠感染患者T 淋巴细胞亚群变化主要表现为T 淋巴细胞数量减少和CD4+/CD8+比值增加,且与病情严重程度呈正相关;糖皮质激素治疗可缓解CD4+/CD8+比值上升,但加剧了T 淋巴细胞减少。回顾性分析发现,中性粒细胞/淋巴细胞比值(NLR)与新冠患者的死亡风险以及使用糖皮质激素是否获益密切相关。当NLR值高于6.11时,使用糖皮质激素和降低死亡率、改善预后显著相关;当NLR 值低于6.11时,使用糖皮质激素不仅不能获益,反而会增加高血糖和感染的风险。淋巴细胞无下降或短暂下降后恢复,提示糖皮质激素治疗有效,免疫抑制作用有限,可继续应用,必要时适当延长应用的时间,否则需及时停用[9]。
4.3 处理
《新型冠状病毒肺炎诊疗方案(试行第九版)》和《新型冠状病毒感染诊疗方案(试行第十版)》均将外周血淋巴细胞计数(如T 淋巴细胞亚群检测)作为新冠感染患者的一般检查,并将外周血淋巴细胞计数进行性降低作为新冠感染患者重型/危重型的早期预警指标,以协助重型和危重型的诊断。由国家呼吸医学中心牵头发布的《中日医院成人Omicron病毒感染初始诊疗方案》,将T 淋巴细胞亚群检测作为所有新冠感染患者入院当天的检测项目。中华医学会呼吸病学分会危重症学组与中国医师协会呼吸病学分会危重症医学专家组制定的《奥密克戎变异株所致重症新型冠状病毒感染临床救治专家推荐意见》中阐述低淋巴血症与疾病严重程度及预后密切相关。
5 抗病毒治疗
早期应用抗病毒药物,减少病毒复制,是降低新冠重型及危重型发生的关键。目前抗病毒治疗推荐小分子抗病毒药物、中和抗体与康复者恢复期血浆。
5.1 小分子抗病毒药物
目前国内已经获批临床应用的小分子抗病毒药物包括奈玛特韦/利托那韦、莫诺拉韦、阿兹夫定,具体见表1。需要注意的是,目前尚无循证医学证据支持小分子抗病毒药物的联合应用。

表1 临床应用的新冠感染小分子抗病毒药物[10-14]Tab.1 Small molecule antiviral drugs for novel coronavirus infection
5.2 抗体及康复者恢复期血浆
随着病毒变异株的不断出现,抗体类药物的有效性也有所变化,应根据药物可及性、最新版诊治指南及高水平循证医学证据选择合适的药物。
5.2.1 安巴韦单抗/罗米司韦单抗注射液 ①作用机制:安巴韦单抗/罗米司韦单抗靶向结合新冠病毒S蛋白受体结合域不同部位,阻断病毒与血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)结合,抑制病毒感染细胞从而发挥中和效应。②适应证:轻、中型且伴有进展为重症高风险因素的成人和青少年(12~17岁,体质量≥40 kg)患者。③用法用量:安巴韦单抗/罗米司韦单抗的剂量分别为1 000 mg。在给药前两种药品分别以100 m L生理盐水稀释后,经静脉序贯输注给药,以不高于4 mL/min的速度静脉滴注,之间使用生理盐水100 mL冲管;在输注期间对患者进行临床监测,并在输注完成后对患者进行至少1 h的观察。④不良反应:过敏反应、腹泻、呕吐、发热、寒战、支气管炎、输液相关反应、血压升高、失眠、咳嗽、流涕。
5.2.2静注COVID-19 人免疫球蛋白 ①作用机制:该药含有高纯度、高效价新冠中和抗体,可中和新冠病毒,使其失去感染性,且其保留的Ig G 可能抑制炎症介质的释放,减轻炎症反应;此外其含有多种抗体形成的复杂免疫网络,具有免疫替代和免疫调节的双重作用。②适应证:有重症高风险因素、病毒载量较高、病情进展较快的病程早期患者。③用法用量:使用剂量为轻型100 mg/kg,中型200 mg/kg,重型400 mg/kg,静脉输注,根据患者病情改善情况,次日可再次输注,总次数不超过5次。该药必须严格单独输注,不得与其他药物混合使用。
5.2.3新冠感染康复者恢复期血浆 ①作用机制:康复者恢复期血浆是从新冠感染康复者采集的富含高浓度IgG 抗体的血浆,能迅速与新冠病毒结合,中和或清除病毒;且可能通过增加病毒抗原的处理和呈递来增强适应性免疫反应。②适应证:可在病程早期用于有重症高风险因素、病毒载量较高、病情进展较快的患者。③用法用量:输注剂量为200~500 m L(4~5 m L/kg),可根据患者个体情况及病毒载量等决定是否再次输注。④注意事项:由于病毒变异株的出现,应选择同种变异株康复者恢复期血浆。
6 免疫治疗
6.1 糖皮质激素
①作用机制:糖皮质激素可抑制新冠感染后机体过度的免疫反应及炎症因子风暴所导致的肺部炎性渗出及脏器损伤[15]。②适应证:新冠感染后炎症反应强烈或存在炎症风暴重型或危重型患者。③使用时机:氧合指标进行性恶化,影像学进展迅速,机体炎症反应激活(如IL-6、D-二聚体显著升高等)。④用法用量:地塞米松5~6 mg/d,特殊体质量(超轻或超重)患者按1 mg/10 kg剂量,或甲泼尼龙40 mg/d,3~5 d后可酌情减量为20 mg/d。疗程7~10 d。患者症状好转、炎症控制后应尽早停用糖皮质激素,疗程超过14 d的糖皮质激素治疗应逐渐减停,避免糖皮质激素“戒断”症状。⑤注意事项:既往有地塞米松、甲泼尼龙过敏或禁忌者可“等效剂量”转换为强的松或氢化可的松。
6.2 托珠单抗
①作用机制:IL-6是一种多效性细胞因子,在新冠感染重症患者发生的“炎症因子风暴”中有至关重要的作用。早期应用IL-6抑制剂托珠单抗可降低机械通气使用率和死亡率[16]。②适应证:常与糖皮质激素联合应用于新冠感染后高炎症状态的进展性重型及危重型患者的早期治疗。③使用时机:不能用细菌感染解释的IL-6水平明显升高(尤其≥3倍正常值)及CRP、铁蛋白显著升高。④用法用量:推荐单次给药,静脉注射剂型推荐剂量4~8 mg/kg,生理盐水稀释至100 m L,输注时间大于1 h;当静脉剂型不可及时,可考虑皮下剂型,皮下剂型常规推荐剂量为324 mg(2支),体质量≤50 kg推荐162 mg(1支),体重≥100 kg推荐486 mg(3支)皮下注射。首次用药疗效不佳者,可在首剂给药12 h后,1~3 d内酌情追加应用1次(剂量同前)。⑤注意事项:既往对托珠单抗过敏患者禁用,活动性结核患者禁用,肝功不全者减量应用,转氨酶≥10倍上限者慎用。
6.3 巴瑞替尼
①作用机制:巴瑞替尼通过抑制JAK1、JAK2通路阻断IL-6等炎症性细胞因子的信号转导发挥抗炎作用,可作为托珠单抗的替代药物。②适应证:用于新冠感染后高炎症状态的进展性重型及危重型患者。③使用时机:不能用细菌感染解释的IL-6、IL-8、IL-10等细胞因子水平明显升高及CRP、铁蛋白显著升高。④用法用量:巴瑞替尼4 mg/d口服,1次/d,体质量≤50 kg者推荐2 mg/d,疗程7~14 d,如患者≥65岁且与糖皮质激素联用,建议加用低分子肝素抗凝治疗以预防血栓形成。⑤注意事项:既往有脑梗死、肺栓塞、静脉血栓病史患者和严重肾功能不全患者以及带状疱疹感染期间禁用,有血栓高危因素患者、合并严重细菌感染患者慎用。
7 抗凝治疗
7.1 机制
新冠感染后导致的高凝状态有导致多种血栓并发症并有危及生命的风险。新冠感染后的高凝状态可能与以下因素有关[17]:①新冠病毒可直接导致血管内的红细胞发生聚集;②新冠病毒直接损伤内皮细胞,激活凝血;③新冠病毒激活的炎症因子风暴,继发激活凝血;④低氧血症不仅增加血液黏稠度,还可通过依赖于缺氧诱导因子(HIF)的信号通路发挥促凝作用;⑤使用免疫治疗如糖皮质激素、JAK 抑制剂及卧床都增加血栓发生风险;⑥自身免疫机制可能也参与了新冠感染患者血栓事件。
7.2 适应证和禁忌证
适应证:第十版《新型冠状病毒感染诊疗方案(试行版)》中推荐对于具有重症高风险因素、病情进展较快的中型病例,以及重型和危重型病例,需要进行抗凝治疗。禁忌证:①治疗剂量肝素抗凝的禁忌证有血小板<50×109/L;血红蛋白<80 g/L;需双联抗血小板治疗;既往30 d内因出血需急诊就诊;出血性疾病病史;遗传性或活动性获得性出血性疾病;严重肾功能不全。②预防剂量肝素抗凝的禁忌证有近期中枢神经系统出血;活动性大出血且24 h内输血>2 个单位;血小板<50×109/L;严重肾功能不全。
7.3 用法用量及疗程
①无静脉血栓栓塞证据的非住院患者:不推荐抗凝治疗。②无静脉血栓栓塞证据的住院非吸氧患者:不推荐抗凝治疗。③住院需要低流量吸氧且不需要住重症监护室(ICU)且低出血风险的患者:推荐治疗剂量的低分子肝素抗凝,100 IU/kg ih q12h。④入住ICU 或需高流量氧疗的成年患者,无抗凝禁忌:推荐预防剂量低分子肝素抗凝,100 IU/kg ih qd(多项临床研究表明入住ICU 的患者接受治疗剂量抗凝出血风险更高)。⑤已确诊静脉血栓栓塞症患者:推荐治疗剂量的低分子肝素抗凝,100 IU/kg ih q12h。
疗程:抗凝治疗持续14 d或直至其转入ICU 或出院。
特殊情况:可通过监测抗Xa活性使用低分子肝素抗凝。①肾功能不全:eGFR≥30 m L/min,正常抗凝,无需调整剂量。②eGFR 15~29 mL/min,减半剂量抗凝。③eGFR<15 m L/min或透析患者,首选普通肝素。④妊娠期:因新冠感染住院的孕妇,无相关禁忌时,推荐预防剂量抗凝,低分子肝素100 IU/kg ih qd(本部分尚缺少大规模循证医学证据支持)。轻型新冠感染患者也应警惕静脉血栓栓塞的相关风险。
8 俯卧位通气
8.1 概述
临床实践和研究证明俯卧位通气是新冠感染治疗中非常重要的一项措施,对于改善预后、降低患者插管率有关键性作用。
8.2 机制[18]
促进塌陷肺泡复张;改善通气血流比;改善呼吸系统顺应性;利于痰液引流;降低肺血管阻力,改善右心功能,增加心输出量等。
8.3 临床应用
适应证:具有重症高风险因素、病情进展较快的中型、重型和危重型病例。
禁忌证:存在气道梗阻风险、严重血流动力学不稳定、身体腹侧体表存在损伤或伤口而影响俯卧位实施、存在颈椎脊柱不稳定性骨折需要固定;存在颅脑损伤等导致的颅内高压;急性出血性疾病。
临床实施方式:包括清醒俯卧位、经典俯卧位和改良俯卧位。清醒俯卧位适用于在未吸氧时患者脉搏血氧饱和度(SpO2)<93%和呼吸频率>22次/min,以及非有创氧疗支持的患者(图1 A~C);经典俯卧位适用于入住ICU 并接受有创机械通气和(或)体外膜氧合器(ECMO)治疗的危重症新冠感染患者,具体实施流程如图2所示[19];对于孕妇、肥胖、腹腔高压、头面部损伤等不方便行常规俯卧位的患者可采用改良俯卧位(图1D)。
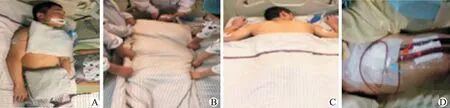
图2 经典俯卧位通气的实施流程Fig.2 Procedure of classical prone position
对符合适应证的患者,应尽早实施俯卧位治疗,且要求每日俯卧位总体时间尽可能大于12 h。若实施过程中出现氧合及动脉二氧化碳分压(PaCO2)改善不明显,或治疗无法获益甚至出现相关并发症,尤其是危及生命的并发症时,需及时终止俯卧位。若患者原发病情得以控制,肺部病灶呈吸收好转趋势,氧合情况明显改善(清醒俯卧位患者呼吸平稳,无需氧疗Sp O2能维持在94%以上;经典俯卧位患者恢复仰卧位后氧合指数明显改善,氧合指数(PaO2/FiO2)>150 mm Hg能维持6 h以上可考虑停止俯卧位治疗。
俯卧位通气实施过程中,可能出现导管移位扭曲打折和脱落、血流动力学不稳定、压力性损伤、周围神经损伤、胃肠营养不耐受等,在实施过程中应注意防范。
9 呼吸支持
呼吸支持是重症新冠感染患者的重要治疗措施,主要包括普通氧疗、经鼻高流量氧疗(HFNO)、无创正压通气(NIPPV)、有创正压通气(IPPV)和体外膜肺氧合(ECMO)技术。理想氧合目标为Sp O2处于93%~96%或患者日常氧合水平[20],推荐常规应用俯卧位通气联合各类呼吸支持技术。
9.1 普通氧疗
鼻导管FiO2最高<50%,普通面罩FiO2<60%,增加部分湿化作用,储氧面罩FiO2<80%,文丘里面罩FiO2<60%,高流速可冲刷部分气道二氧化碳,但湿化作用有限。短时间(1~2 h)密切观察呼吸窘迫和(或)低氧血症有无改善。
9.2 HFNO 与NIPPV
适用于150 mm Hg<PaO2/FiO2<300 mm Hg,同时伴有呼吸频率(RR)>25次/min或呼吸窘迫的患者。HFNO推荐流速30~60 L/min,如需>60 L/min,提示呼吸窘迫。伴有慢性阻塞性肺疾病和心源性肺水肿的危重症患者,首选NIPPV 治疗[21]。
ROX 指 数[(Sp O2/FiO2)/RR]>4.88,预 示HFNO 治疗成功可能性大;ROX 指数3.85~4.88,HFNO 治疗失败可能性大;ROX 指数<3.85,不推荐使用HFNO。下列情况不建议使用HFNO:Pa O2/FiO2<150 mm Hg;RR>35次/min;血流动力学不稳定;酸中毒(p H<7.3)等。HFNO 治疗失败或不耐受,可在严密监测下短时间(1~2 h)尝试NIPPV。一旦失败,应尽早实施IPPV[21]。
9.3 气管插管指征
气管插管有创通气目前尚无统一指征,可参考以下指标综合判断:HFNO、NIPPV 支持下PaO2/FiO2<120 mm Hg;二氧化碳潴留进行性加重伴p H<7.3;严重的呼吸窘迫(如RR>30次/min、胸腹矛盾呼吸,潮气量>500 m L,分钟通气量>14 L/min);气道保护能力差,痰液引流障碍;血流动力学不稳定;意识障碍等。
9.4 IPPV
遵循小潮气量肺保护性通气策略,建议参数如下[22-23]:①潮气量4~8 m L/kg理想体质量,平台压<30 cm H2O 和驱动压<15 cm H2O。对于呼吸系统顺应性正常或轻度降低(≥40 mL/cm H2O)或自主呼吸努力较强者可适当增加潮气量至8 mL/kg理想体质量。②推荐使用高水平呼气末正压(PEEP)(>10 cm H2O)治疗合并中重度ARDS患者,但肺泡复张性差或合并急性肺心病患者应慎用。③早期合并中重度ARDS(PaO2/FiO2<150 mm Hg)患者,若出现肺保护性通气或俯卧位通气实施困难、自主呼吸努力过强和严重人机不协调等情况,可酌情在充分镇静镇痛基础上间断或短期(<48 h)联合使用肌松剂。④对于常规通气参数设置难以纠正的低氧血症,且肺部影像学提示双肺大量渗出影的中重度ARDS患者,可酌情使用肺复张手法(RM)进行挽救治疗。
9.5 ECMO 支持
1)适应证:应用标准机械通气治疗并联合肺复张、俯卧位通气、肌松剂等手段,病情无明显改善并符合以下条件之一[24],可考虑VV-ECMO 治疗:①PaO2/FiO2<50 mm Hg超过3 h;②PaO2/FiO2<80 mm Hg超过6 h;③动脉血p H 值<7.25并伴有PaCO2>60 mm Hg超过6 h。部分患者可出现心肌受累、难治性心源性休克(持续性组织低灌注,收缩压<90 mm Hg,心脏指数<2.2 L/(min·m2),同时给予去甲肾上腺素>0.5μg/(kg·min),多巴酚丁胺>20μg/(kg·min)或同等剂量,可考虑行VA-ECMO 治疗。2)禁忌证:无绝对禁忌证。相对禁忌证如下[25]:高龄;合并无法恢复的基础疾病(如中枢神经系统严重损伤、恶性肿瘤晚期等);存在抗凝禁忌;在较高机械通气条件下(FiO2>90%,平台压>30 cm H2O)机械通气>7 d;伴有严重多器官功能衰竭;主动脉瓣中-重度关闭不全及急性主动脉夹层(VA-ECMO 患者);存在周围大血管解剖畸形或病变而无法建立ECMO血管通路。
10 抗生素的使用
10.1 概述
新冠感染同时合并细菌感染的概率很低,特别是轻型或普通病房的中型患者[25],不推荐常规使用抗菌药物。不合理的抗菌药物使用,会导致细菌耐药性增加,使人体内菌群失调,诱发二重感染,易产生药物不良反应,并造成医疗资源浪费。但感染新冠病毒后,局部呼吸道黏膜损伤,机体防御机制减弱,可能继发细菌感染,多发生在高龄、有基础疾病(如糖尿病、COPD 等)的人群。当继发细菌感染时,需考虑予以抗菌药物治疗。
10.2 应用指征
如果患者在临床上出现以下一种或几种情况,需考虑是否继发细菌感染:①体温明显改善后再次出现发热,不能用新冠感染解释;②咳黄脓痰,痰量明显增多,持续3 d以上且不好转;③降钙素原等感染指标较前明显升高;④胸部CT 提示有细菌感染表现;⑤痰或气道分泌物培养阳性或宏基因组二代测序(metagenomic next-generation sequencing,m NGS)检出临床意义大的病原菌。怀疑细菌感染者应及时送检痰培养、病原学相关检查,综合评估,从严掌握抗菌药物应用指征。
10.3 处理
①对于考虑社区获得性感染,应根据患者年龄、有无基础疾病、疾病严重程度、实验室及影像学检查、既往用药情况,并参考当地流行病学及细菌耐药监测数据,分析最有可能的病原体,可选择呼吸喹诺酮类或二代、三代头孢菌素类进行经验性治疗[26];②对于考虑医院获得性或呼吸机相关性感染,应根据疾病严重程度、多重耐药风险以及所在医疗机构病原菌特点,选用三代、四代头孢菌素或含有β-内酰胺酶抑制剂的复合制剂,碳青霉烯类抗生素仅限于有多重耐药革兰阴性杆菌感染风险的患者[27];③对于使用ECMO或有血管内装置的患者,还应警惕血流感染;④一旦明确病原菌后,应根据药敏结果及时调整给药方案。
11 新冠感染相关心肌炎及心脏疾病合并新冠感染
11.1 新冠感染相关心肌炎
11.1.1概述 新冠感染可累及心血管系统。有研究证实,大约12%的新冠感染住院患者可能存在心肌损伤[28]。虽然在这些患者中,心肌炎较为少见,但与患者预后不良直接相关,且一旦引起暴发性心肌炎将显著增加患者死亡率。研究表明,新冠病毒性心肌炎的发病率在新冠住院患者中约为4.5‰[28],高龄、男性、既往心血管疾病、肥胖、糖尿病、高血压、免疫抑制和严重的全身性疾病都是新冠感染合并心肌炎的高危因素。
11.1.2机制 目前认为新冠感染相关心肌炎的主要机制有3类[29]:①由于心肌细胞中ACE2的高表达,病毒可能直接侵袭心肌细胞导致心肌损伤;②由病毒导致的过度炎症反应及细胞因子风暴导致心肌损伤;③病毒侵犯其他脏器导致的严重低氧等全身情况可影响心血管系统,加重心肌损伤。
11.1.3诊断 新冠感染相关心肌炎是指在新冠感染1~2周后出现以下表现:心脏症状,如胸痛、呼吸困难、心悸、晕厥等;肌钙蛋白(c Tn)升高;心电图异常,如新出现的室性心律失常、房室传导阻滞、弥漫性T 波倒置、ST 段抬高不伴对应导联ST 段倒置压低、QRS波群时限延长等;超声心动图异常,如非冠状动脉走形区域的室壁运动异常,心室应变异常;CMR 影像异常,如非缺血性心肌延迟钆强化,T1、T2弛豫时间延长和/或活检病理学所见如炎性心肌浸润伴心肌细胞变性和坏死。根据美国心脏病协会(American College of Cardiology,ACC)的定义标准,根据心肌炎诊断确定程度分为疑似、拟诊、确诊3 类[30]。确诊病例需有CMR 或心肌活检证实。
11.1.4治疗 血流动力学稳定的疑似心肌炎患者,轻度或无症状,可于急诊动态观察,如果怀疑可能加重或者诊断为暴发性心肌炎,应入院进行临床监测。
1)病情监测:严密监测心电及生命体征变化;监测血常规、c Tn、BNP(或proBNP)、肝肾功、电解质、凝血功能、血乳酸、CRP、IL-6、血气等各项实验室指标;严密监测和管控出入量;胸片、超声心动图根据病情需要复查;必要时行有创血流动力学监测;
2)对症支持治疗:卧床休息,避免剧烈运动;清淡、易消化而营养丰富的饮食;根据病情选择适当氧疗方式(鼻导管、面罩或机械通气);改善心肌能量代谢类药物;大剂量维生素C 有利于减轻过度炎症反应,可给予这类患者维生素C 6 g bid静滴治疗。
3)抗病毒治疗:对于发病5 d以内的患者,可首选应用奈玛特韦/利托那韦(Paxlovid)抗病毒治疗;对于发病5 d以上,尤其是重症心肌炎患者,慎用抗病毒药物。
4)免疫调节治疗:①糖皮质激素:对于出现左室功能不全或新发心律失常的患者,可考虑糖皮质激素治疗。可给予地塞米松(5~10 mg/d,疗程5~10 d)或甲强龙(40~80 mg/d,疗程5~10 d)。②免疫球蛋白(IVIG):虽然IVIG 不能降低新冠感染患者住院时间及死亡率,但IVIG作为暴发性心肌炎重要的免疫调节治疗,可显著改善患者心脏结构功能和预后,因此可酌情使用。剂量:0.1~0.3 g/(kg·d),疗程5~7 d。
5)生命支持治疗:对于血流动力学不稳定的暴发性心肌炎患者尽早使用生命支持治疗。①循环支持:根据患者血流动力学监测指标选择多巴胺、去甲肾上腺素、重组人脑钠肽(rh-BNP)等血管活性药物,心排出量减低(低心排)的患者应根据病情选择合适的强心药物(如洋地黄类、多巴酚丁胺、米力农、左西孟旦等);机械循环支持主要目标是减轻心脏后负荷,维持体循环灌注和冠脉灌注,为心肌细胞恢复争取时间,可根据具体情况选择主动脉内球囊反搏(IABP)、VA-ECMO 或 左 心 辅 助 装 置(如Impella 系 统)。②呼吸支持:暴发性心肌炎患者如存在呼吸功能障碍均推荐尽早给予呼吸支持治疗,以减轻患者劳力负荷和心脏做功,具体可根据患者氧合情况选择无创或有创机械辅助通气。③血液净化及连续肾脏替代治疗(CRRT):对于暴发性心肌炎特别是伴有急性左心功能不全的患者,CRRT 有助于保持患者容量平衡,血液净化可持续过滤去除毒素和细胞因子,因此应密切监测肾功能变化,在合并肾功能损伤时,应早期积极应用。
11.2 心血管疾病患者合并新冠感染
具有糖尿病、冠心病、心力衰竭等心血管基础疾病的患者具有发展成重型乃至危重型的潜在风险,应加以关注,应动态观察心电图变化,如出现症状加重,应完善c Tn、BNP(pro-BNP)等检查,以明确诊断。
治疗基础疾病的长期用药方案原则上不需停用,除非开始服Paxlovid等抗新冠病毒药物(具体见表2药物间相互作用)。
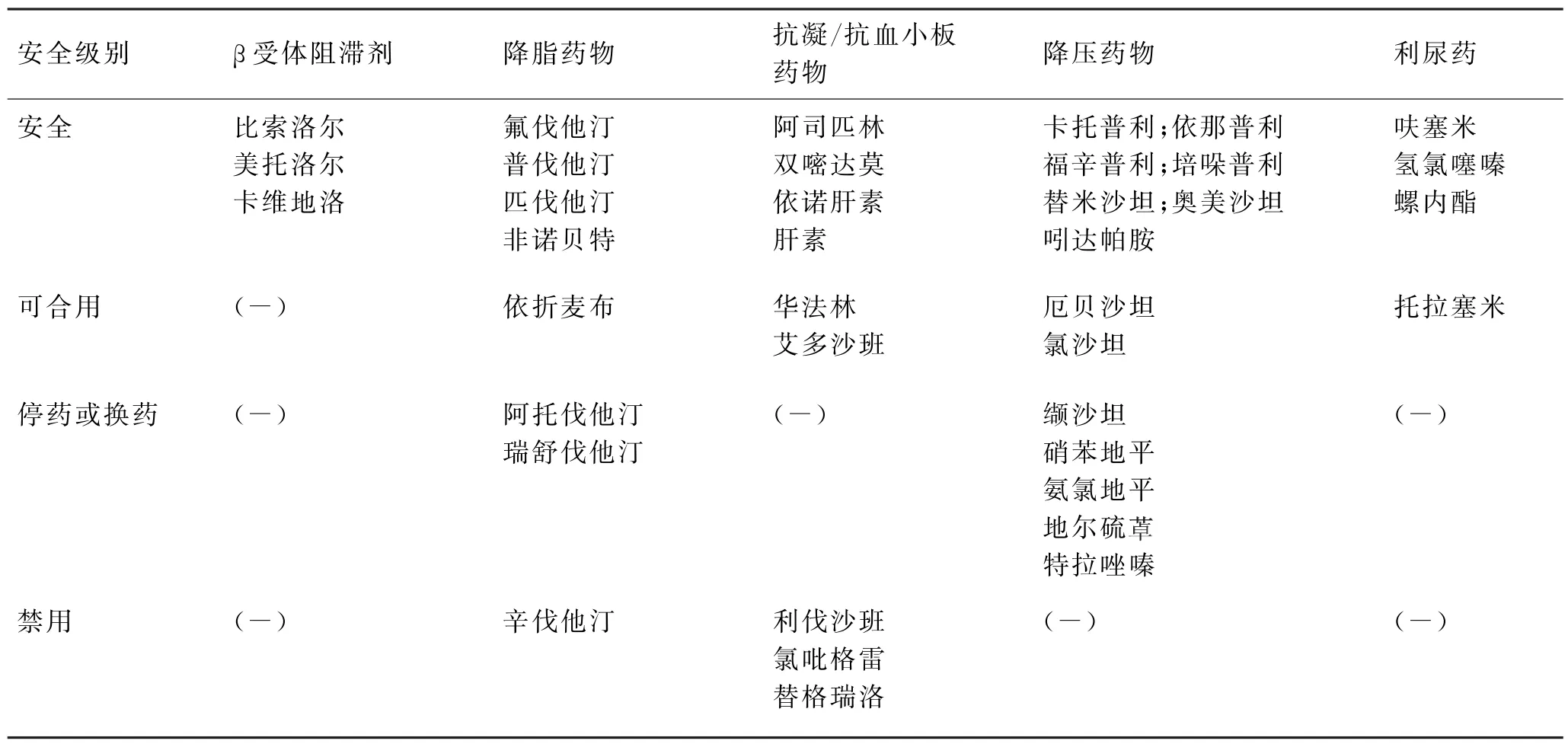
表2 Paxlovid与心血管疾病常用药物的相互作用Tab.2 Interaction between Paxlovid and common drugs for cardiovascular diseases
12 慢性肾脏病(CKD)合并新冠感染及新冠病毒相关急性肾损伤(AKI)
12.1 CKD患者肾功能不全时新冠感染的治疗药物及相关剂量调整
既往患有CKD 或肾移植病史的患者,一旦合并新冠感染,需兼顾肾脏疾病的进展和诊治,并注意药物间相互作用。尤其是Paxlovid与免疫抑制剂存在显著相互作用,从而预期增加环孢素、他克莫司、地塞米松、甲泼尼龙的血药浓度。对使用他克莫司的CKD 患者,口服Paxlovid的第1~5天,要暂停他克莫司;Paxlovid治疗结束后,根据他克莫司血药浓度决定逐步恢复至之前的用量。由于CYP3A 酶恢复的时间不确定,应持续、密切监测他克莫司血药浓度至少2周,并进行个体化剂量调整[31]。
CKD 和维持性透析患者、尤其是维持性血液透析患者是新冠重型/危重型高危人群,抗病毒治疗需争分夺秒,牢牢把握首次核酸阳性的72 h,首选抗病毒小分子药物,防止轻型转向重型。需要注意药物的使用剂量等,具体见表3。
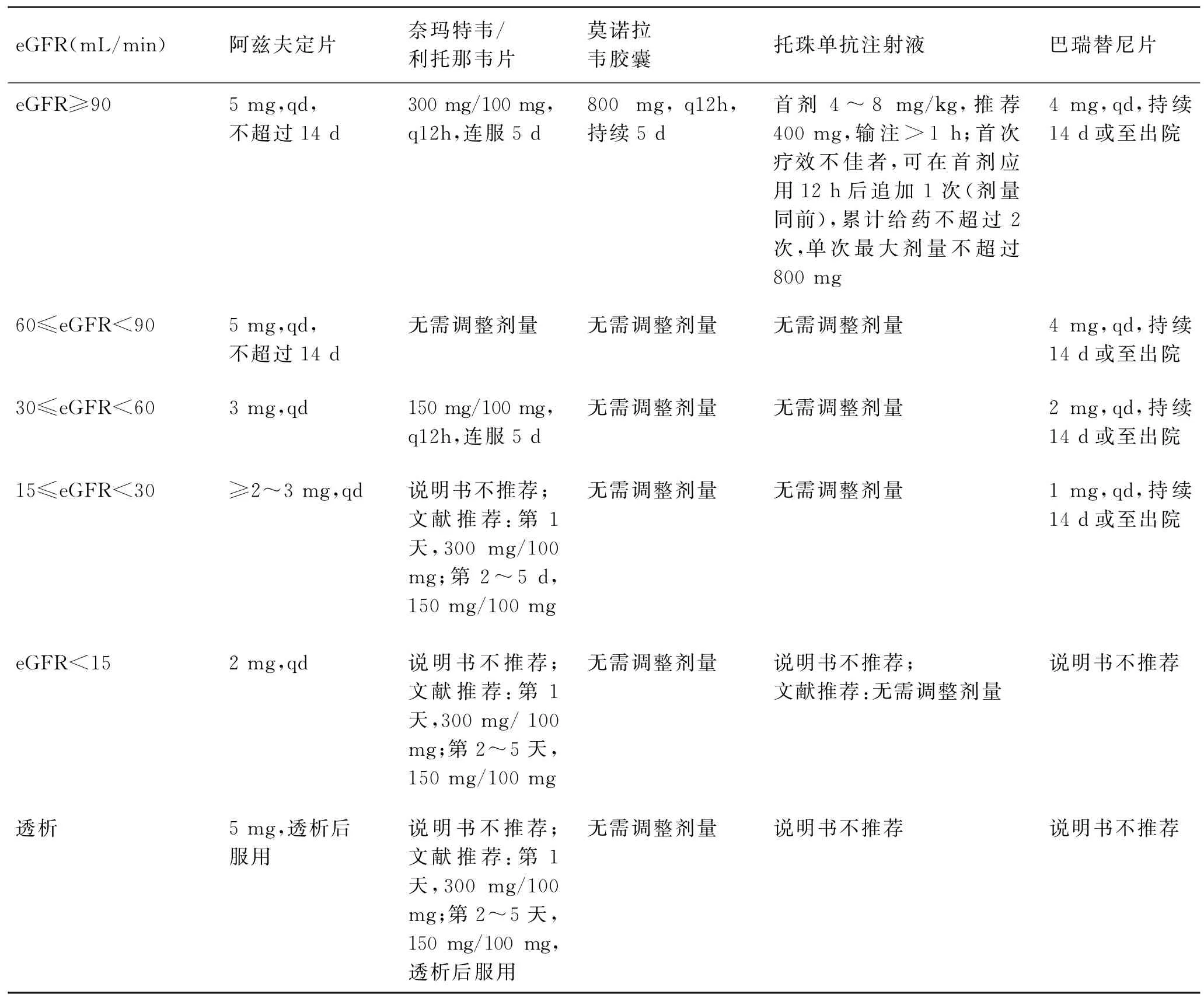
表3 肾功能不全时新冠感染抗病毒治疗药物及剂量调整[32-34]Tab.3 Antiviral drugs and dosage adjustment for treatment of novel coronavirus infection in patients with renal insufficiency
12.2 新冠感染合并AKI
新冠感染合并AKI指患者既往无各种急、慢性肾脏疾病,而在新冠感染时,因各种因素导致肾脏损伤,出现蛋白尿、血尿、尿量减少、血肌酐升高以及肾脏影像学改变等表现的临床综合征,包括因新冠病毒直接介导或免疫激活介导的AKI。
12.2.1 AKI发生的危险因素[35]年龄大于65岁,既往有慢性肾脏病、心衰、肝脏疾病、糖尿病或有急性肾损伤病史;少尿[尿量小于0.5 mL/(kg·h)]、容量不足时使用一些药物,如NSAIDs、ACEI、ARBs、氨基糖苷类抗菌素、碘造影剂等可加速AKI发生和进展。
12.2.2 AKI的发生机制 新冠感染患者发生AKI的机制如下:新冠病毒通过ACE2、DPP4受体直接介导肾脏靶向攻击、免疫激活介导的大量炎症因子释放、病毒侵袭横纹肌引起的肌肉坏死,以及低血压、脱水、低氧血症、电解质紊乱等。肾脏病理主要表现为急性肾小管坏死、急性间质性肾炎、足细胞病/塌陷性FSGS微血管病等。
12.2.3床旁血液净化治疗 ①治疗时机:新冠感染相关AKI 2级及以上、血液透析患者合并新冠感染、腹膜透析患者合并新冠感染重型、全身性炎性反应综合征(SIRS)、多脏器功能衰竭(MODS)、细胞因子风暴综合征(CSS)、急性肺水肿、药物无法控制的高钾血症、无法纠正的代谢性酸中毒、儿童/新生儿液体超负荷(超过10%)。液体超载=(当日体质量-入院时体质量)/入院时体质量×100%。②血液净化技术模式:血浆置换、吸附、灌流、血液/血浆滤过。
12.2.4新冠感染相关AKI的预防 如无明确出血性休克,建议在高危患者或已经发生AKI的患者中首选等张晶体液而非胶体液(白蛋白或淀粉)进行扩容。对围手术期或存在感染性休克的AKI高危患者,建议使用标准化操作管理血流动力学及氧合参数,以避免AKI的发生或加重。在重型患者,推荐使用胰岛素治疗将血糖控制在6.1~8.3 mmol/L。推荐避免利尿剂应用以预防和治疗AKI,除非是为了控制容量过负荷。推荐避免低剂量多巴胺、心房尿钠肽(ANP)或重组人(rh)IGF-1 以预防或治疗AKI。建议避免氨基糖苷类药物治疗感染;如需使用,建议每日单次给药;如每日多次给药,且超过24 h,建议监测血药浓度。如需使用两性霉素,建议使用脂质体两性霉素,而非传统配方。
13 新冠感染的营养支持
13.1 营养治疗的重要性及适用人群
营养治疗是新冠感染后的基础治疗手段之一,应予以重视。新冠感染患者如果出现营养不良,不仅可降低呼吸肌功能,出现呼吸肌无力,还会加重免疫功能障碍,使病情进一步恶化,不利于治疗及预后[36-37]。
启动营养治疗应基于营养诊断。对于生命体征平稳的以下两类患者需积极实施营养支持,有助于更好的临床结局。①有营养风险的患者:入院后24 h内进行营养风险筛查(NRS)2022,初步筛查≥3分;或改良版重症患者营养风险(NUTRIC)评分≥5分。②入院时有严重营养不良的患者:可用2019GLIM量表、SGA、BCA 量表等评估。
13.2 按照五阶梯方法实行营养治疗[38]
一般情况下,若任何原因导致的下一阶段营养摄入不能满足60%目标能量需求,并持续3~5 d以上,选择上一阶梯。①膳食+营养教育:提供软烂、易消化、蛋白质高的营养膳食。②膳食+口服营养补充(ONS):除膳食摄入外,每天400~800 kcal的全营养液口服(整蛋白或短肽型均可),乳清蛋白粉25 g/d。③全肠内营养:25~35 kcal/(kg·d),蛋白1.0~2.0 g/(kg·d),整蛋白与短肽制剂均可;根据患者胃肠道耐受情况,缓慢加量,预防误吸和腹泻。④部分肠内营养 部分肠外营养:补充性给予肠外营养治疗。如胃+肠道无功能,出现肠内营养禁忌证则选择上一阶梯。⑤全肠外营养治疗(TPN):仅用于存在肠内营养禁忌证的患者。
13.3 成人营养治疗方案
①能量:(25~35)kcal/(kg·d)。②液量:病情稳定患者以(30~40)m L/(kg·d),加强观察,避免水过量或不足。③蛋白:肝肾功能正常的患者可按(1.0~2.0)g/(kg·d)[39]给予,将蛋白质在总热能中的供能比由平时的15%提高到25%~30%。TPN 时,热氮比可提高到(100~150)∶1,并提高蛋白质中支链氨基酸的含量,以减少肌肉的分解,增强呼吸肌的力量。④脂肪:外源性补充左旋肉碱,或者优先使用中长链脂肪酸,并且可适当提高N3脂肪酸、N9脂肪酸的比例[39],以抑制炎症反应和提高患者免疫力。⑤碳水化合物:糖脂比(50~70)∶(50~30),热氮比(100~150)∶1。⑥应常规补充多种维生素、矿物质,特别注意维生素B1、维生素C、硒、锌和磷的缺乏。⑦应用免疫营养素应权衡利弊,需严格掌握适应证,不建议常规补充。如精氨酸可以改善胸腺功能,促进伤口愈合,但也可显著升高60岁以上老人及肿瘤患者的CRP值[40]。
13.4 预防再喂养综合征
再喂养综合征是一种致死性的液体和电解质转移,其生化标志是低磷血症,常发生在人工喂养后的几小时到2周之内,可导致严重后果,且临床发生率高,需积极关注。其诱发因素是长期摄入不足患者在短时间内接受高能量(尤其含较高剂量葡萄糖)的肠内营养或肠外营养治疗而导致。故临床应以预防为主。
防治:①识别高危人群。严重营养不良、长期禁食、营养治疗前已存在电解质紊乱和维生素缺乏、体质指数低下、滥用药物史(包括胰岛素、化疗、利尿剂等)的患者。②对已存在重度电解质紊乱(血清磷、镁、钾、钙或钠水平低下) 和维生素缺乏或不足的患者,先给予相应补充和纠正,再开始营养治疗。当血磷水平低于0.32 mmol/L,需立即静脉补充甘油磷酸钠[41]。③小剂量、低浓度起始喂养,避免过快增加热量。④及时监测血糖、电解质等,其中尤为重要的是血磷和维生素B1。此外,临床营养治疗过程中,还需避免误吸风险,根据病情变化及胃肠道耐受情况及时调整治疗方案,使营养治疗顺利进行。
14 新冠感染患者的康复治疗
14.1 住院期间康复指导方案
新冠感染住院患者主要为中型、重型和危重型,核心问题为肺炎导致的氧合异常、呼吸衰竭等。本阶段的康复指导方案如下。
14.1.1自主体位管理 要求患者采取俯卧位通气,每次4 h,每日不少于12 h。对于俯卧位出现明显不适且难以坚持者,可由俯卧位转换为侧卧位或前倾位,当不适缓解后继续采取俯卧位通气(图3)。为了让患者俯卧位坚持更久,俯卧位时可对患者面部、肩颈部、腰背部、四肢及患者感觉不适部位施以按、揉、拿、捏等推拿手法。

图3 推荐体位管理方式Fig.3 Recommended position management
14.1.2呼吸康复治疗 ①背部扣拍:双手空掌交替扣拍患者背部,从外向内、由下向上叩拍,频率约120次/min。②有效咳嗽:有效咳嗽有利于清除痰液;如患者咳嗽效力差,可进行辅助咳嗽训练;如患者咳嗽剧烈,难以忍受,可采用呵气代替咳嗽。③振动排痰:每日治疗2~4次,于餐前或餐后2 h进行,治疗前可进行雾化治疗,治疗后5~10 min进行排痰吸痰,每次治疗时间约20 min。④物理因子治疗:肺部炎症渗出期可采用短波、超短波治疗及磁疗,以促进肺部渗出吸收(治疗强度:无热量;治疗时间:10 min/次)。
14.1.3注意事项 ①定时监测患者血氧饱和度、血压、呼吸频率、心率及其他不适等,糖尿病患者监测血糖变化。②关注患者胃肠道功能耐受情况,如:口咽分泌物量、胃胀、反流、呃逆等,避免误吸。③对于合并慢性阻塞性肺疾病、支气管扩张及囊性纤维化等疾病者,需特别关注痰液引流情况。④制动体位下注意预防深静脉血栓。
14.2 出院康复指导方案
符合出院标准的新冠感染患者,仍可能存在很多不适症状。可针对性采用以下康复干预措施,或者到康复医学科门诊就诊治疗。①呼吸气促:呼吸控制训练、体位改变训练、呼吸操训练、家庭氧疗。②痰液难以咳出:咳嗽训练、叩背训练、呼吸控制、室内湿化、家庭雾化。③乏力疲劳:进行适当的有氧训练和抗阻训练,可增加运动耐力,减轻四肢酸痛感,改善疲劳状态。可进行床上主/被动活动、床边坐起、床边活动、床旁坐站,原地踏步、室内步行、慢走、太极拳、八段锦等。需循序渐进,逐渐增加活动量,运动期间监测血氧饱和度不低于93%。④疼痛:磁疗、温热疗法、手法按摩、激光治疗、红外偏振光。⑤食欲不振:中频脉冲电刺激、磁疗、温热疗法。⑥焦虑、抑郁及睡眠障碍:重复经颅磁刺激治疗或专科就诊口服相应药物治疗。⑦嗅觉和味觉下降:嗅、味觉训练。⑧咽干咽痛:五官科超短波治疗。
15 新冠感染的中医诊疗推荐
15.1 新冠感染的症状及病因病机
主要表现为发热、全身疼痛、咽喉疼痛、饮食无味、口苦咽干、恶心腹泻、干咳咽痒、多汗乏力、胸闷、心慌气短、头晕鼻塞等。中医病因主要为寒湿裹挟戾气,病机总体为寒湿包火,即外有风寒湿内有蕴热毒[42-43]。
15.2 处理
预防可用正气散合剂(生黄芪50 g,防风15 g,炒白术20 g,桔梗10 g,桂枝15 g,五味子15 g,炙甘草10 g,水煎服,150 m L,2次/d)。新冠感染人群恢复期可用益气宁心合剂(西洋参15 g,麦冬30 g,五味子15 g,黄芪20 g,白术20 g,鸡内金20 g,炙甘草10 g,柴胡10 g,大枣7枚,水煎服,150 m L,2次/d)。
针对主要症状进行对症治疗:①发热、全身疼痛(恶寒发热、头痛无汗,肢体酸楚疼痛,口苦、微渴,舌苔白或微黄),可用九味羌活丸6 g(大蜜丸2丸)+生姜3~6片+葱白3~6段(2 cm/段),煮水300~500 m L,温服,覆薄被,微汗出即可,2次/d。②咽喉疼痛:金花清感颗粒6 g(1袋,3次/d)、银翘解毒丸3 g(大蜜丸1丸/次,3 次/d;小丸10 丸,3 次/d)。③饮食无味、口苦、恶心干呕:小柴胡颗粒10 g(2袋,3次/d)。④干咳无痰,口干咽干:养阴清肺丸10 g(大蜜丸1丸,3次/d)或川贝枇杷膏(10 m L,3次/d)或玄麦甘桔颗粒10 g(1袋,3次/d)。⑤咳嗽、咳黄痰:复方鲜竹沥液(10 mL,3次/d)或鱼腥草合剂(10 mL,3次/d)。⑥多汗乏力:玉屏风散颗粒10 g(自汗,体虚出汗,2袋,3 次/d);虚汗停颗粒10 g(夜间多汗,2 袋,3次/d)。⑦胸闷、心慌、气短:生脉饮(10 mL,3次/d)+稳心颗粒5 g(1袋,3次/d)。⑧头晕鼻塞、流清涕:川芎茶调丸7.5 g(水丸20 丸,2 次/d,淡绿茶水冲服)。⑨心悸、失眠、焦虑:心速宁胶囊1.92 g(舌质红,苔黄,痰热内扰证,4粒,3次/d);枣仁安神口服液(舌质淡红,苔白,心血不足证,10 m L,1 次/晚)。○10恶心呕吐伴有肠鸣泄泻:霍香正气丸6 g(水丸15丸,3次/d)。背部冷痛、腰骶部酸痛:附子理中丸2.75 g(水丸10粒,3次/d)+金匮肾气丸5 g(水蜜丸25粒,3次/d)。
特殊情况:以上所有中药及中成药的推荐剂量均为成人使用剂量;孕妇以及儿童应咨询专业中医师后用药;中成药中含有蔗糖、蜜等辅料的药品,糖尿病患者应慎用。
16 吸入糖皮质激素的应用
对吸入糖皮质激素治疗新冠感染,目前《新冠病毒感染诊疗方案(试行第十版)》并没有给出具体推荐意见,仅在免疫治疗中提到对于氧合指标进行性恶化、影像学进展迅速、机体炎症反应过度激活状态的重型和危重型病例,酌情短期内使用全身糖皮质激素。在此种情况下吸入糖皮质激素不能替代全身糖皮质激素。
美国国立卫生研究院(NIH)新冠病毒感染治疗指南中,对于不需要吸氧的住院患者(中型患者),反对使用地塞米松或其他系统性糖皮质激素。而目前尚缺少足够的研究证据支持或反对使用吸入性糖皮质激素治疗新冠感染。STOIC研究纳入146例轻型新冠感染患者,结果提示吸入布地奈德(800μgbid)可降低轻型患者急诊就医率或住院率[44];PRINCIPLE 研究纳入2 530名65岁以上或50岁以上有并发症的轻型新冠感染患者,结果提示吸入布地奈德(800μg bid)不能降低患者28 d的住院率和死亡率,但可缩短自我报告的恢复时间[45]。这提示新冠感染的轻型患者早期使用吸入糖皮质激素可预防患者发展成重型。
新冠感染患者恢复期大多会有较剧烈的干咳,或者咳嗽伴有喘息、气憋、胸闷等临床表现,胸部影像学正常,而又无法用当前或其他疾病解释,考虑可能是新冠感染引起的感染后咳嗽。其可能的发病机制如下:①气道炎症及气道高反应性:新冠病毒侵犯气道黏膜导致广泛的气道炎症、上/下呼吸道上皮损伤,同时有研究发现新冠感染诱发的神经源性炎症也可能参与了气道高反应性的发生发展;②黏液高分泌:黏液分泌的刺激以及咳嗽受体高敏感性。其中,气道炎症是患者气道高反应性增加的核心发病机制,考虑使用吸入糖皮质激素可能会有部分患者获益。由于目前缺乏高级别循证医学证据,建议权衡获益及风险后酌情使用。
17 新冠反弹的处理和鉴别
17.1 定义及机制
2022年5月,美国CDC定义Paxlovid治疗后新冠反弹,是指经实验室确认的新冠感染患者在完成为期5 d的Paxlovid治疗疗程后已经康复,在2~8 d后再次出现新冠的症状和/或新冠检验阳性。新冠反弹并非Paxlovid治疗后独有。一项未经同行审议的研究表明,Paxlovid和Molnupiravir的新冠反弹风险并无统计学差异[46]。而在未服用抗病毒药物时,超过10%的感染人群也会出现病毒水平反弹[47]。因此,定义新冠反弹不再强调是否经过抗病毒治疗,只要在新冠感染康复2~8 d后再次出现新冠感染的症状和/或新冠检验阳性,均属于新冠反弹。其包含3种可能:有病毒但无症状、有症状但没有病毒、既有病毒又有症状。
新冠反弹的具体机制尚在研究中。已有研究表明,病毒耐药性、体液免疫不足、细胞免疫不足都不是Paxlovid治疗后新冠反弹的可能原因[48]。整体来说,有基础疾病的新冠感染患者的新冠反弹率高于无基础疾病的感染者[46]。有研究者推测新冠反弹更有可能是由于个体药代动力学差异或者药物治疗时间不足所导致的药物暴露剂量不足[48],也可能是新冠感染的自然进程本就存在着消长的情况,因此,其恢复并不是线性的[49]。
17.2 鉴别
①新冠反弹与复阳、长新冠、二次感染的鉴别:复阳属于新冠反弹的一种,而新冠反弹不仅包括复阳,还包括症状反弹,但其症状反弹有时间间隔(2~8 d后),因此可与长新冠相区分。新冠反弹也并非二次感染,二次感染是一次新的感染,通常有症状,有传染性,且往往与上次感染间隔1月以上甚至3~6月,而新冠反弹定义在28~30 d内更为合理。②新冠反弹与其他病原体感染的鉴别:如出现新冠症状和/或影像反弹,复查新冠抗原和核酸阴性,或新冠抗原和核酸虽阳性,但病情演变不能用单纯的新冠感染解释时,需警惕继发或重叠其他病毒如流感、腺病毒、EB病毒、巨细胞病毒等感染,或病毒以外其他病原体如细菌、支原体等感染。尤其冬春季节是流感高发季节,需警惕新冠感染与流感的双重感染或先后继发感染。③警惕新冠感染介导的自身免疫性疾病:研究表明,病毒感染在自身免疫性疾病且具有遗传易感性的个体中发挥了重要作用,被认为是自身免疫性疾病的环境触发因素,新冠病毒也不例外。新冠感染与自身免疫性疾病发病机制有相似性,主要表现在天然免疫细胞数量增加,适应性免疫细胞的失调,细胞因子水平升高,自身抗体(如抗ANA、抗Ro/SSA 抗体等)出现[50]。目前已有文献报道,新冠感染引发的成人新发自身免疫性疾病包括系统性红斑狼疮、免疫性血小板减少症、自身免疫性溶血性贫血、自身免疫性脑炎和自身免疫性甲状腺疾病等。但是大多数研究结果仅在文献中作为病例报告发表,未来需进一步评估这一现象的具体含义。
17.3 处理
一旦出现新冠症状反弹和/或影像反弹,需要住院的患者首先需要复查新冠抗原和新冠核酸(如有条件还可开展新冠病毒分离及培养),复查血常规、降钙素原、CRP、IL-6 等感染性指标,必要时还需完善甲流、乙流筛查及巨细胞、EB 病毒等相关检查,行痰病原学检查,病情需要且病情允许时行支气管镜检查及BALF-m NGS。针对新冠感染后反复发热、单纯感染不能解释的患者,还应完善自身抗体全套、抗中性粒细胞抗体、风湿系列、体液免疫全套、肌炎谱等检查,必要时还应请风湿免疫科及相关多学科会诊。
如为明确的新冠反弹,大多对症处理或观察即可,对极少数需要住院的患者,建议按《新型冠状病毒感染诊疗方案(试行第十版)》或参考本推荐意见,再次进行准确的临床分型,并制定规范化、个体化的治疗方案。如初治未给予抗病毒治疗,应尽早启用抗病毒药物,并提高患者服药依从性以保证药物暴露剂量充足;如初治已给予抗病毒治疗,应考虑抗病毒治疗后的新冠反弹,是否再启用新一疗程的抗病毒治疗或换用其他药物抗病毒,尚无定论,需要结合患者核酸Ct值、病情进展速度及肝肾功能综合考虑。
如初治未给予激素治疗,氧合指标进行性恶化、影像学进展迅速、机体炎症反应激活(如IL-6、D-二聚体显著升高)等情况下规范应用激素;如初治已给予激素治疗,应评估患者免疫状况及炎症情况,排查继发二重感染,甄别新冠肺炎机化,必要时根据初治激素的用量和疗程酌情追加使用。其他免疫治疗应权衡利弊,严格把握指征,慎重应用。
18 新冠感染后间质性肺病
18.1 概述及发生机制
重型及危重型新冠感染如未得到及时有效的治疗,肺部病变经过损伤、修复,逐渐进入纤维化阶段,即新冠感染后的间质性肺病,其影像特征一般包括网格影、实质条带、牵拉性支气管扩张、小叶间隔增厚、蜂窝影等。
目前新冠感染后肺纤维化的机制仍不完全清楚,考虑可能与以下因素有关:①病毒造成直接肺损伤,激活异常的损伤修复,导致肺纤维化;②病毒造成免疫介导的肺损伤,激活免疫细胞,分泌大量促炎、促纤维化因子,包括TGF-β和IL-6等,随着成纤维细胞向肌成纤维细胞的募集和分化,伤口愈合反应异常,导致细胞外基质在间质中沉积过多,气体交换受损,肺微结构破坏,最终导致纤维化。
18.2 处理
新冠感染后间质性肺病在影像学上可表现为双肺间质性炎症,大约30%~60%的患者出现不同程度的肺间质改变[51-52]。部分间质病变随着时间的推移有改善趋势,但仍有部分患者在动态随访期间,出现纤维化逐渐加重趋势,可伴有肺功能恶化,此时需要酌情考虑抗纤维化治疗。
1)抗炎治疗:糖皮质激素可用于新冠感染后的间质性肺病,特别是肺部影像学以机化性肺炎(organizing pneumonia,OP)或非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP)为主要表现的患者,起始治疗剂量为醋酸泼尼松0.3~0.4 mg/kg或其等效剂量,或醋酸泼尼松20~30 mg/d×2周,2周后减量至10~15 mg/d维持,持续时间不超过6周[53-54]。针对部分患者在修复期出现明显肺间质病变,或影像学表现肺间质病变较急性期进展,特别是血清炎性指标升高,影像学主要表现为OP 或NSIP的患者,使用糖皮质激素的指征、疗程可适当放宽[55]。
研究显示,新冠感染后间质性肺病患者短期接受中、小剂量糖皮质激素治疗,可改善肺功能及纤维化程度。然而,目前有关糖皮质激素应用剂量及疗程的高质量临床研究相对较少,具体应用时机、剂量、疗程、药物类型、目标患者的选择及长期预后仍需进一步随机对照试验确定。同时,使用糖皮质激素治疗,还应兼顾其副作用和禁忌证,需监测血糖、血压等。
2)抗氧化治疗:氧化应激在肺损伤修复中发挥重要作用。研究表明,口服乙酰半胱氨酸600 mg 3次/d,可改善患者肺纤维化,但目前尚缺少前瞻性随机对照临床研究。另外,冬虫夏草制剂也有一定的抗氧化抗纤维化作用,临床也可进一步探索其疗效。
3)抗纤维化:新冠感染的肺损伤修复与间质性肺病有相似的细胞因子谱,因此,用于治疗特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)的药物也可能有益于新冠肺炎患者。有研究探索吡非尼酮治疗重症新冠感染,结果虽未显示能改善纤维化的作用,但可降低重症新冠感染患者的炎症因子水平,降低D-二聚体水平,提示其潜在的抗炎作用及在抗纤维化中的潜在应用价值[56]。尼达尼布能够抑制促纤维化信号转导,减弱成纤维细胞的增殖、迁移和分化以及细胞外基质成分分泌。有研究探索尼达尼布作为新冠感染后肺纤维化的附加治疗,结果显示其未能改善影像检查结果或60 d死亡率,但可改善重症新冠感染患者的氧合指数[57],且需更大样本进一步验证。
4)肺移植:肺移植是新冠感染导致的严重肺损伤和广泛肺纤维化患者的最终选择。但同时受多种因素限制,包括移植的同种异体肺中新冠感染的复发、病毒导致的患者肺部损伤造成的手术困难,以及同种异体肺被致病微生物感染的风险。因此,新冠感染后的肺移植需充分评估,以提高成功率。
5)肺康复治疗:患者住院期间,可予以康复治疗,包括呼吸操、肺廓清、运动训练、上肢训练、柔韧性训练、神经肌肉电刺激疗法、呼吸功能训练等。
患者出院后应定期进行胸部高分辨CT(high resolution CT,HRCT)和肺功能检查,尤其是出院时肺部阴影未完全吸收者,常规随访时间建议为出院后第1、4、10个月,之后是否随访则取决于患者的胸部影像学吸收情况,如果发展为不可逆纤维化阶段,则应按照肺间质病诊疗常规,3~6个月随访1次[55]。对于患者的心理状况也需要进行评估,必要时予以干预。
总之,本推荐意见在卫健委的第十版《新型冠状病毒感染诊疗方案(试行版)》的基础上,结合西安交通大学第二附属医院多学科专家的临床救治经验,针对新冠感染临床诊疗中存在的多个热点问题,详细梳理和解读,以期为新冠感染患者的救治提供相关参考。

