利用CRISPR/Cas9基因编辑技术创建水稻OsPUX2突变体
高上 满淼淼 赵华 张丽娜 王加峰


摘要 [目的]U-box蛋白是一类决定靶标蛋白特异性的E3泛素连接酶(少部分属于泛素链聚集因子-E4),在植物抗病、抗逆和生长发育各阶段都发挥着重要作用。为揭示U-box蛋白家族基因OsPUX2在水稻防御反应中的具体生物学功能,利用CRISPR/Cas9编辑技术对OsPUX2基因进行编辑。[方法]在OsPUX2第1外显子设计1个20 bp的编辑靶点,构建了OsPUX2基因敲除载体pRGEB32-OsPUX2-gRNA载体,并通过农杆菌介导的转化方法侵染水稻Pik-H4 NIL愈伤组织,经潮霉素检测获得转基因阳性植株,并对T0代转基因植株进行靶点区域序列进行PCR和测序分析,分析ospux2的突变类型。[结果]成功获得了ospux2的敲除突变体材料,对突变类型的分析发现,转基因编辑后代共存在7种突变类型,以缺失突变为主,其中一种纯合突变类型在OsPUX2第一个外显子的第115号碱基处缺失了一个C碱基,导致蛋白的翻译在第84个氨基酸处提前终止。[结论]该研究获得ospux2突变株系对进一步研究该基因的功能具有重要意义。
关键词 水稻;U-box;OsPUX2;CRISPR/Cas9;基因编辑
中图分类号 S511 文献标识码 A 文章编号 0517-6611(2023)09-0073-04
doi:10.3969/j.issn.0517-6611.2023.09.018
Abstract [Objective]Ubox proteins are a class of E3 ubiquitin ligases that determine the specificity of target proteins, play an important role in plant disease resistance, stress resistance and all stages of growth and development. In order to reveal the specific biological function of the Ubox protein family gene OsPUX2 in rice defense response, the OsPUX2 gene was edited by CRISPR/Cas9 editing technology. [Method]A 20-bp editing target was designed in the first exon of OsPUX2 and the pRGEB32OsPUX2gRNA vector was constructed. Rice PikH4 NIL callus was infected by Agrobacteriummediated transformation and tested with hygromycin. The T0 generation transgenic plants were subjected to PCR and sequencing analysis of the target region sequence to analyze the mutation type of ospux2. [Result]The knockout mutant of ospux2 was successfully obtained. There were a total of 7 mutation types in the transgenic edited progeny, which are mainly deletion mutations. One of the homozygous mutation types with a C base deletion at the +115 bp of the first exon of OsPUX2 gene leads to termination of protein translation at 84 aa. [Conclusion]The ospux2 mutant strain obtained in this study is of great significance to further study the function of this gene.
Key words Rice;Ubox;OsPUX2;CRISPR/Cas9;Gene editing
基金項目 2021年省级乡村振兴战略专项经费(2021KJ382);农业农村部华南现代生物种业重点实验室(2105-000000-20-03-457451)。
作者简介 高上(1999—),男,河南郑州人,硕士研究生,研究方向:水稻抗性。*通信作者,副研究员,博士,从事水稻病害研究。
泛素-蛋白酶体系统是细胞内蛋白质降解的重要途径之一,参与生物体内绝大多数的生理活动,通过降解靶蛋白水平调控植物体的生长发育过程及其对生物胁迫和非生物胁迫的响应[1-2]。泛素-蛋白酶体系降解途径由泛素活化酶E1、泛素结合酶E2、泛素连接酶E3及26S蛋白酶体组成,其中E1负责激活泛素,E2直接将泛素转移到底物蛋白质,或者同泛素一起转移给E3连接酶,形成被蛋白酶体识别的底物后被降解[3]。泛素分子对靶蛋白的特异性识别主要依赖于E3泛素连接酶,E3是一个大的、多样化的蛋白群,根据基序的不同,可分为4类:HECT结构域、U-box结构域、RING-finger结构域、Cullin-RING结构域[4-5]。其中U-box蛋白质广泛存在于酵母到人类的大量真核生物中[6]。据报道,植物中U-box蛋白质在抵抗生物胁迫与非生物胁迫过程中发挥重要作用[3],迄今为止,大部分水稻U-box蛋白质的功能及其作用机制尚不清楚,通过利用基因编辑技术对靶基因OsPUX2进行定点编辑,为解析该类蛋白质在植物抗病抗逆方面的功能具有重要意义。
目前已经有大量U-box蛋白质参与抗病抗逆过程的报道,如在植物抗病反应中起负调控作用的AtSPL11、AtPUB12/AtPUB13[7-9]及在植物抗病中发挥着正调控作用的CMPG1、AtPUB17等[10-11]。水稻OsPUB44正调控水稻PTI及其对白叶枯病的抗性[12]。AtPUB22和AtPUB23能够协同负调控植物的干旱胁迫反应,而AtPUB30蛋白能调控植物耐盐作用[13]。此外,水稻OsPUB15能够降低活性氧暴发,从而正调控盐胁迫反应[14]。AtPUX1对于清除无功能的AtCDC48具有重要作用,可介导多种细胞活动,包括内质网和高尔基体膜的同型融合、内质网相关蛋白降解、细胞周期进程和细胞凋亡[15]。虽然大量U-box蛋白参与调控植物各种生理活动被研究报道,植物许多U-box蛋白的功能及其作用机制研究也取得了较大进展,但仍缺乏系统深入研究。水稻中OsPUX2与AtPUX2亲缘关系较近,但其具体功能尚不清楚。
CRISPR/Cas9技术作为一种高效的基因编辑工具,已经被广泛应用于水稻、小麦、玉米、番茄等农作物中,实现对不同靶基因的定向编辑,在分子育种方面也显示了巨大的应用潜力[16-18]。CRISPR/Cas9介导的基因编辑是由gRNA与Cas9蛋白组成复合物实现的,gRNA负责定位与其有互补关系的DNA双链,Cas9核酸酶负责切割DNA双链产生双链断裂(Double strand breaking,DSB),经非同源末端连接修复(nonhomologous endjoining,NHEJ)后,产生一系列插入、缺失及碱基替换突变,从而创造出一系列的突变体,以便于进行基因功能的研究。由于CRISPR/Cas9 技术操作简单,效率较高,目前已被广泛应用于各类生物基因功能研究中[19]。
笔者利用CRISPR/Cas9基因编辑技术定點编辑水稻OsPUX2基因,构建水稻OsPUX2的突变体材料,以期为后续开展OsPUX2参与的具体调控通路的功能解析奠定重要的材料基础。
1 材料与方法
1.1 试验材料
以粳稻Pik-H4 NIL为受体材料。 Cas9-gRNA表达载体pRGEB32购自Addgene。大肠杆菌(Escherichia coli)DH5α、根癌农杆菌(Agrobacterium tumefaciens)EHA105由本实验室保存。
1.2 靶点的选择及gRNA设计
利用CRISPR/Cas9靶位点在线设计平台(http://skl.scau.edu.cn/)[20]设计OsPUX2编辑靶点,查找符合GN19NGG的序列。其中,GN19为20个碱基的靶点序列,NGG(N表示任意碱基)为识别靶序列的原初间隔序列毗邻基序(Protospacer adjacent motif,PAM)。优选靶位点位于编码序列5′端,与潜在脱靶位点的差异在3个碱基以上,以保证编辑的特异性。选择第1外显子设计1个20 bp的编辑靶点,设计2条互补靶点引物OsPUX2-E1gRNAF与OsPUX2-E1gRNAR,其靶点引物序列分别为TGCAGATGATCCGTGGCAAGATGCCAAGGGGACTCGCCGTTTTAGAGCTAGAAATAG(5′—3′)和CTATTTCTAGCTCTAAAACGGCGAGTCCCCTTGGCATCTTGCCACGGATCATCTGCA(5′—3′)。靶位点的特异性通过水稻全基因组BLAST分析进行比对。
1.3 CRISPR/Cas9表达载体构建
首先将Cas9蛋白表达载体pRGEB32用BsaI进行单酶切,凝胶回收载体片段,将2条互补靶点引物OsPUX2-E1gRNAF与OsPUX2-E1gRNAR进行退火反应,将其与凝胶回收的pRGEB32载体片段利用重组酶进行重组连接反应(反应体系:4 μL 5×CE Ⅱ Buffer、2 μL Exnase Ⅱ、0.03 pmol pRGEB32、0.06 pmol 插入片段,补ddH2O至20 μL;37 ℃ 30 min),将连接产物转化大肠杆菌DH5α后对靶点序列利用U3gRNA-F与UBI-R(表2)进行菌落PCR鉴定,并进行测序分析,取测序正确的重组质粒转化农杆菌EHA105感受态,并侵染转化Pik-H4 NIL愈伤组织,经潮霉素筛选获得再生T0代植株。用CTAB法提取植株叶片基因组DNA,利用OsPUX2-kotest-F与OsPUX2-kotest-R(表2)对靶位点区域DNA片段进行PCR扩增(产物约408 bp)鉴定突变类型。引物U3gRNA-F、UBI-R、OsPUX2-kotest-F、OsPUX2-kotest-R 的碱基序列分别为GTTGGAAACCACGTGATGT(5′—3′)、ACTGTAATTTCTTCTGGCTGG(5′—3′)、ACAACAGGCAAATCAGGAGC(5′—3′)、GGAACGACAAGTACAGGAAGG(5′—3′)。
2 结果与分析
2.1 gRNA靶点选择和序列设计
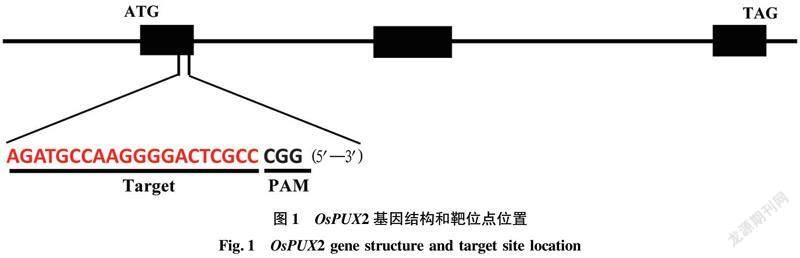
OsPUX2含有3个外显子,CDS含有615个碱基,编码205个氨基酸(aa),UBX结构域位于OsPUX2的C端区域(121~205 aa)。为完全破坏OsPUX2基因的功能,利用CRISPR/Cas9靶位点在线设计平台(http://skl.scau.edu.cn/)在OsPUX2第1个外显子区域选择一个靶点(5′—AGATGCCAAGGGGACTCGCC CGG—3′)进行定点编辑,靶位点位于编码区+98到+118处(图 1)。将设计的靶位点序列进行BLAST比对分析,证明其具有较好的特异性。
2.2 OsPUX2基因的CRISPR/Cas9表达载体构建
首先凝胶回收BsaI酶切后的pRGEB32载体片段,将2条互补靶点引物OsPUX2-E1gRNAF与OsPUX2-E1gRNAR退火后直接将其与BsaI酶切后的pRGEB32载体片段利用重组酶进行重组连接反应,重组产物热激转化后,挑取单克隆用引物U3gRNA-F、UBI-R进行菌落PCR扩增,得到500 bp的目的条带(图2)。对阳性菌落质粒利用U3gRNA-F进行测序,结果表明OsPUX2基因的1个靶点序列克隆至pRGEB32载体,成功获得pRGEB32-OsPUX2-gRNA的表达载体,可以进行后续转基因试验。
2.3 OsPUX2基因的CRISPR/Cas9轉基因植株鉴定
pRGEB32-OsPUX2-gRNA的表达载体转入农杆菌EHA105中,利用农杆菌介导法将表达载体转入水稻材料Pik-H4 NIL愈伤组织中,经过加有潮霉素的培养基筛选后,将阳性愈伤组织转入分化培养基;进一步生根培养得到T0代OsPUX2基因的CRISPR/Cas9转基因植株。最终获得20个潮霉素阳性转基因植株(图3)。
2.4 编辑突变体的突变类型分析
首先利用引物(OsPUX2-kotest-F与OsPUX2-kotest-R)对潮霉素基因检测为阳性的植株OsPUX2编辑靶点区域DNA片段进行扩增。电泳结果表明,所有的CRISPR/Cas9编辑突变体都能扩增出408 bp左右的目的条带(图4)。对相应突变体靶位点区域的DNA片段进行测序,并以野生型序列作为参考,对OsPUX2转基因株系中各靶位点序列进行比较,并利用解码网站(http:∥skl.scau.edu.cn/dsdecode/)对全部转基因植株进行序列分析。结果表明(图5),ospux2的突变频率高达85%,共存在7种突变类型,多为剪切位点处产生的碱基缺失突变,分别有-1、-2、-4、-5、-23、-23及-2/+1(缺失/插入)类型,分别占编辑类型总数的51.7%、10.3%、10.3%、13.7%、3.4%、6.9%和3.4%,其中,单碱基缺失占比最高。进一步分析发现,含有单碱基缺失(CDS中115号碱基C缺失)的突变体有6个转基因株系均为纯合缺失突变(ospux2-1、ospux2-2、ospux2-11、ospux2-19、ospux2-21和ospux2-25),该碱基缺失导致该蛋白的翻译在第84个氨基酸处提前终止。综上分析可以发现,成功实现了对OsPUX2基因的定点编辑,并获得了6株含有1个碱基的纯合突变株系,而杂合突变株系需要在T1、T2代继续与测序进行比较分析。
3 讨论
CRISPR/Cas9是一项比TALEN和ZFN技术优势更强的基因编辑技术,能够精确地对植物基因组的靶标部位进行编辑,具有较高的特异性和编辑效率。CRISPR/Cas9技术的出现为植物基因工程研究提供了新工具,也极大推动了植物中复杂调控网络的解析与遗传育种研究。
U-box蛋白质多参与植物的生长发育、生物胁迫与非生物胁迫过程的调控[9,12-13]。前期研究发现,OsPUX2基因可能参与对稻瘟病抗性的调控,经分析发现,OsPUX2基因与拟南芥的AtPUX2同源性高,但具体的功能仍不清楚。为进一步研究OsPUX2基因在抗病途径中的功能,该研究利用单靶点gRNA对水稻的OsPUX2基因进行了定点编辑,获得了一系列不同缺失类型的ospux2突变体,ospux2的突变频率高达85%,其中,ospux2单碱基缺失突变类型占51.7%,该碱基(115号碱基C)缺失导致蛋白翻译提前终止,突变株系中有6株含有该种类型的纯合突变。其他类型的突变包括多碱基缺失及插入株系都处于杂合状态,需要在T1代或T2代予以分离出来,这些类型的突变中除3碱基缺失会造成整码突变外,其他多造成蛋白翻译的提前终止。以上功能缺失型突变体的获得为进一步研究OsPUX2基因的功能提供了重要的遗传材料。
参考文献
[1] SADANANDOM A,BAILEY M,EWAN R,et al.The ubiquitinproteasome system:Central modifier of plant signalling[J].New Phytol,2012,196(1):13-28.
[2] FURNISS J J,GREY H,WANG Z S,et al.Proteasomeassociated HECTtype ubiquitin ligase activity is required for plant immunity[J].PLoS Pathog,2018,14(11):1-22.
[3] STONE S L.The role of ubiquitin and the 26S proteasome in plant abiotic stress signaling[J].Front Plant Sci,2014,5:1-10.
[4] ARAVIND L,KOONIN E V.The U box is a modified RING fingera common domain in ubiquitination [J].Curr Biol,2000,10(4):R132-R134.
[5] HATAKEYAMA S,YADA M,MATSUMOTO M,et al.U box proteins as a new family of ubiquitinprotein ligases[J].J Biol Chem,2001,276(35):33111-33120.
[6] ZHANG Z Y,LI J H,LIU H H,et al.Roles of ubiquitinationmediated protein degradation in plant responses to abiotic stresses[J].Environ Exp Bot,2015,114:92-103.
[7] SHIRSEKAR G S,VEGASANCHEZ M E,BORDEOS A,et al.Identification and characterization of suppressor mutants of spl11mediated cell death in rice[J].Mol Plant Microbe Interact,2014,27(6):528-536.
[8] LIU J L,LI W,NING Y S,et al.The UBox E3 ligase SPL11/PUB13 is a convergence point of defense and flowering signaling in plants[J].Plant Physiol,2012,160(1):28-37.
[9] LIU J L,PARK C H,HE F,et al.The RhoGAP SPIN6 associates with SPL11 and OsRac1 and negatively regulates programmed cell death and innate immunity in rice[J].PLoS Pathog,2015,11(2):1-23.
[10] YANG C W,GONZLEZLAMOTHE R,EWAN R A,et al.The E3 ubiquitin ligase activity of Arabidopsis PLANT UBOX17 and its functional tobacco homolog ACRE276 are required for cell death and defense[J].Plant Cell,2006,18(4):1084-1098.
[11] GONZLEZLAMOTHE R,TSITSIGIANNIS D I,LUDWIG A A,et al.The Ubox protein CMPG1 is required for efficient activation of defense mechanisms triggered by multiple resistance genes in tobacco and tomato[J].Plant Cell,2006,18(4):1067-1083.
[12] ISHIKAWA K,YAMAGUCHI K,SAKAMOTO K,et al.Bacterial effector modulation of host E3 ligase activity suppresses PAMPtriggered immunity in rice[J].Nat Commun,2014,5:1-11.
[13] SEO D H,RYU M Y,JAMMES F,et al.Roles of four Arabidopsis Ubox E3 ubiquitin ligases in negative regulation of abscisic acidmediated drought stress responses[J].Plant Physiol,2012,160(1):556-568.
[14] PARK J J,YI J,YOON J,et al.OsPUB15,an E3 ubiquitin ligase,functions to reduce cellular oxidative stress during seedling establishment[J].Plant J,2011,65(2):194-205.
[15] PARK S,RANCOUR D M,BEDNAREK S Y.Protein domaindomain interactions and requirements for the negative regulation of Arabidopsis CDC48/p97 by the plant ubiquitin regulatory X(UBX)domaincontaining protein,PUX1[J].J Biol Chem,2007,282(8):5217-5224.
[16] CHILCOAT D,LIU Z B,SANDER J.Use of CRISPR/Cas9 for crop improvement in maize and soybean[J].Prog Mol Biol Transl Sci,2017,149:27-46.
[17] CHEN K L,WANG Y P,ZHANG R,et al.CRISPR/Cas genome editing and precision plant breeding in agriculture[J].Annu Rev Plant Biol,2019,70:667-697.
[18] CAO H X,WANG W Q,LE H T,et al.The power of CRISPRCas9induced genome editing to speed up plant breeding[J].Int J Genomics,2016,2016:1-11.
[19] 劉耀光,李构思,张雅玲,等.CRISPR/Cas植物基因组编辑技术研究进展[J].华南农业大学学报,2019,40(5):38-49.
[20] 曾栋昌,马兴亮,谢先荣,等.植物CRISPR/Cas9多基因编辑载体构建和突变分析的操作方法[J].中国科学:生命科学,2018,48(7):783-794.

