3种中药在体外对PEDV的抑制作用
单雪芹 凡玉芳 沈咏舟 王亚男 韩国祥



摘要 [目的]筛选抗猪流行性腹泻病毒(PEDV)的有效中药单体及其作用节点。[方法]选择3种中药单体进行体外抗病毒试验,通过对病毒3个节点(抑制吸附穿入、直接杀灭、抑制复制)进行药物作用,评价CCK-8法、间接免疫荧光法和Western blot的对抗病毒效果。[结果]黄芩苷和水飞蓟在病毒吸附和穿入阶段抗病毒效果好,而诃子抗病毒效果较差;CCK-8测试显示,黄芩苷和水飞蓟最大抑制率分别为82.34%和78.00%,间接免疫荧光和Western blot进一步验证黄芩苷和水飞蓟能降低绿色荧光强度及抑制病毒N蛋白的表达,且2种药物抗病毒作用均呈现一定的浓度依赖性。[结论]该研究结果可为后续抗PEDV药物的筛选提供科学依据。
关键词 猪流行性腹泻病毒;中药;抗病毒作用
中图分类号 S858.28 文献标识码 A 文章编号 0517-6611(2023)09-0065-05
doi:10.3969/j.issn.0517-6611.2023.09.016
Abstract [Objective]In order to screen effective traditional Chinese medicine monomers and their action nodes against PEDV.[Method]Three traditional Chinese medicine monomers were selected for in vitro antiviral test.Through the drug action on the three nodes of the virus (inhibition of adsorption penetration,direct killing,inhibition of replication),the antiviral effect was evaluated by CCK8 method,indirect immunofluorescence method and Western blot.[Result]The results showed that baicalin and silymarin had the best antiviral effect at the stage of virus adsorption and penetration,while chebula had a poor antiviral effect.CCK8 test showed that the maximum inhibition rates of baicalin and silymarin were 82.34% and 78% respectively.Indirect immunofluorescence and Western blot further verified that baicalin and silymarin could reduce the intensity of green fluorescence and inhibit the expression of viral N protein,and the antiviral effects of the two drugs showed a certain concentration dependence.[Conclusion]The results of this study can provide a basis for the subsequent screening of anti PEDV drugs.
Key words Porcine epidemic diarrhea virus;Traditional Chinese medicine;Antiviral effect
基金项目 芜湖市科技计划重点研发项目(2020yf50)。
作者简介 單雪芹(1987—),女,安徽蚌埠人,工程师,硕士,从事微生物与免疫学研究。
猪流行性腹泻(PED)是由猪流行性腹泻病毒(PEDV)引起的仔猪和育肥猪的一种急性肠道传染病。该病可发生于任何年龄的猪,年龄越小,症状越重,死亡率越高[1]。PEDV暂无商品化特效治疗药物,主要依靠疫苗进行预防,但变异株的出现使疫苗保护力急剧下降,且弱毒疫苗存在一定的返强风险[2-3]。临床防治亦采用抗生素、激素等药物,但长期使用会导致致病菌耐药性增加和猪肉产品药物残留,降低疗效的同时增加公共卫生安全风险,严重危害人类健康[4-5]。我国中药资源丰富,且其具有低耐药性、低毒性、低残留等优点,目前已知较多中药具备增强免疫力及抗病毒作用[6],大量研究亦表明,中药能有效防治 PEDV 引起的仔猪腹泻[7]。
中兽医学认为,猪 PED 属于外邪犯脾胃,毒邪湿气蕴积体内所致,而仔猪为稚阳之体,脾胃素弱,饲养不当、寒热不调等侵入均可导致脾胃功能失调而引发仔猪腹泻,因此可采用清热解毒、健脾祛湿、止泻收敛等治疗原则[8]。黄芪具有健脾补中,升阳举陷,益卫固表,利尿,托毒生肌的功效,主治脾气虚证、肺气虚证等[9]。诃子可涩肠止泻,敛肺止咳,常用于治疗久泻久痢,便血脱肛[10]。水飞蓟性味苦凉,有清热、解毒、保肝利胆作用[11]。3种药物从功效上看,均可对PED产生治疗作用,其中发酵黄芪多糖产物对PEDV疫苗诱导的免疫应答的增强作用已得到证实[12],而诃子和水飞蓟对PEDV的影响鲜见报道。笔者选取 3 种中药进行体外抗 PEDV 研究,以期获得较好的抗 PEDV 的有效中药单体,为后续抗病毒药物的筛选提供科学依据。
1 材料与方法
1.1 材料
1.1.1 毒株和细胞。非洲绿猴肾细胞(Vero细胞)、PEDV HS株由实验室保存。
1.1.2 主要试剂。
黄芩苷(HPLC≥85%)、水飞蓟(10∶1 提取物)、诃子(10∶1 提取物)均购自宝鸡市方晟生物开发有限公司;新生牛血清购自内蒙古金源康生物工程有限公司;1M Tris-HCl、CCK-8 试剂盒、4%多聚甲醛固定液和RIPA 裂解液均购自上海碧云天生物技术有限公司;胰蛋白酶、DMEM、辣根过氧化物酶(HRP)化学发光底物均购自Thermo公司;PEDV N 蛋白单克隆抗体购自Medgene Labs 公司;FITC 标记山羊抗小鼠 IgG、小鼠抗 GAPDH 单克隆抗体、HRP 标记的山羊抗小鼠 IgG均购自生工生物工程(上海股份有限公司);脱脂牛奶、PBS、牛血清蛋白 V(BSA-Ⅴ)均购自北京索莱宝科技有限公司;Triton X-100购自北京酷来搏科技有限公司;彩色电泳蛋白 Marker(10-250 KDa)购自Bio-Rad 公司。
1.1.3 主要仪器。
细胞培养箱(Thermo Scientific 公司);酶标仪、湿转膜装置、蛋白电泳仪(Bio-Rad 公司);生物安全柜(苏州安泰空气技术有限公司);倒置荧光显微镜(Nikon 公司);脱色摇床(TS-100 海门麒麟医用仪器厂)。
1.2 方法
1.2.1 间接免疫荧光法测定 PEDV 病毒滴度。
选取生长状况良好的Vero细胞,消化后按100 μL/孔接种至96孔板内,置于37 ℃ 5% CO2条件下培养。将HS株用细胞维持液进行稀释,稀释度为10-1~10-10,待细胞长至90%时,弃去培养基,并将稀释好的病毒液按100 μL/孔接种至96孔板内,每个浓度设置8个重复,置于37 ℃ 5% CO2条件下培养72 h。
取出96孔板,弃生长液,按100 μL/孔加入4%多聚甲醛固定液,4 ℃固定30 min,用PBS 200 μL/孔洗涤3次,每次5 min;0.5% TritonX-100按100 μL/孔室温通透20 min,用相同方法洗涤;封闭液按100 μL/孔室温摇床封闭1h,用相同方法洗涤;加入一抗(1∶1 000 PBS稀释),50 μL/孔,4 ℃过夜孵育,用相同方法洗涤;加入荧光二抗(1∶100 PBS稀释),50 μL/孔,全程避光操作,室温摇床孵育1 h,用相同方法洗涤;加入适量PBS保持湿润;之后用荧光显微镜观察,记录荧光灶数目。按Reed-Muench两氏法计算TCID50。
1.2.2 中药单体最大无毒剂量的测定。
将中药溶解至DMSO中使其终浓度为100 mg/mL,用细胞维持液稀释中药使其终浓度为1 mg/mL(含1%DMSO),在此基础上进行倍比稀释。待96孔板铺满单层细胞,弃去培养基,按100 μL/孔向其加入稀释好的药液,每个浓度设置4个重复,另设正常细胞对照及含有1% DMSO对照,置于37 ℃ 5% CO2细胞培养箱培养96 h,用CCK-8法检测细胞存活率,细胞存活率大于90%的药物浓度即为该药物最大无毒剂量。
1.2.3 3种中药单体最佳作用浓度及作用节点的筛选。
试验选取黄芩苷、水飞蓟和诃子 3 种中药单体,分别通过 3 个作用节点(抑制吸附穿入、直接杀灭、抑制复制)进行体外抗 PEDV 试验,采用 CCK-8 法检测细胞 OD450 nm 值,并计算病毒抑制率。在药物最大无毒剂量范围内,用细胞维持液将药物倍比稀释成 4 个浓度(表1),分装待用。
1.2.3.1 中药对 PEDV 阻断作用的测定。
待 Vero 细胞单层时,弃细胞生长液,按100 μL/孔加入已稀释好的药液,每个浓度设置6个孔,37 ℃ 5% CO2 作用4 h,弃药液,按100 μL/孔加入 100 TCID50 PEDV,同时设立正常细胞及病毒对照,置于 37 ℃ 5% CO2作用2 h,弃病毒液,每孔加入100 μL细胞维持液,置于37 ℃ 5% CO2 培养96 h。之后采用 CCK-8 法检测细胞 OD450 nm 值,并计算病毒抑制率。
1.2.3.2 中药对 PEDV 直接杀灭作用的测定。
将稀释好的药液与100 TCID50 PEDV 混合,4 ℃作用4 h,然后按照100 μL/孔将混合液加入单层Vero细胞的96孔板内,每个药物浓度设置6个孔,同时设立正常细胞及病毒对照,37 ℃ 5% CO2 作用2 h,弃去混合液及病毒液,每孔加入100 μL细胞维持液,置于 37 ℃ 5% CO2 培养96 h。之后采用 CCK-8 法检测细胞 OD450 nm 值,并计算病毒抑制率。
1.2.3.3 中药对 PEDV 抑制作用的测定。
观察孔板内的Vero细胞,待细胞单层时,弃细胞生长液,按100 μL/孔加入100 TCID50 PEDV,37 ℃ 5% CO2 作用2 h,弃病毒液,按100 μL/孔加入已稀释好的藥液,每个药物浓度重复6个孔,同时设立正常细胞及病毒对照,置于 37 ℃ 5% CO2 培养96 h。之后采用CCK-8法检测细胞OD450 nm值,并计算病毒抑制率。
1.2.4 有效抗病毒作用节点试验。筛选出对病毒抑制率大于50%的中药单体及药物作用节点。
1.2.4.1 间接免疫荧光法检测抗病毒作用。
将生长状况良好的细胞铺至96孔板,待孔底铺满单层细胞,弃培养基,按100 μL/孔加入已稀释好的药液,37 ℃ 5% CO2作用4 h,弃去药液,按100 μL/孔加入100 TCID50 PEDV,同时设立正常细胞组对照及病毒组对照,置于37 ℃ 5% CO2作用2 h,弃去病毒液,按100 μL/孔加入细胞维持液,置于37 ℃ 5% CO2培养16 h,弃细胞生长液,将单层细胞用于间接免疫荧光法检测。
1.2.4.2 Western blot 法检测抗病毒作用。
将生长状况良好的细胞铺至6孔板,待孔底铺满单层细胞,弃培养基,按2 mL/孔加入已稀释好的药液,37 ℃ 5% CO2 作用4 h,弃去药液,按1 mL/孔加入 1 000 TCID50 PEDV。同时设立正常细胞及病毒对照,置于 37 ℃ 5% CO2 作用 2 h,弃病毒液,按 2 mL/孔加入细胞维持液,置于37 ℃ 5% CO2 培养16 h,收集细胞用于Western blot检测。
2 结果与分析
2.1 PEDV 病毒滴度
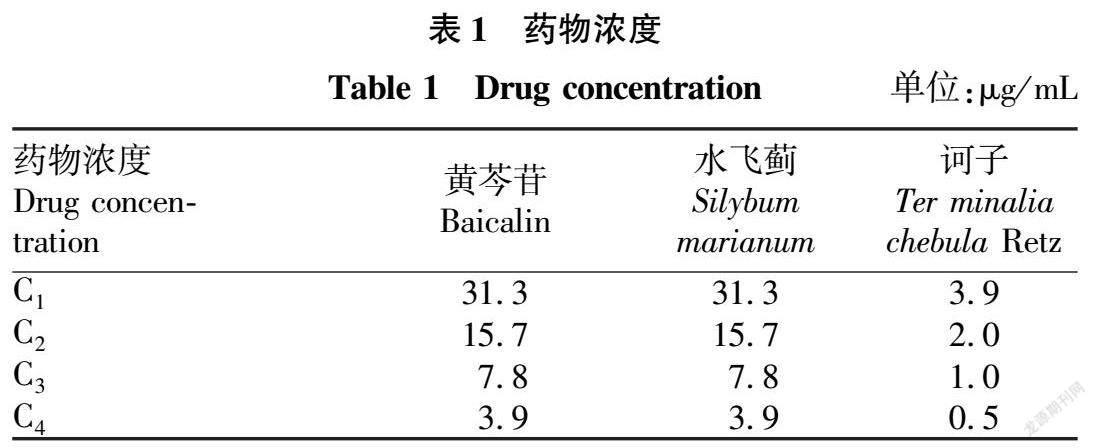
分别将稀释度为 10-1~-10-10 的病毒液接种至 96 孔板,置于 37 ℃ 5% CO2 培养 72 h后,用间接免疫荧光法检测每个孔中的 PEDV 荧光灶(图1)。经观察,PEDV 引起的病变情况按照 Reed-Muench 公式计算 TCID50,该病毒 TCID50 为 10-5.5/0.1 mL。
2.2 中药最大无毒剂量
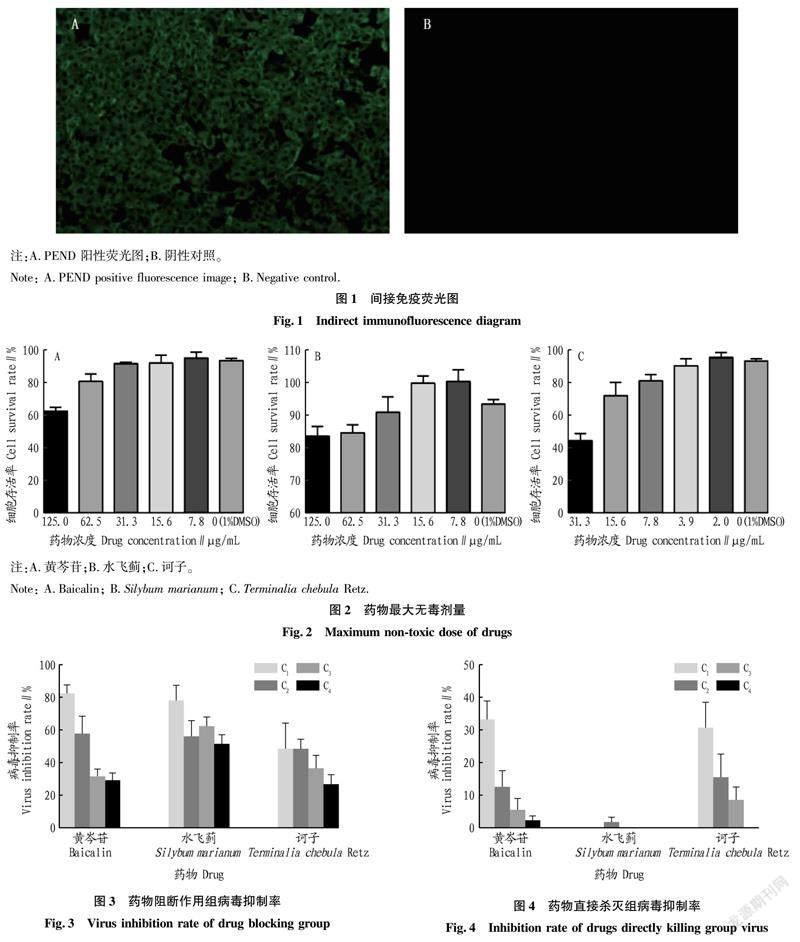
加入不同浓度药物培养96 h后,按照CCK-8法检测细胞OD450 nm值,并根据公式计算细胞存活率,当细胞存活率大于90%时,该浓度为药物最大无毒剂量。如图2所示,各药物最大无毒剂量黄芩苷为31.3 μg/mL,水飞蓟为31.3 μg/mL,诃子为3.9 μg/mL。
2.3 中药单体及作用节点的筛选结果
2.3.1 中药阻断病毒吸附穿入的检测结果。
如图3所示,3 种中药对病毒均有一定的抑制作用,且黄芩苷与水飞蓟的病毒最大抑制率分别为 82.34%和78.00%。黄芩苷对病毒的抑制呈现明显的浓度依赖,不同浓度间抑制率差异极显著(P<0.01),浓度越高,抑制率越高;水飞蓟不同浓度间抑制率差异不显著(P>0.05),说明水飞蓟对病毒抑制作用较为稳定。
2.3.2 中药直接杀灭病毒的检测结果。
如图4所示,3种中药对病毒的抑制作用均较差,黄芩苷与诃子对病毒最大抑制率分别为33.05%和30.55%,水飞蓟对PEDV无抑制作用,揭示黄芩苷、诃子和水飞蓟直接杀灭PEDV作用较差。
2.3.3 中药抑制病毒复制的检测结果。
根据所测的 OD450 nm 值,计算各中药浓度对病毒的抑制率,结果如图5所示。从图5可见,黄芩苷对病毒几乎无抑制作用,诃子对病毒的抑制作用很微弱,水飞蓟最大抑制率为 10.78%,揭示黄芩苷、诃子和水飞蓟无抑制 PEDV 复制的作用。
2.4 有效抗病毒作用的试验结果
2.4.1 间接免疫荧光。
结果显示,未经药物处理的病毒组显示出强烈的绿色荧光信号,相反,经药物处理后的试验组绿色荧光信号减弱,随着黄芩苷(图6)和水飞蓟(图7)浓度的降低,荧光信号强度开始增加,显示出2种药物的抗病毒作用均有一定的浓度依赖性。
2.4.2 Western blot。
随着黄芩苷和水飞蓟浓度的降低,病毒核衣壳蛋白均以类似的剂量依赖性方式增加,且黄芩苷剂量依赖性更强,这与 CCK-8 的检测结果和间接免疫荧光的检测结果一致。黄芩苷和水飞蓟在 C1 浓度时 N 蛋白几乎检测不到(图8)。
3 讨论
PED 主要危害仔猪,导致其高发病率和死亡率,给全球养猪业带来了巨大经济损失。尽管已经开发了多种PEDV疫苗,但是疫苗和田间流行毒株的差异性导致疫苗保护性较差[13]。截至目前,尚未开发出可用于 PEDV 的药物并在临床中使用。因此,迫切需要探究新型抗 PEDV 药物以消除 PED 的威胁。天然化合物和组合物已成为抵抗多种病毒感染的丰富药物来源。例如,格瑞弗森(Griffithsin)是一种高甘露糖特异性凝集素,已被证明可以通过防止病毒吸附和阻断 PEDV 在细胞间的传播来减少 Vero 细胞中的 PEDV 感染[14]。从柠檬清风藤(Sabia limoniacea)叶片中提取的丙烯基酚类化合物对 PEDV 的复制具有良好的抗病毒活性[15]。
PEDV 生命周期包括4个阶段:吸附、穿入、复制和释放[16]。该研究从 3 种中药中筛选出最有效的抗病毒中药及其抗病毒作用阶段。
该研究先确定 3 种药物最大无毒剂量,并在此基础上进行试验,最大程度减少药物毒性对细胞存活率的影响。采用 CCK-8 法测得细胞存活率,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色(颜色的深浅和细胞数目呈线性关系)[17]。通过 3 种不同作用方式来确定药物的最佳作用阶段,即阻断病毒的吸附、直接杀灭病毒、抑制病毒释放,3个作用方式与临床中预防、消毒和治疗的试验设计相似[18]。结果表明,在病毒吸附穿入阶段,3 种药物均显示出抑制病毒感染,其中黄芩苷和水飞蓟抑制作用效果较好,最大抑制率分别为 82.34%和 78.00%。在筛选出有效中药及其作用阶段后,通过间接免疫荧光和 Western blot 进一步分析黄芩苷和水飞蓟的抗病毒作用。结果显示,2种药物抗病毒作用均呈现一定的浓度依赖性,药物浓度越高,荧光信号越弱,N 蛋白表达量越低。N 蛋白在受感染的细胞内大量产生,且具有多种功能,包括与病毒 RNA 结合以形成核糖核衣壳,在病毒复制、转录和翻译中发挥作用[19]。黄芩苷和水飞蓟降低了细胞内 PEDV N 蛋白的表达,说明入侵细胞的 PEDV数量减少,再次证实黄芩苷和水飞蓟阻断了 PEDV 对细胞的吸附穿入。
水飞蓟提取物内含有大量黄酮类化合物,主要为水飞蓟素[20]。水飞蓟素包括水飞蓟賓(silybin)、异水飞蓟宾(isosilybin)、水飞蓟宁(silydianin)、水飞蓟亭(silychristin)等[21]。同样,黄芩苷也属于黄酮类化合物。黄酮类的药理特性包括抗菌、抗氧化、抗炎和抗病毒等功能[22]。目前已有针对黄酮类化合物对多种 DNA 和 RNA 病毒进行了抗病毒研究[23]。其作用机理包括对冠状病毒 3CL 蛋白酶(3CLpro)的抑制作用[24-25],同样甾体生物碱番茄素(Tomatidine)亦通过抑制 3CLpro 的活性显著抑制了 PEDV 的复制[26];破坏病毒 RNA 与异质性胞核核糖核蛋白(heterogeneous nuclear ribonuc leoproteins)的结合来抑制肠道病毒 71 型感染[27];干扰神经氨酸酶活性,破坏H5N1 型禽流感病毒在人肺上皮细胞和单核细胞来源的巨噬细胞中的复制[28]。该研究发现了黄芩苷和水飞蓟可以抑制 PEDV 吸附穿入细胞,但具体作用机制仍需进一步研究。
参考文献
[1] 黄龙,赵世源,高菊梅,等.猪流行性腹泻的诊断报告[C]//中国畜牧兽医学会兽医病理学分会第二十一次学术研讨会暨中国病理生理学会动物病理生理学专业委员会第二十次学术研讨会 论文集.[出版地不详]:[出版者不详],2015:165.
[2] 杨盼盼.表达PEDV中国变异株S基因重组伪狂犬病病毒构建[D].郑州:河南农业大学,2015.
[3] 胡兴义,张双翔,冯旭芳,等.猪病毒性腹泻(PED)疫苗免疫后母猪乳汁中PEDV IgA消长动态[J].中国兽医学报,2017,37(9):1659-1663.
[4] 代新光,冯雪冰.基层医院中用维生素抗生素激素药物的忧患[J].中外医疗,2009,28(5):165.
[5] 中农.抗生素可用但不可滥用[J].农业知识:科学养殖,2013(4):18.
[6] 孙耀华,杨劲松.中兽药的临床应用之抗病毒和增强免疫力的中草药[J].兽药市场指南,2021(2):38-39.
[7] 刘衍芬,李艳飞,鄂禄祥.中药复方对人工感染猪流行性腹泻病毒仔猪的治疗效果研究[J].黑龙江畜牧兽医,2016(9):155-158,298.
[8] 朱国强.猪流行性腹泻的中兽医辨证分析[J].畜牧业环境,2020(10):87-88.
[9] 张焕,王玉龙,刘秋燕,等.浅析黄芪药对在方剂配伍中的意义(摘要)[C]//中华中医药学会2014第七次临床中药学术研讨会论文集.[出版地不详]:[出版者不详],2014:125-126.
[10] 罗光伟,陈建江.诃子的药理作用研究进展[J].云南中医中药杂志,2012,33(11):78-80.
[11] 鞠雷,王晓丹,刘占民.水飞蓟煎剂对ICR小鼠扑热息痛肝损伤的保护作用[J].黑龙江畜牧兽医,2007(11):90-92.
[12] 王亭亭.黄芪发酵多糖提取物组份鉴定及其对猪流行性腹泻的免疫调节作用[D].泰安:山东农业大学,2020.
[13] CHEN N H,LI S J,ZHOU R Y,et al.Two novel porcine epidemic diarrhea virus (PEDV) recombinants from a natural recombinant and distinct subtypes of PEDV variants[J].Virus research,2017,242:90-95.
[14] 陈兵.中药复方健脾止泻散对仔猪流行性腹泻防治效果研究[D].长沙:湖南农业大学,2014.
[15] CHO H M,HA T K Q,DANG L H,et al.Prenylated phenolic compounds from the leaves of Sabia limoniacea and their antiviral activities against porcine epidemic diarrhea virus.[J].Journal of natural products,2019,82(4):702-713.
[16] WANG Y H,GRUNEWALD M,PERLMAN S.Coronaviruses: An updated overview of their replication and pathogenesis[J].Methods in molecular biology,2020,2203:1-29.
[17] 郭玲,王敏,郝亮.胰島素样生长因子1对小鼠成骨细胞增殖和碱性磷酸酶活性的影响[J].中国组织工程研究与临床康复,2010,14(33):6095-6098.
[18] 布玮玮.河南省PRRSV分子流行病学调查及体外抗病毒中药单体的筛选[D].洛阳:河南科技大学,2014.
[19] MCBRIDE R,VAN ZYL M,FIELDING B C.The coronavirus nucleocapsid is a multifunctional protein[J].Viruses,2014,6(8):2991-3018.
[20] 闫玉峰,于健东.水飞蓟的化学成分及药理研究进展[J].中国药事,2000,14(5):335-337.
[21] 陈香.水飞蓟提取物中黄酮成分分析[J].现代仪器,2012,18(5):83-85.
[22] RUSSO M,MOCCIA S,SPAGNUOLO C,et al.Roles of flavonoids against coronavirus infection[J].Chemicobiological interactions,2020,328:1-13.
[23] LALANI S,POH C L.Flavonoids as antiviral agents for Enterovirus A71 (EV-A71)[J].Viruses,2020,12(2):1-34.
[24] JO S,KIM S,SHIN D H,et al.Inhibition of SARSCoV 3CL protease by flavonoids[J].Journal of enzyme inhibition and medicinal chemistry,2020,35(1):145-151.
[25] JO S,KIM H,KIM S,et al.Characteristics of flavonoids as potent MERSCoV 3Clike protease inhibitors[J].Chemical biology & drug design,2019,94(6):2023-2030.
[26] WANG P C,BAI J,LIU X W,et al.Tomatidine inhibits porcine epidemic diarrhea virus replication by targeting 3CL protease[J].Veterinary research,2020,51(1):1-18.
[27] ZHANG W,QIAO H S,LV Y Z,et al.Apigenin inhibits enterovirus71 infection by disrupting viral RNA association with transacting factors[J].PLoS One,2014,9(10):1-9.
[28] SITHISARN P,MICHAELIS M,SCHUBERTZSILAVECZ M,et al.Differential antiviral and anti-inflammatory mechanisms of the flavonoids biochanin A and baicalein in H5N1 influenza A virusinfected cells[J].Antiviral research,2013,97(1):41-48.

