AlCl3/urea类离子液体电沉积铝
王姝羡,徐存英,陈 晓,向琴琴,李 艳
(昆明理工大学 冶金与能源工程学院,云南 昆明 650093)
铝具有优良的导电性、导热性、延展性、耐蚀性及易回收等特点,被广泛应用于汽车船舶、建筑材料、航天航空及电子技术工业等方面,是一种具有应用潜力的优良材料[1]。现行铝主要采用冰晶石熔盐电解工艺生产[2]。该工艺通常在非常高的温度(950~1 000 ℃)下进行,存在能耗高、操作复杂、排放污染物等不足。为了降低能耗和减少污染物排放,许多研究人员转而研究如何在室温和近室温条件下电解铝。有机溶液(如芳香烃和醚)作为电解质可实现铝电沉积和电解精炼[3],但有机溶剂挥发性高、导电性差、电化学窗口窄等缺陷限制了其实际应用。离子液体是近30年发展起来的一种新型溶剂,具有导电性好、热稳定性高、电化学窗口宽、不可燃性、不挥发性和无毒等特点[4-8],可以避免传统有机溶剂和高温熔盐体系的固有缺陷,成为电化学提取铝和精炼铝的一种理想替代电解质。
近年来,离子液体电沉积铝引起了人们的极大关注:Pradhan等[9]研究了在EMIC-AlCl3和BMIC-Al-Cl3两种离子液体中铝的电沉积,结果发现,在90 ℃时,可以在铜基体上沉积出结节状且均匀分布的铝;Kamavaram[10]、Zhang[11]等利用低温AlCl3-BMIC离子液体作为电解质对铝合金(65%~71% Al)进行电解精炼,可以得到纯度为99%的工业铝,且污染物零排放。上述研究结果表明,利用离子液体作为电解液,可以实现电沉积铝或进行铝合金的电解精炼,但是离子液体的合成工艺复杂、价格昂贵,极大地限制了其工业应用。
类离子液体[12]是近年来发展起来的一种新型溶剂,它不仅具有离子液体独特的物理化学性能,还具有合成简单、价格低廉等优点。在几种三氯化铝基类离子液体中,尿素-酰胺(乙酰胺、丙酰胺、丁酰胺、碳酰胺)类离子液体[13]由于合成原料价格非常低廉、导电性好、操作简单,成为电沉积铝和电解精炼铝的潜在电解质。Li等[14]初步探索在AlCl3/酰胺(乙酰胺、丙酰胺、丁酰胺)中电沉积铝,发现在AlCl3/酰胺摩尔比为1.3∶1.0的AlCl3/酰胺类离子液体中均可在铜电极上电沉积出铝,且在AlCl3/乙酰胺类离子液体中电沉积的铝沉积层较为平整。Cvetković等[15]研究了在AlCl3/碳酰胺中沉积温度、工作电位、沉积电流密度和沉积时间对沉积铝形态的影响,结果发现,沉积的铝晶粒的形状和大小随施加的电势、电流密度和温度的变化而变化,而沉积时间对铝的改变不大。但是到目前为止,仅在该类离子液体中电沉积出铝,而对于它们的综合电化学性能及组分对铝电沉积性能的影响研究较为浅显,而这些对于开发AlCl3/酰胺类离子液体电解生产铝和电解精炼铝的新工艺又至关重要。
因此,本文研究了三氯化铝/尿素(AlCl3/urea)类离子液体的物理化学性质及电化学行为;系统分析AlCl3/urea摩尔比和温度对体系电导率和黏度的影响,以及温度对铝离子析出电位、铝离子还原反应过程动力学、沉积铝形貌和结构的影响规律。
1 实验材料和方法
1.1 化学试剂及材料
尿素(CH4N2O)、三氯化铝(AlCl3)、无水乙醇(C2H6O)、丙酮(C3H6O)等试验所用的化学试剂均为分析级,购自上海阿拉丁生化科技有限公司;尿素使用前在真空干燥箱中于343K下干燥24 h。Pt线(d=1.0 mm,99.9%)、Al丝(d=1.0 mm,99.9%)、铜电极(d=3 mm,99.9%)和铜片(>99%)购自Sigma Aldrich公司。
1.2 类离子液体的制备及性能测试
在充满氩气的真空手套箱中进行AlCl3/urea类离子液体的合成。将不同摩尔比的尿素与AlCl3混合均匀,形成亮黄色的透明液体,得到不同配比的AlCl3/urea类离子液体[16]。
AlCl3/urea类离子液体的电导率和黏度分别采用便携式电导率仪(型号:DDBJ-350F,雷磁仪电科学仪器)和数字旋转黏度计(型号:SNB-2,上海方瑞仪器有限公司)进行测试。为了最大限度地减小测量误差,电导率和黏度的测量均采用降温的方式测试。每次测量前在油浴锅中恒温1 h,在每个实验条件下测试3次,电导率测试的误差范围约为±0.02 mS·cm-1,黏度测试的误差范围约为±0.05 mPa·s。在排除偶然误差的情况下,取其算术平均值作为最终测量结果。
1.3 电化学测试与电沉积
所有电化学测试及电沉积均在氩气气氛保护下进行;电化学测试采用典型的三电极体系在CHI760D电化学工作站上进行;工作电极采用Cu圆盘电极(d=3 mm),对电极采用Pt丝电极(d=1.0 mm,l=5 mm),参比电极用自制的Al/Al(Ⅲ)作为参比电极。实验前,工作电极和对电极经金相砂纸打磨平整;然后,用0.5 μm Al2O3粉进行抛光;再依次使用丙酮、酒精和超纯水进行清洗;最后,冷风吹干备用。电沉积实验采用直流电源恒电流沉积,阴极为铜片(1 cm×1 cm),阳极为铝片(2 cm×2 cm)。进行实验前,电极需要用金相砂纸打磨光亮;然后,用无水乙醇浸泡超声去脂,最后用去离子水冲洗吹干备用。
电沉积所得样品的形貌和晶体结构分别采用场发射电子扫描显微镜(FE-SEM)和X射线衍射仪(XRD)进行表征分析。
2 结果与讨论
2.1 AlCl3/urea类离子液体电导率
在不同温度条件下,测定AlCl3/urea类离子液体电导率与体系组分的关系,结果如图1所示。
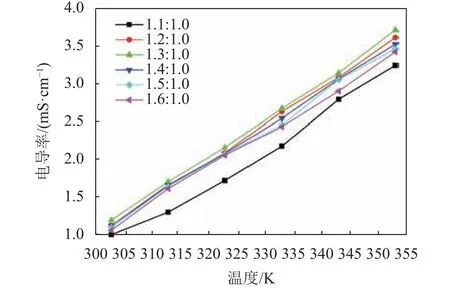
图1 不同温度下不同摩尔比的AlCl3/urea类离子液体的电导率Fig.1 Conductivity of AlCl3/urea ionic liquid analogues with different molar ratios at different temperatures
由图1可见:随着AlCl3/urea摩尔比的增加,AlCl3/urea类离子液体电导率逐渐增加;当AlCl3/urea超过1.3∶1.0时,电导率开始下降。这表明类离子液体的电导率与体系组分(AlCl3/urea摩尔比)有密切的关系。溶液电导率(κ)可表示为[17]:
式中:e为电子电量,取1.602 2×10-19C;F为法拉第常数;|zi|为带电离子电荷数;ci为带电离子摩尔浓度,mol·m-3;η为溶液黏度,Pa·s;r为带离子半径,m;π为圆周率。
由式(1)可知:电导率与体系的组成、带电体的数目、半径及介质黏度等均有关系;AlCl3摩尔分数的增加使AlCl3/urea体系的组成、带电离子的数目、半径及黏度都发生变化,从而导致电导率变化。
AlCl3型离子液体的离子存在形态与离子液体的组成密切相关,AlCl3/urea类离子液体也是如此。当AlCl3/urea的摩尔比小于等于1.0时,AlCl3/urea类离子液体呈碱性或中性,AlCl3与urea发生反应[12]:
由式(2)可知,反应生成了 [AlCl2·(urea)n]+正离子和 AlCl-4负离子。因此,在较低摩尔比的AlCl3/urea类离子液体中,存在的负离子主要是 AlCl-4。正、负离子交替排列可形成链状的低聚体,如式(3):
虽然正、负离子之间的作用力较弱,但足以使原来单个的离子失去其独立性,从而形成带正电、带负电或电中性的低聚体。低聚体的链长与正负离子的种类、大小、离子间相互作用力和氢键的强弱有关。离子体积越小,聚合度越高,链越长,低聚体体积相对就大;反之,正负离子体积越大,聚合度就越低,链越短,低聚体体积相对就小。由于 AlCl4-离子的体积较小,离子缔合效应和氢键作用较大,有利于形成聚合度较高的 ···AlCl-4-[AlCl2·(urea)n]+-AlCl-4···低聚体,带电体数目少。
当AlCl3/urea摩尔比超过1.0时,AlCl3/urea类离子液体变为酸性,增加的AlCl3与体系中的负离子AlCl-4反应为:


由图1还可以看出,在组成一定的条件下,AlCl3/urea类离子液体的电导率随温度的升高而增大。这是因为类离子液体由阴、阳离子组成,依靠离子迁移导电,随着温度的升高,离子获得的能量增加,容易克服离子间的相互作用力及聚合效应,导致类离子液体黏度降低,离子运动的阻力减小,迁移速度加快,电导率增大。对图1中的实验数据进行回归分析发现,AlCl3/urea类离子液体的电导率与温度的关系符合Kohlraush经验式[20]:
式中:κ0为当温度为T0时体系的电导率,mS·cm-1;α、β为温度系数;T为温度,K;T0为最低测试温度,取303 K。
由图1可以计算出κ0、α和β。为了分析温度系数随摩尔比的变化规律,绘制温度系数α和β与类离子液体摩尔比的关系曲线,结果如图2所示。
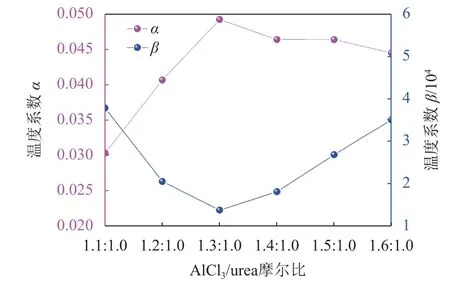
图2 温度系数α、β与摩尔比的关系Fig.2 Temperature coefficients α and β versus molar ratio
由图2可见:随着AlCl3/urea摩尔比从1.1增加到1.3,温度系数α从0.030迅速增加至0.049;当AlCl3/urea摩尔比超过1.3:1.0时,温度系数α随AlCl3/urea摩尔比的增加略微降低,说明AlCl3摩尔比对α的影响越来越小。温度系数α的这种变化规律与AlCl3/urea类离子液体中的氢键作用和缔合效应有关[21]。体系的氢键作用和缔合效应越大,温度对类离子液体的结构影响越大。在AlCl3/urea摩尔比小于1.3的区域,由于体系的氢键作用和缔合效应较大,故AlCl3/urea摩尔比对温度系数α的影响较大;而在AlCl3/urea摩尔比大于1.3的区域,由于体系的氢键作用和缔合效应较小,故AlCl3/urea摩尔比对温度系数α的影响比较小[22]。从图2还可以看出:当AlCl3/urea摩尔比小于1.3时,温度系数β随着AlCl3/urea摩尔比的增大而下降;当Al-Cl3/urea摩尔比大于1.3时,AlCl3/urea摩尔比对于温度系数β的影响增大。温度系数β的变化规律与AlCl3/urea类离子液体的淌度作用有关[23],体系的淌度作用越大,温度对类离子液体的结构影响越大。在AlCl3/urea摩尔比小于1.3的区域,由于体系的淌度作用较小,故AlCl3/urea摩尔比对温度系数β的影响较小;而在AlCl3/urea摩尔比大于1.3的区域,由于体系的淌度作用较大,故AlCl3/urea摩尔比对温度系数β的影响比较大。
依据Arrhenius公式,如式(7)所示[24],绘制AlCl3/urea类离子液体电导率的对数(ln κ)与温度倒数(T-1)的关系曲线,结果如图3所示。由图3可见,ln κ与T-1呈良好的线性关系,根据拟合结果可以计算出不同摩尔比的类离子液体的电导活化能,结果见表1。可以发现:体系的电导活化能随摩尔比的增加先减小后增加;当摩尔比为1.3∶1.0时,电导活化能最小,为19.82kJ·mol-1。
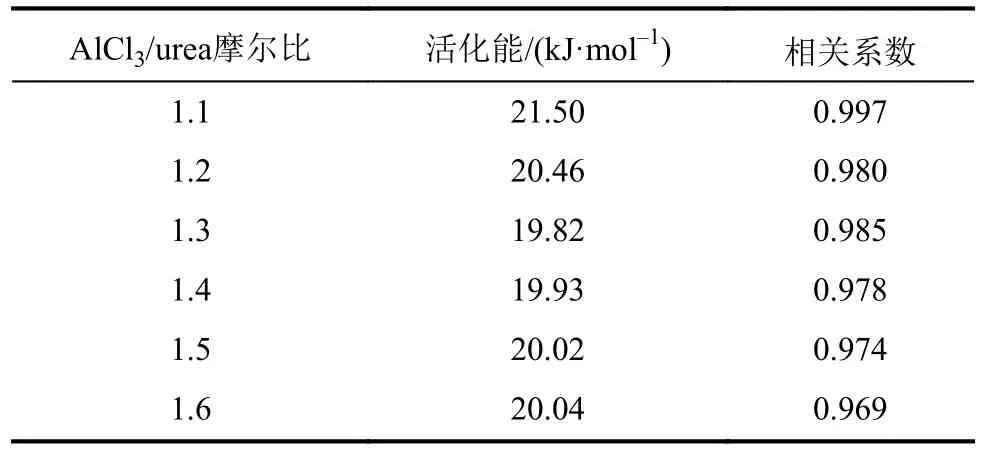
表1 不同摩尔比的AlCl3/urea类离子液体的Arrhenius回归参数Tab.1 Regression parameters of Arrhenius for different molar ratios of AlCl3/urea ionic liquid analogues

图3 不同摩尔比的AlCl3/urea类离子液体电导率的对数ln κ与温度倒数T -1的关系Fig.3 Relationship between ln κ and T -1 of conductivity of AlCl3/urea ionic liquid analogues with different molar ratios
式中:κ为电导率,mS·cm-1;κ0为常数;Eκ为电导活化能,kJ·mol-1;R为气体常数;T为热力学温度,K。
2.2 AlCl3/urea类离子液体黏度
黏度是类离子液体的一个重要参数,为了研究体系组分对AlCl3/urea类离子液体黏度的影响,测定了不同AlCl3/urea摩尔比(1.1∶1.0~1.6∶1.0)的类离子液体在不同温度(303~353 K)下的黏度,结果如图4所示。由图4可见:电解质黏度随AlCl3/urea摩尔比的增加呈先降低后增加趋势,当AlCl3/urea摩尔比为1.3∶1.0时,黏度最低;不同摩尔比的AlCl3/urea类离子液体黏度随温度的升高都出现急剧降低趋势,说明黏度对温度非常敏感;温度升高,阴阳离子间距离增大,离子间相互作用力减小,体系黏度也随之减小。
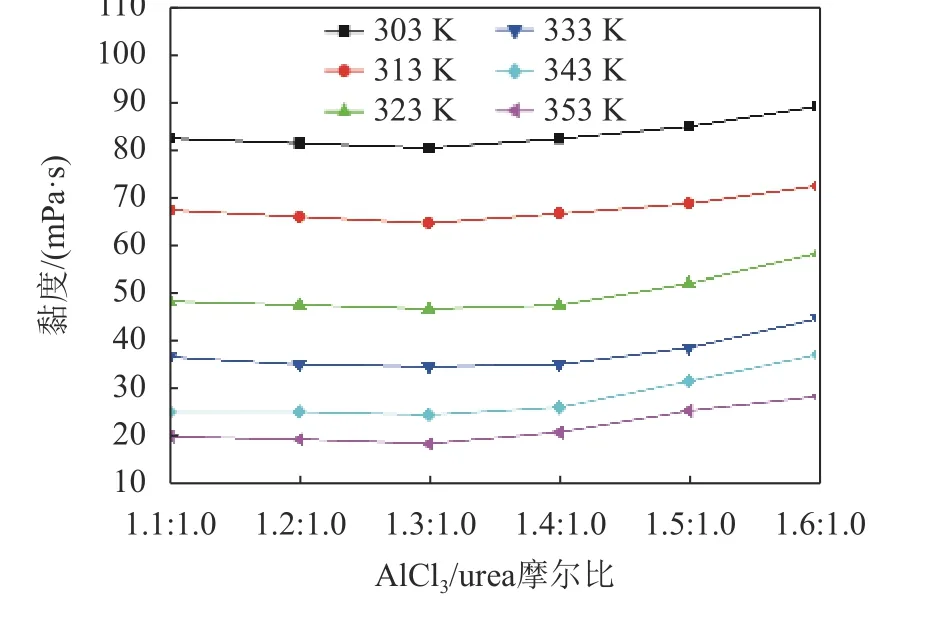
图4 不同摩尔比的AlCl3/urea类离子液体在不同温度下的黏度Fig.4 Viscosity of AlCl3/urea ionic liquid analogues with different molar ratios at different temperatures
综合体系离子电导率和黏度的测试结果及参数分析,发现AlCl3/urea摩尔比为1.3∶1.0的类离子液体物化性质较为优良,故选定该体系进行后续电化学研究。
2.3 阴极极化曲线
图5为不同温度下在AlCl3/urea(1.3∶1.0)类离子液体中铜电极上Al(Ⅲ)还原的阴极极化曲线。
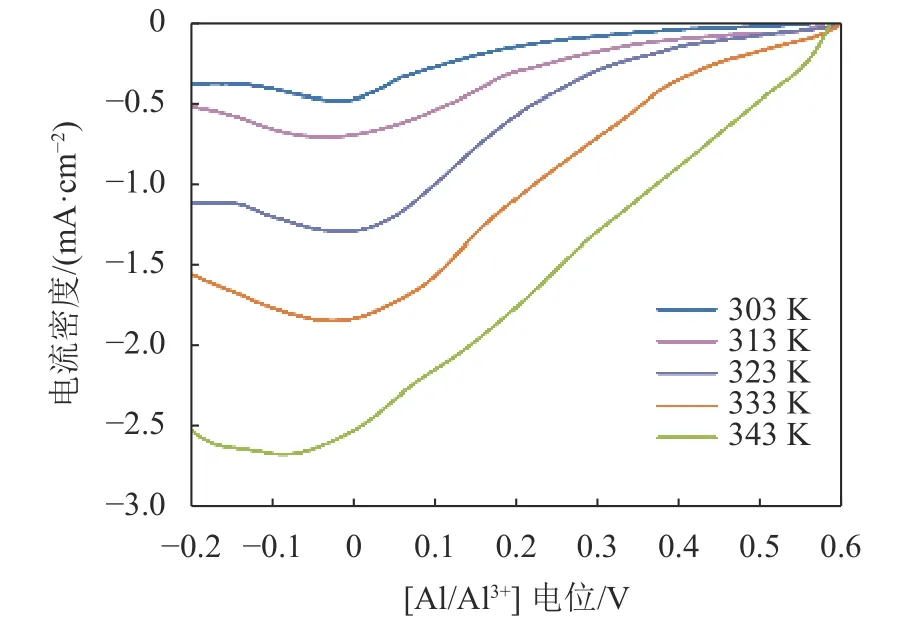
图5 温度对铝在铜基体上的阴极极化曲线的影响(扫速:5 mV/s)Fig.5 Effects of temperature on the cathodic polarization curves of aluminum on copper substrates (v=5 mV/s)
从图5可以看出,随着反应温度的升高,金属铝的析出电位逐渐正移,但变化不大。这是因为随着温度的升高,AlCl3/urea类离子液体黏度逐渐降低,离子的迁移速率加速了Al(Ⅲ)离子在铜基体上的还原[25]。铝在AlCl3/urea(1.3∶1.0)类离子液体中的还原反应可以用式(8)和(9)表示[12]:
为了得到相关动力学参数,将铝的阴极极化曲线转化为Tafel曲线形式,通过对阴极极化曲线的塔菲尔区域进行分析得到塔菲尔斜率b、传递系数c和交换电流密度i0等参数,计算公式如式(10)和(11)所示[26]:
式中:η为过电位,V;b为塔菲尔斜率,mV/decade;i0为交换电流密度,mA/cm2。将得到的不同温度下动力学参数列于表2。
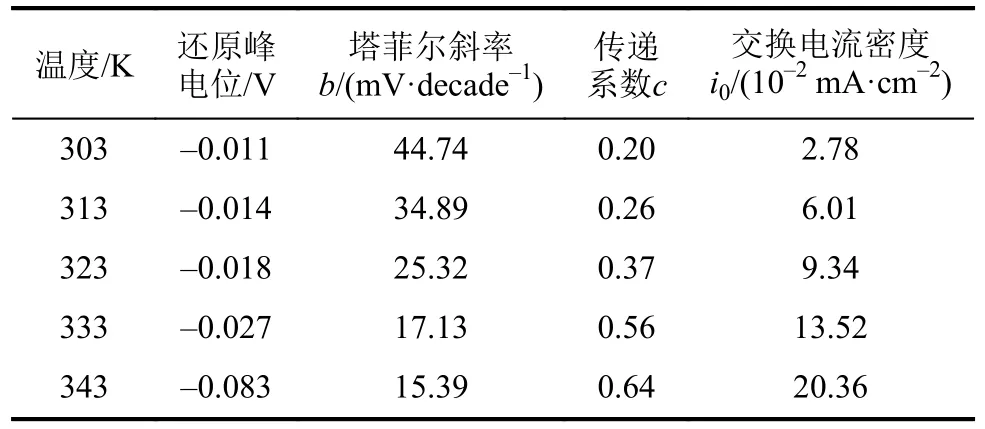
表2 温度对铝在铜基体上的阴极极化曲线影响的动力学参数Tab.2 Kinetic parameters of the effects of temperature on the cathodic polarization curves of aluminum on copper substrate
从表2可以看出:随着反应温度从303 K增加到343 K,塔菲尔斜率b从44.74 mV·decade-1变为15.39 mV·decade-1,而传递系数c则从0.20增加到0.64,表明温度升高可促进电荷迁移反应;交换电流密度随着温度的升高而增大,说明较高的温度有利于加快Al(Ⅲ)离子的还原反应速率。交换电流密度i0与温度之间的关系可以用Arrhenius公式的推导式来表示[27],如式(12):
式中,n为阴极反应转移的电子数,A为电极反应面积,Ec′为电极反应表观活化能。绘制交换电流密度的对数lni0与温度的倒数T-1关系曲线,如图6所示。由图6可见,lni0与T-1呈良好的线性关系,说明实验数据符合Arrhenius推导式。
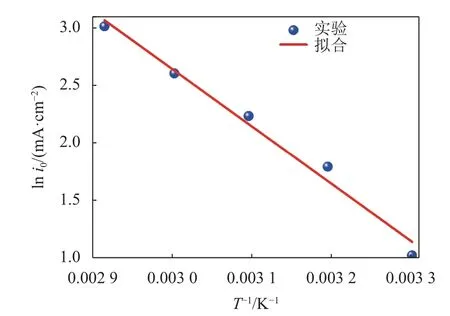
图6 ln i0与T -1的关系Fig.6 Relationship between ln i0 and T -1
2.4 铝沉积产物的表征分析
对不同温度下得到的沉积产物进行扫描电镜分析,所得表面形貌如图7所示。由图7可见,不同温度下得到的铝均由不规则的微米块体组成。313 K得到的铝粒径较大,致密性较差,这可能是因为温度较低时,AlCl3/urea电解液黏度较大,活性离子扩散传递速率较慢,电极表面的活性离子得不到及时补充,导致浓差极化增大,所以得到的铝沉积层不致密[28];与313 K沉积温度相比,323 K条件下得到的铝粒径显著减小,沉积层变得平整致密,这是因为温度升高降低了电解质黏度,促进了离子的扩散,减小或消除了浓差极化;随着温度从323 K升高到343 K,铝沉积产物粒径稍有增大,这是因为铝的生长速率随温度的升高而逐渐加快。

图7 不同温度下电流密度i=5 mA/cm2电沉积1.5 h得到的铝产物FE-SEM照片Fig.7 FE-SEM pictures of aluminum obtained by electrodeposition at different temperatures with current density i=5 mA/cm2 for 1.5 h
图8为不同温度下所得到的铝沉积物的XRD图谱。由图8可见,所有沉积物均为面心立方(fcc)结构的金属铝。
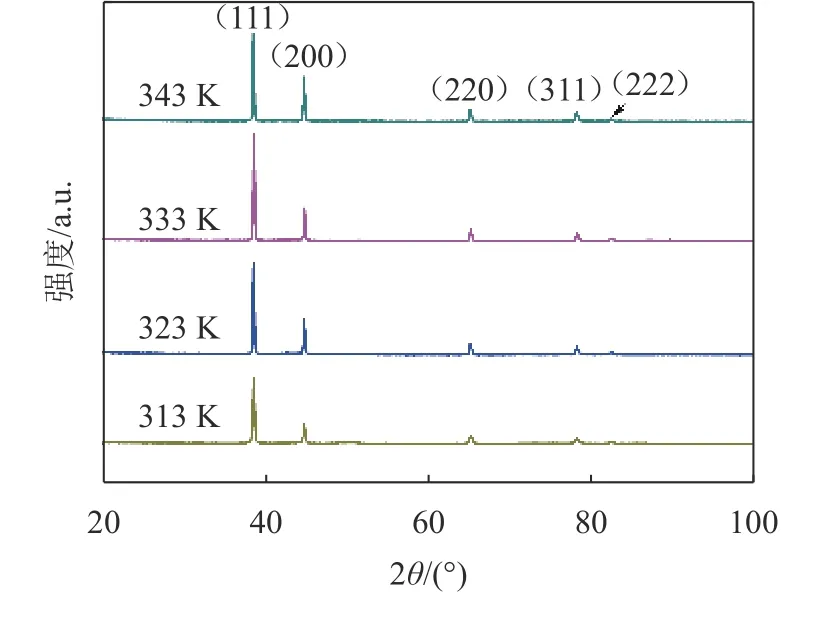
图8 铝产物XRD图谱Fig.8 XRD patterns of aluminum products
晶体的择优取向通常用织构系数TC(hkl)来表示[29],其计算公式如式(13):
式中,TC(hkl)为晶体的结构系数,I(hkl)为测量所得(hkl)晶面的峰强,I0(hkl)为(hkl)晶面对应的ASTM标准强度,n为XRD测试到的晶面数。
温度对铝沉积物结晶取向的影响见表3。结构系数与单位1的偏差意味着生长的首选方向,偏差越大表明取向越高。分析表3可知,不同温度下获得的沉积物都具有(111)晶面优先取向[18]。313 K获得的铝择优取向从(111)变为(222)、(200)、(220)和(311),而在更高温度(323 K~343 K)下获得的铝择优取向从(111)变为(200)、(220)、(222)和(311)。
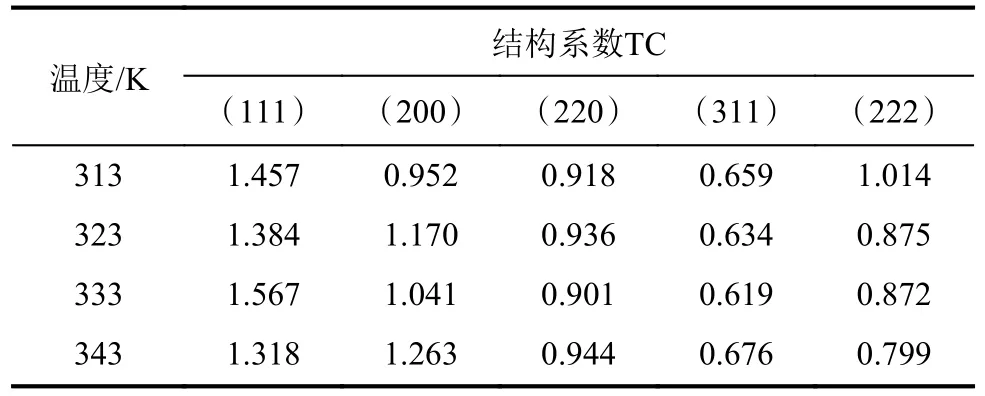
表3 温度对铝沉积物结晶取向的影响Tab.3 Effect of temperature on the crystalline orientation of aluminum deposits
3 结 论
1)在303~353 K的温度范围内研究了不同摩尔比(1.1∶1.0~1.6∶1.0)的AlCl3/urea类离子液体的电导率和黏度。结果表明,摩尔比为1.3∶1.0的AlCl3/urea类离子液体电导率最大,黏度最小,物化性质较为优良,其电导活化能为19.82 kJ·mol-1。
2)阴极线性扫描伏安曲线表明:随着反应温度从303 K增加到343 K,塔菲尔斜率b从44.74 mV·decade-1减少到15.39 mV·decade-1,传递系数c从0.20增加到0.64,说明温度升高促进了电荷迁移反应,使得金属铝的析出电位正移,交换电流密度增大,并且温度越高这种趋势越明显,说明较高的温度有利于加快Al(Ⅲ)离子在铜基体上的还原;lni0与T-1呈良好的线性关系,说明实验数据符合Arrhenius推导式。
3)FE-SEM结果表明,不同温度下得到的铝均由不规则的微米块体组成。313 K条件下得到的铝粒径较大,致密性较差;升温使得铝粒径减小,沉积层更加平整致密;XRD分析表明晶粒的生长方式受到了温度的影响,但都具有(111)晶面优先取向。

