离子敏感型原位凝胶在眼部给药的应用
刘颖慧,李昆钊,梁文迪,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
眼睛是人体重要且敏感的器官,其结构复杂、构造精密,容易受到各种疾病和炎症的影响。然而,眼部的生理屏障和清除机制对有效治疗各种眼部疾病提出了不小的挑战。眼部给药最常用的途径是局部给药,如滴眼液和眼膏剂。然而,却面临着生物利用度低(5 %)、频繁给药等局限性[1]。为克服这些局限,越来越多的研究者们开始探索原位凝胶在眼部递药中的应用。笔者就眼用离子敏感型原位凝胶的作用机制、常用聚合物材料以及递药策略进行概述,旨在为后续的研究方向提供新的思路和有益参考。
1 眼部给药的特点
眼睛通常以晶状体平面为界被分为前段和后段,前段包括角膜、结膜、虹膜、睫状体、房水和晶状体;后段包括玻璃体、视网膜、黄斑、视神经、脉络膜和巩膜(见图 1)。相应地,眼部疾病也被分为前段疾病和后段疾病[2-3]。眼部疾病的给药途径主要是局部给药和全身给药。
全身给药主要采用口服或静脉注射,使药物通过血液循环到达作用部位。但是,由于眼内环境的血-房水屏障(Blood-aqueous barrier,BAB)和血-视网膜屏障(Blood-retina barrier,BRB)的阻碍,全身给药的生物利用度仅有10 %[4-5]。
局部给药是治疗眼前段疾病最常见的手段,常用的给药剂型主要是滴眼液和眼膏剂,约占眼用制剂市场的 90 %[6]。局部给药虽然无创,且患者依从性好,但反射性眨眼、泪液稀释、鼻泪管引流等动态屏障使药物很难达到理想的治疗效果,生物利用度还不到 5 %[5-8]。研究表明,普通滴眼液一滴的体积大约为 25~56 μL,平均约39 μL。而眼睛储存液体的体积约为 7 μL,滴眼后多余的药液会迅速从结膜囊溢出,或从鼻泪管流出,泪液也会不断排出,直到其体积恢复至 7 μL 左右。泪液排出的速率可随药液黏度增大而减小[7,9]。因此,滴眼液的药物损失率在 90 % 以上。此外,少量药物将从鼻泪管进入胃肠道,还会造成全身毒性[10]。为维持药效,滴眼液给药次数一般维持在 2~4 次/天。频繁给药使得药物吸收的峰谷现象突出,在靶部位难以维持长时间平稳有效的治疗浓度,高频率、大剂量用药可能会同时引起眼部和全身副作用[11,12]。为了能较大限度地提高眼用药物的眼部吸收,最常使用的改进策略主要有两种:增加角膜通透性和延长眼表接触时间[7,13]。前者主要通过前药、渗透促进剂和胶体给药系统(如纳米粒、脂质体、囊泡)来实现,后者主要依赖于眼用制剂的流变性和黏附性来实现[14]。
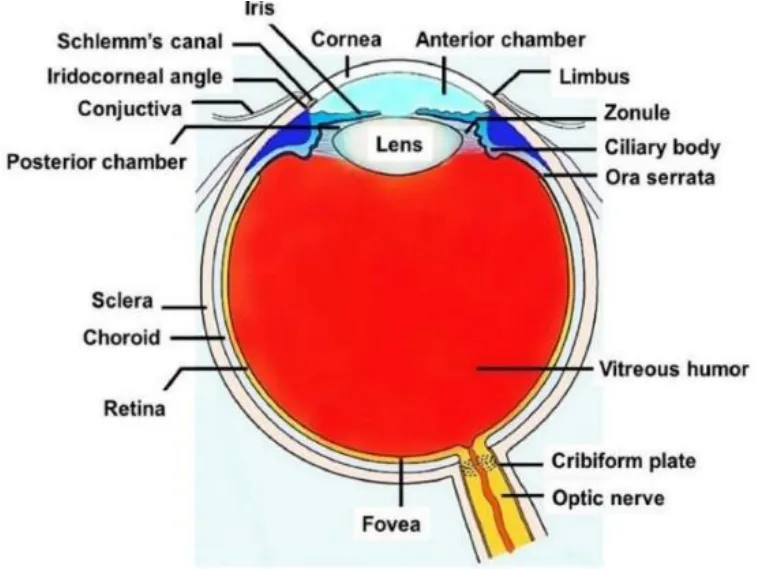
Fig.1 Anatomy of eye[3]图1 眼部解剖图[3]
2 原位凝胶
原位凝胶(in-situgel)又称即型凝胶、在位凝胶,是一种具有环境敏感性的聚合物药物[15-17]。该类制剂以水溶液形式作用于眼部后,在眼部生理环境下发生相变,形成半固态的凝胶状物质(见图 2),从而延长了药物在眼部的滞留时间。该递药系统具有滴眼液和眼用凝胶的双重优势[11,18]。此外,原位凝胶具有假塑性行为,其黏度会随着剪切速率的增加而急剧下降,可避免患者因频繁眨眼而产生疼痛的感觉[19-21]。该类制剂的特点在于:①易于给药,剂量准确,副作用小;②眼部滞留时间长,药物持续释放,生物利用度高;③减少给药频率,改善患者依从性和舒适性[21,22]。

Fig.2 The picture of blank gel solution and blank gel[11]图2 空白凝胶溶液与空白凝胶[11]
刺激响应型原位凝胶是使用环境敏感、生物相容、无刺激性的聚合物配制而成的[23]。根据刺激响应性机制,原位凝胶大致可分为温度敏感型、pH 敏感型、离子敏感型三种凝胶体系[18,24]。温度敏感型原位凝胶在室温下为溶液形式,在生理温度下转变为半固态凝胶,最常用的聚合物有泊洛沙姆(Poloxamers/Pluronics®)、聚N-异丙基丙烯酰胺类和纤维素衍生物等[25]。pH 敏感型聚合物如聚丙烯酸(Polyacrylic acid,PAA)类衍生物卡波姆,含有可电离的酸性或碱性基团,这些基团能够根据环境 pH 值的变化接受或提供质子,并表现出溶胶-凝胶(sol-to-gel)转变[25-26]。离子敏感型聚合物可与泪液中的离子相互作用,构象改变并形成三维网状结构,发生溶胶-凝胶转变。制剂在眼表的黏度主要取决于泪液中阳离子的浓度[25]。有研究认为,阴离子和阳离子聚合物可比非离子聚合物表现出更好、更显著的黏附性能。泪液的快速周转与排出会使普通黏性滴眼液被稀释,导致其黏附性降低。而此时阳离子的大量增加,却可进一步提高离子敏感型聚合物的黏度[27]。此外,离子敏感原位凝胶与温度敏感原位凝胶相比,所使用的响应性聚合物浓度更小;与pH 敏感原位凝胶相比,具有更适于眼部的 pH 值,刺激性更小[17]。因此,离子敏感型原位凝胶在眼部给药的应用有着独特的优势。
第一个上市的眼用原位凝胶制剂 Timoptic®-XE[9],即马来酸噻吗洛尔原位凝胶滴眼液(Timolol maleate ophthalmic gel forming solution),是以结冷胶为基质的离子敏感型原位凝胶制剂。与传统的噻吗洛尔滴眼液相比,原位凝胶制剂的给药频率从每天两次减少到每天一次[28]。目前市场上的眼用原位凝胶产品见表 1。

Table 1 Key information about the marketed in-situ gel preparations表1 已上市原位凝胶制剂的主要信息
3 离子敏感型原位凝胶作用机制
阴离子多糖与泪液中的一价 Na+和/或二价 Ca2+、Mg2+交联后可发生溶胶-凝胶转变[29],并增加聚合物黏度。因此,可延长药物在眼部的滞留时间,减少泪液的冲刷与稀释,提高生物利用度[30]。其中,阳离子的类型和浓度与交联聚合物的黏度和溶胶-凝胶转变速率有关。在可用于开发缓释给药的眼科制剂的材料中,广泛使用的为离子活化多糖包括结冷胶、海藻酸钠、黄原胶等[19,21,24]。
4 常用离子敏感型聚合物及其应用
4.1 结冷胶
结冷胶(Gellan gum,GG)是从鞘氨醇单胞菌中提取的一种线性阴离子胞外多糖,由α-L-鼠李糖、β-D-葡萄糖和β-D-葡萄糖醛酸组成,摩尔比为 1∶2∶1[22]。结冷胶最初是一种食品添加剂,在各种食物中起到稳定剂、增稠剂和胶凝剂的作用。近年来,结冷胶因其生物相容性和低细胞毒性而被作为生物医学应用材料进行研究[31]。天然结冷胶可形成柔软的弹性凝胶,而商业产品(Gelite®/kelcogel®)通过碱处理脱乙酰化,可形成透明且坚硬的凝胶[32]。结冷胶对热和 pH 都很稳定,其分子量很高,约 5 × 105Da[33]。在无离子环境中,含有结冷胶的溶液黏度很小,在室温下以溶液形式存在,聚合物通过微弱的范德华力连接而形成双螺旋[34]。一旦与泪液中的阳离子电解质接触,这些螺旋聚集在一起,导致聚合物交联,并与阳离子形成复合物,与水形成氢键,聚集形成三维网络结构。这样就形成了结膜-巩膜储存库,从而可以更有效地控制药物释放[24]。镁、钙等二价离子比钠、钾等一价离子对凝胶特性的影响更大。在所有阳离子中,钙离子对凝胶强度的影响最大[33]。
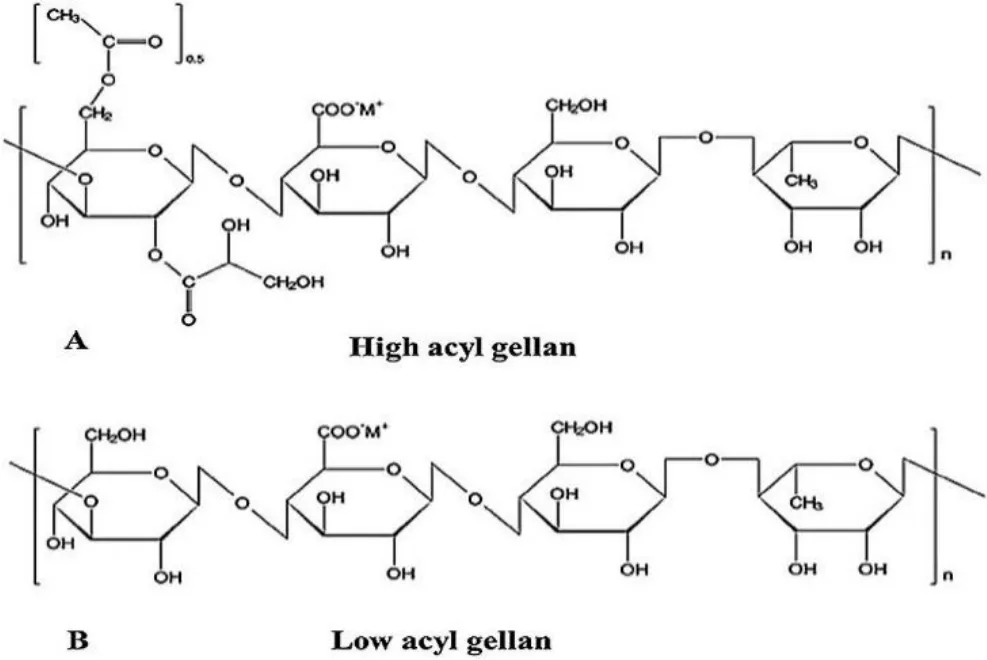
Fig.3 The chemical structure of gellan gum: high acyl (A) and low acyl (B) [33]图3 结冷胶化学结构:高乙酰化(A)和低乙酰化(B)[33]
4.1.1 结冷胶的应用
Yu 等[13]设计了马来酸噻吗洛尔(Timolol maleate,TM)的“脂质体-离子敏感原位凝胶载体”给药系统,实验得出 TM 在0.2 %、0.4 % 和 0.6 %(w/v)低乙酰结冷胶脂质体的释药速度呈递减趋势,凝胶黏度呈递增趋势。在对制剂的体内外特性和刺激性进行评价后发现,与传统马来酸噻吗洛尔滴眼液相比,新型制剂可提高角膜透过率、延长角膜滞留时间、提高生物利用度。
Sun 等[31]开发了以结冷胶为基础的布林佐胺(Brinzolamide)眼用原位凝胶缓释制剂。实验结果表明,在模拟泪液(Simulated tear fluids,STF)的存在下,制剂溶液相变后形成一种黏性凝胶。从而,可实现药物的缓慢释放。普通滴眼液 2 h 内释放近 92 % 的药物,相变后的凝胶制剂可使药物释放时间延长至 12 h。凝胶的黏度随 GG 浓度的增加而增加,而释药速率随之降低。
Bhalerao 等[34]研究了布林佐胺在不同比例结冷胶制剂的体外释放情况发现,含有结冷胶的制剂的药物释放主要受制剂中结冷胶的比例影响。在布林唑胺溶液浓度为 0.5 %(w/v)的情况下,结冷胶浓度从 0.10 % 增加到 0.30 %,溶液的黏度从 19 cps 增加到 41 cps,与模拟泪液混合后体外胶凝时间从 18 s 显著缩短到 5 s。不含结冷胶的制剂 50 % 药物释放所需时间(t50%)为 0.28 h,完全释放时间(t90%)为 3.91 h。当结冷胶的用量从 0.10 % 增加到 0.30 % 时,t50%提高为2.86~9.80 h,t90%提高为 14.91~32.12 h。
4.1.2 结冷胶的设计改良
结冷胶虽然具有一定的黏附性,但因为其三维结构依赖着较弱的氢键和范德华力,所以仍不足以延长药物在黏膜的滞留时间至理想值[22]。因此,不少研究者尝试对结冷胶进行结构改良,开发其衍生物,以便得到更优的制剂。
Agibayeva 等[35]对甲基丙烯酸酯结冷胶衍生物作为潜在的眼部给药黏附性辅料进行了评价。通过与甲基丙烯酸酐反应,对结冷胶进行化学改性,得到甲基丙烯酸度分别为 14 % 和 49 % 的衍生物。与原始结冷胶相比,衍生物的疏水性更强。对含有结冷胶的荧光素钠及其甲基丙烯酸酯衍生物的体外研究表明,甲基丙烯酸化改善了结冷胶的黏附性,增强了它们在牛结膜黏膜上的滞留。用含有结冷胶和甲基丙烯酸酯衍生物的盐酸毛果芸香碱制剂进行的活体实验表明,改性程度较低的 6 % 的衍生物具有更好的性能。
Jelkmann 等[22]通过氧化裂解和氨还原胺化将伯氨基引入结冷胶主链,合成了胺化结冷胶衍生物。与未经改性的结冷胶相比,胺化的聚合物-粘液混合物的黏度增加了 32 倍,在黏膜的黏附时间延长了 14 倍,从而增强了制剂的黏附性。
4.2 海藻酸钠
海藻酸盐(Sodium alginate,SA)是一种可生物降解的生物相容性阴离子多糖,由β-D-甘露糖醛酸(Mannuronic acid,M)和α-L-古糖醛酸(guluronic acid,G)残基组成,二者通过 1,4-糖苷键连接,其顺序和比例由其来源的藻类决定[24]。这种多糖与溶液中的 Ca2+等阳离子反应,通过离子交联形成紧密排列的链状水凝胶,增加了其黏性,也增加了眼药的滞留时间。所形成凝胶的理化性质取决于所用海藻酸盐的浓度、黏度、分子量,以及其结构中 G 和 M 残基的比例,前者含量的增加会增加凝胶的凝胶化程度[24,36,37]。
Cohen 等[37]的研究结果表明,低 G 含量(40 %)的海藻酸盐凝胶化速度较慢,一般需要10 min以上才能得到可见的凝胶。高 G(69 %)海藻酸基质的毛果芸香碱制剂能有效降低兔眼的眼压,并维持 10 h 左右。相比之下,毛果芸香碱水溶液剂的降眼压效果仅可持续 3 h。而低 G(39 %)的海藻酸盐制剂的持续降眼压效果仅与水溶液剂相当。
Rupenthal 等[27]比较了载有毛果芸香碱的 0.5 % 结冷胶、黄原胶、卡拉胶、海藻酸盐等聚合物的原位凝胶制剂的效果。这些聚合物在维持毛果芸香碱的缩瞳反应方面均优于水溶液。然而,海藻酸盐制剂的药物滞留效果逊于其他聚合物制剂,性能较差,原因可能是其在泪液中的凝胶能力较低。另外,泪液的快速周转与排出虽然进一步提高了结冷胶、黄原胶和卡拉胶制剂的黏度,却可能由于其中的二价阳离子浓度过高,导致海藻酸盐在眼部产生沉淀。
4.3 黄原胶
黄原胶(Xanthan gum,XG)是一种生物相容性好、可生物降解的阴离子多糖,经细菌发酵产生。XG 由一个线性的β-(1-4)-D-葡萄糖骨架组成,与纤维素相同[38]。XG 水溶液具有剪切稀释性,在低温或高离子强度下显示出有序、刚性的双螺旋结构。不同的 XG 分子链之间通过较弱的非共价相互作用形成三维网络结构。所以,其凝胶性质较弱,它在任何浓度下都不能形成真正的凝胶[39]。因此,与前两种聚合物相比,黄原胶很少作为起主要作用的凝胶剂,它更多地被用来与其他性能优异的聚合物复配,通常作为增黏剂以改善单一凝胶体系的黏度和凝胶化程度。
Bhowmik 等[40]制备了一种基于泊洛沙姆 407 的眼用原位凝胶制剂,并在不影响凝胶缓释性能的前提下,加入了黄原胶和瓜尔胶(Guar gum)。结果表明,要使制剂在体温下发生溶胶-凝胶转变,需泊洛沙姆的浓度在 18 % 以上。而以质量比 3∶7 加入黄原胶和瓜尔胶后,泊洛沙姆浓度低于 18 % 时便可完成凝胶转变。体外和体内研究都表明,含有黄原胶-瓜尔胶的制剂的药物释放速率更慢,角膜前滞留时间更长。
Morsi 等[41]制备了以结冷胶为基础的离子敏感型眼部给药纳米乳剂。分别加入了黄原胶和HPMC 增强制剂的黏附性,未影响缓释性能。相比之下,结冷胶-黄原胶制剂在所有研究参数上均优于结冷胶-HPMC。制剂稳定性良好,与市售布林佐胺滴眼液(Azopt®)和乙酰唑胺口服片剂(Cidamex®)相比,能有效减缓药物释放,在长时间降低眼压方面显示出优越性。
4.4 复配体系
在实际应用中,单一的凝胶体系有时候会因具有一定的缺陷导致其性能不能完全满足制剂的要求。因此,可以采用复配体系来改变单一原位凝胶基质的缺陷。将两种或以上具有不同刺激响应机制的原位凝胶聚合物组合在同一制剂中,有望改善治疗效果并提高患者依从性,还可能使药物的生物利用度呈指数增加[42]。同时,也可减少配制更高效的原位凝胶体系所需的单个聚合物的用量[32]。
Shastri 等[43]以盐酸莫西沙星为模型药物,考察了以 P407(15 %,w/w)、P188(14 %~16 %,w/w)为基础的加入结冷胶(0.3 %~0.7 %,w/w)的原位凝胶复配体系。发现结冷胶的加入对凝胶的生物黏附力、凝胶强度产生了积极作用,也有助于控制药物的释放速率。
Ranch 等[44]研制、优化和评价了结冷胶(0.55 %,w/v)与卡波姆 934P(0.35 %,w/v)的复配体系制备奥洛他定原位凝胶,二者的协同效应改善了制剂的凝胶特性。优化后的凝胶透明、等渗,具有假塑性流动,生理条件下黏度最大(3363 cps)、非生理条件下黏度最小(131 cps)、使用安全、无刺激性。活体药物释放研究显示,与滴眼液(1 h)相比,家兔泪液中的药物存在时间长达3 h。该凝胶在人眼内的接触时间为 (15.0 ± 2.5) min,是市售凝胶((6.0 ± 3.2) min)的 2 倍以上,可减少给药次数和总给药剂量。
结语
除了上述的刺激响应性原位凝胶,一些“智能”凝胶也层出不穷。在环境发生微小变化时可表现出显著的物理化学变化,从而触发智能聚合物结构变化。这些信号或刺激因素可以是光、压力、酶、生物分子、葡萄糖等[24,42],“智能”凝胶的独特性能也在眼部给药方面打开了新的应用的大门。
综上所述,眼用原位凝胶制剂具有独特的优势,能够克服一部分传统眼药剂型的局限性,可极大延长药物在角膜的滞留时间、减少给药次数、提高生物利用度、改善患者依从性。原位凝胶给药系统在治疗眼部疾病方面有着巨大的潜力和广阔的前景。然而,目前上市的眼用原位凝胶制剂凤毛麟角,可见原位凝胶给药系统在临床的多样化应用仍面临着不小的挑战。为了最大化地提高眼用原位凝胶制剂的治疗效果,还需对各类聚合物进行更深入、更严格的研究与探索,以开发出更优秀的原位凝胶眼部给药系统。同时,针对眼用原位凝胶制剂建立一套完善的质量评价体系也是亟待解决的问题。

