扩张型心肌病病人CD247基因多态性与遗传易感的关系
李超民,李渊博,董晓华,徐林杰,韩 勇,罗 薇
目前,关于扩张型心肌病(dilated cardiomyopathy,DCM)的发病机制仍在不断研究中,遗传因素和非遗传因素均是其发生的原因[1]。有研究显示,自身免疫是参与DCM心力衰竭发展和进展的关键机制[2]。T细胞在DCM发病机制中发挥着双重作用,一方面,T细胞可帮助B细胞产生自身抗体;另一方面,它们释放细胞因子以诱导纤维化[3]。全基因组分析显示了DCM与T细胞分化、增殖和激活相关基因的关联[4]。T细胞受体T3 zeta 链(CD3ζ),也称为CD247,对T细胞受体-CD3(TCR/CD3)复合物的组装、表面表达和信号级联重要[5],该途径异常导致T细胞功能障碍和自身免疫性疾病发展[5]。相关研究已证实,CD247与多种自身免疫性疾病之间存在关联,包括系统性红斑狼疮、类风湿性关节炎等[6]。然而,CD247基因突变是否与DCM的易感性相关报道较少。本研究假设是CD247通过自身免疫的病理过程介导不良的心脏重塑,探讨了已证实与自身免疫疾病相关的3个CD247单核苷酸多态性(single-nucleotide polymorphisms,SNP)rs1052237[7]、rs2056626[8]和rs864537[9]是否与DCM的易感性相关。
1 资料与方法
1.1 研究对象 选取2015年3月—2019年4月在我院连续招募同意参与基因研究的279例DCM病人作为病例组。DCM入选标准:根据欧洲心脏病学会(ESC)工作组关于的DCM临床诊断[10];排除标准:非DCM、冠心病、原发性瓣膜性心脏病、先天性心脏病、肺源性心脏病、心包炎、肿瘤或免疫系统疾病。临床评估、实验室检查、超声心动图和冠状动脉造影(或冠状动脉计算机断层造影)及心脏磁共振成像和心脏放射性核素检查(如有临床指征)进行诊断评估。所有病人的电子病历均包括家族史。对照组为同期于我院进行体检的健康者363名,通过问卷调查、体检、血清生化指标和超声心动图评估,均为身体健康;排除标准:心血管疾病史或症状、服用任何心血管疾病药物及糖尿病诊断。测定超声心动图参数,包括左室射血分数(LVEF)和心脏内部尺寸。
1.2 SNP基因分型 采集血液至含有乙二胺四乙酸(EDTA)的容器中。根据标准盐析法从外周静脉血的白细胞中提取基因组DNA,在iPLEX SNP基因分型分析仪(美国Sequenom公司)上使用Sequenom-MassARRAY系统进行SNP基因分型。聚合酶链式反应(PCR)和相关延伸反应的所有分析均由在线分析设计套件软件(Sequenom)设计,引物由美国Invitrogen公司合成。根据Sequenom MassARRAY SNP技术提供的标准方法,进行PCR条件、等位基因特异性引物延伸及其产物分析。使用MassARRAY Typer 4.0软件(Sequenom)对产生的质谱进行处理和分析,测定峰识别和等位基因。为了确保获得的基因型是有效的,在5%的DNA样本中对各个SNP进行重复的基因型分析,所有结果完全一致,对所有其他数据进行盲法基因分型。基因分型调用率为99.0%~99.5%。
1.3 随访 第3个月、第6个月、第1年通过访问、电话或医疗记录进行随访。记录之后每年生存状况和死亡病因,预后评估包括全因死亡或心血管疾病死亡。
1.4 统计学处理 采用SPSS 19.0统计软件进行分析。采用双尾独立t检验比较病例组和对照组之间连续变量的差异。采用Kruskal-Wallish检验比较3种遗传模式下基因型间非正态连续变量的差异。分类变量的比较采用χ2检验。通过χ2拟合优度检验评估对照组中每个SNP与Hardy-Weinberg平衡(HWE)的偏差。χ2检验评估病例组和对照组等位基因和基因型频率的差异。采用Logistic回归分析不同遗传模式或等位基因指定的基因型对DCM易感性的影响。Kaplan-Meier图和多变量Cox回归分析用于根据基因型定义的亚组的生存分析。显著性阈值设定为P<0.05。错误发现率(FDR)控制用于调整多次测试。
2 结 果
2.1 两组临床资料比较(见表1)
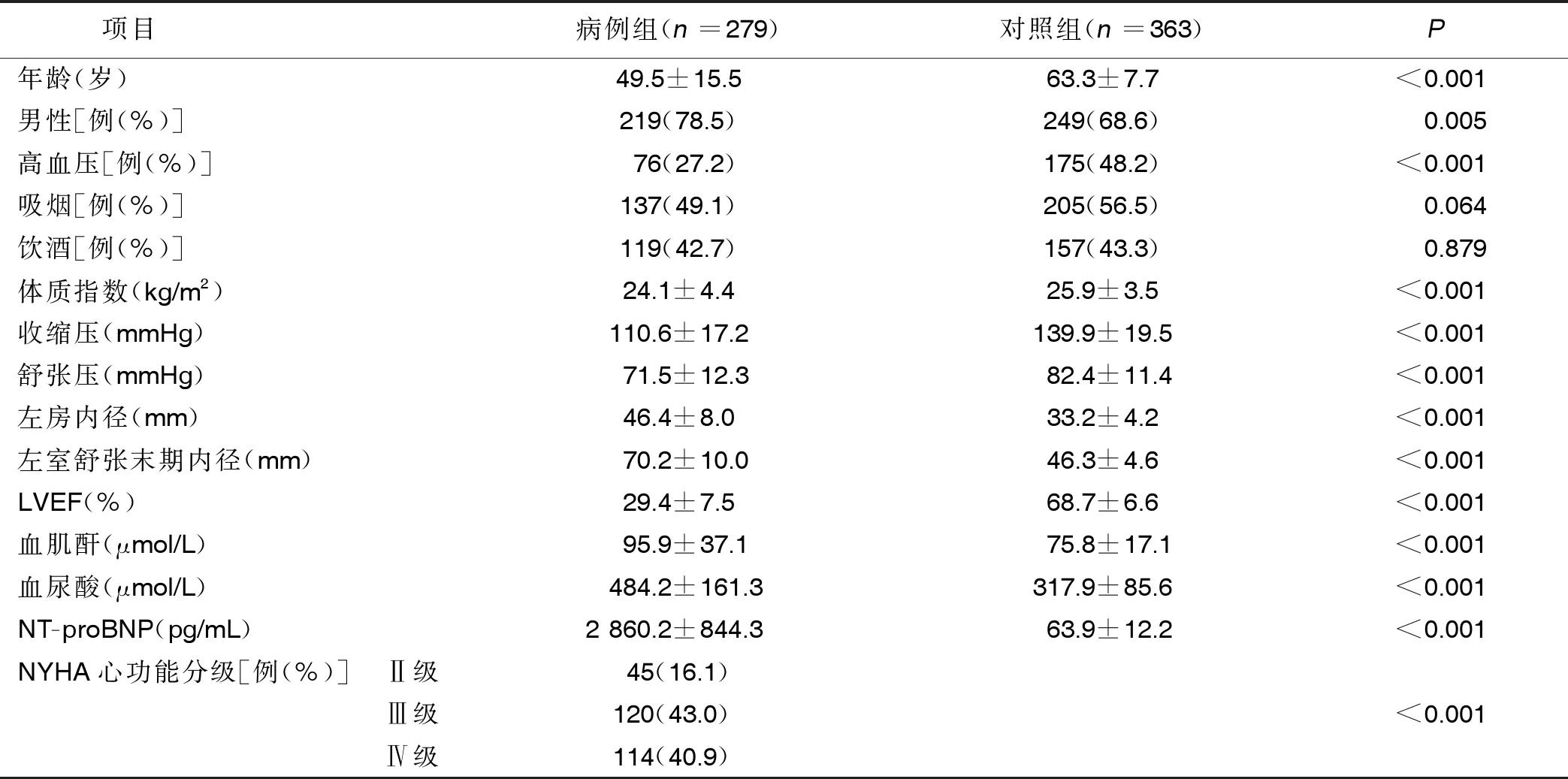
表1 两组临床资料比较
2.2 两组CD247基因型分布 DCM病人中,rs1052237的G等位基因和rs2056626的C等位基因频率较低(P<0.05),详见表2。加性模型中,rs1052237和rs2056626与DCM的低易感性相关(P值分别为0.045,0.040),并在隐性遗传模型中倾向于降低DCM的易感性(P值分别为0.052,0.064)。详见表3。
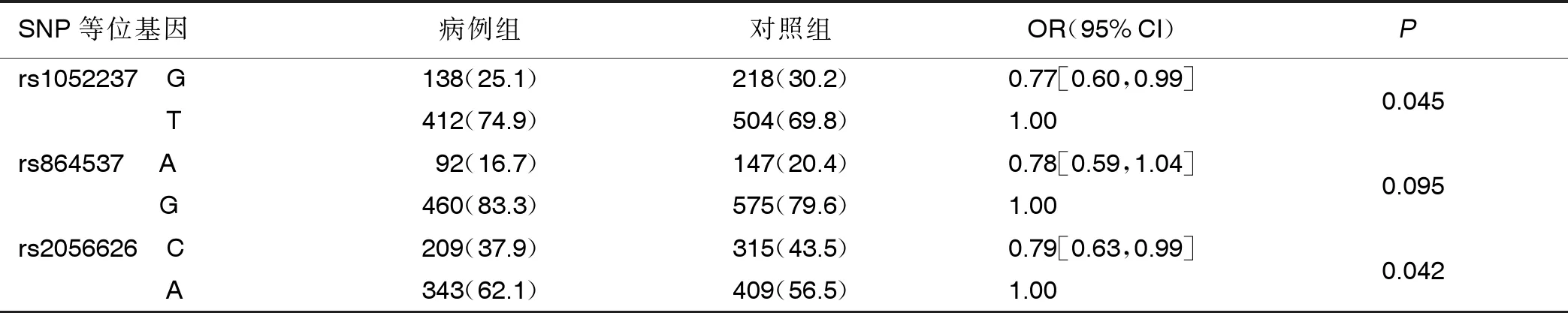
表2 两组CD247基因多态性等位基因频率比较 单位:例(%)

表3 两组CD247基因型分布 单位:例
2.3 CD247基因多态性与DCM病人血清CD247水平、临床指标的关联 在加性模型和显性模型下,rs864537的A变异体与DCM病人的血清CD247水平较低相关(P值分别为0.032,0.012)。rs1052237的G变异体与DCM病人血清CD247低水平相关(加性模型,P=0.020;显性模型,P=0.020;隐性模型,P=0.037)。详见表4。rs864537的AA基因型与较低的LVEF(隐性模型,P=0.018;加性模型,P=0.039),较高的左室舒张末期内径(加性模型,P=0.033)有关。详见表5。

表4 DCM病人CD247基因多态性与血清CD247水平的关系(n=279)

表5 DCM 病人CD247基因多态性与心功能指标的关系
2.4 CD247基因多态性对DCM病人预后的影响 所有DCM病人随访时间为(20.6±10.6)个月,其中60例死于其他原因,57例死于心血管疾病。Kaplan-Meier和多变量Cox回归分析表明,CD247基因的3个SNP多态性对DCM病人的全因死亡或心血管死亡无影响。详见表6。
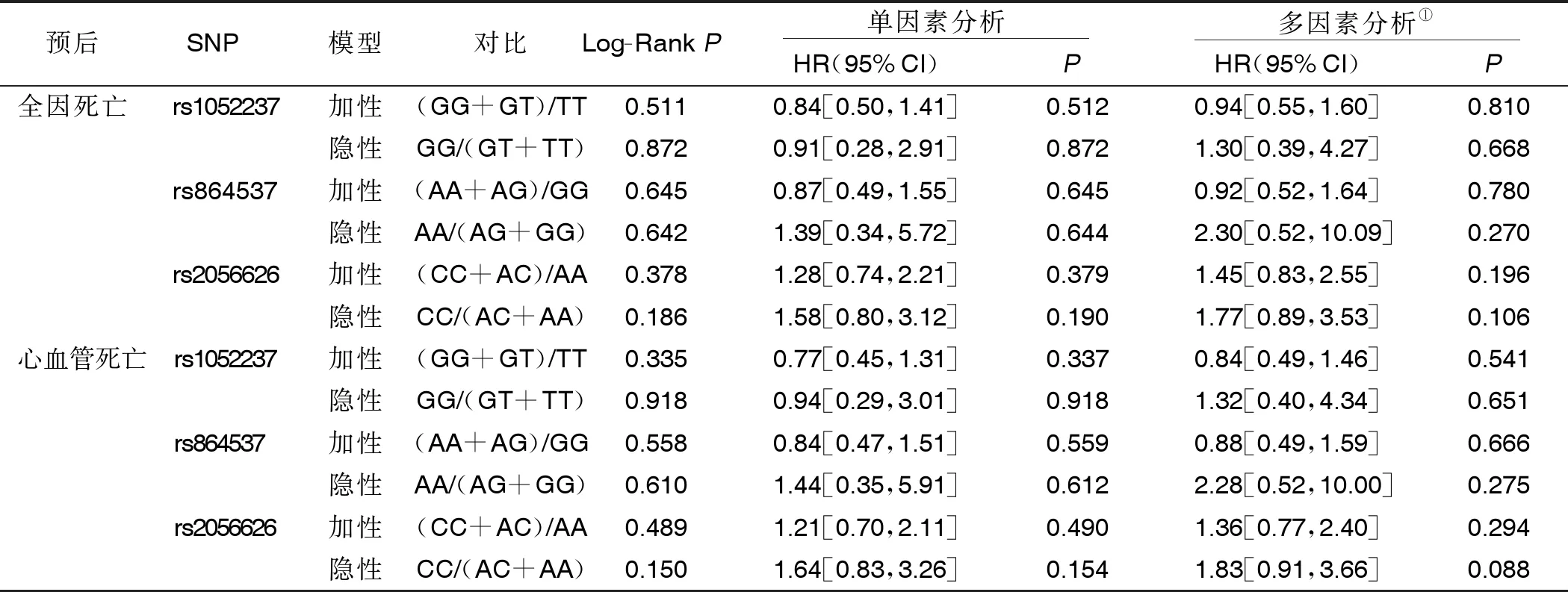
表6 CD247基因多态性对DCM病人预后的影响
3 讨 论
DCM是一种病因未明的自身免疫性疾病,有证据支持遗传因素在DCM易感性和进展中发挥着重要作用[11]。目前已知与主要组织相容性复合体(MHC)相关的基因与DCM相关,但可解释疾病易感性的遗传贡献低于50%[11]。因此,利用全基因组筛查或候选基因方法鉴定新型DCM易感性基因是目前的研究热点。CD247是T细胞受体(TCR)信号级联的关键组成部分,对TCR-CD3复合物的组装和表面表达重要[7]。有研究表明,所有TCR亚单位中,只有CD247的表达被特异性下调,且这些T细胞影响了TCR介导的功能[12]。考虑到CD247在T细胞反应及自身免疫性疾病中的作用,为阐明该基因在DCM易感性中的作用,有必要分析DCM病人的CD247基因多态性。本研究发现:rs1052237的G变体和rs2056626的C变体可能与DCM的低易感性有关;rs864537的AA基因型可能与DCM病人的LVEF降低有关。
具有rs1052237的G变体DCM病人血清CD247水平较低,但在健康受试者中并非如此,表明该SNP可能仅在病理状态下通过影响CD247基因的表达而发挥作用。rs1052237位于CD247基因的近5′基因区域,其确切功能尚未明确,且其是否影响DCM疾病状态下的蛋白质表达和功能有待进一步分析。
SNP rs2056626的次要等位基因与DCM的低易感性有关,其位于N端重复结构域之一,表明其可能参与了TCR信号的调节[13]。有研究显示,C等位基因的携带与类风湿性关节炎病人滑膜T细胞表面CD3ζ密度降低有关[13]。本研究中DCM rs2056626基因型病人血清CD247水平比较差异无统计学意义,推测是由于血清CD247水平不仅与基因型有关,而且与类风湿性关节炎和DCM病人不同的疾病状态和病理过程有关。虽然SNP rs2056626的变异未改变血清CD247水平,但不能排除其可能通过改变心肌CD247的组织水平影响疾病易感性,需在今后研究中得到证实。有研究显示,SNP rs864537的遗传变异可改变一般人群血清CD247水平[14]。本研究结果显示,这些变体与DCM病人中较低的CD247水平相关,且进一步分析表明,rs864537的次要变异A等位基因与较低的LVEF相关,与血清水平变化一致。
尽管血清CD247水平是心力衰竭预后的独立危险因素[15],但本研究中的生存分析未发现CD247基因多态性与DCM的预后的关联,提示基因突变并非是决定CD247血清水平的唯一因素,CD247水平由疾病严重程度决定。
本研究的局限性:与DCM易感性相关的显著CD247基因多态性,但不能排除假阳性结果,遗传分析中的统计显著性较小,因此今后在独立样本集中进行重复研究以确认结果;未评估组织中CD247基因表达,因此不能从本研究中确认CD247基因中的显著SNP影响了心脏组织的基因表达并直接参与了纤维化和炎症;未进行功能分析CD247基因中突变等位基因的影响,无法阐明CD247基因多态性与DCM关联的确切机制;本研究是一项以医院为基础的病例对照/队列研究,选择偏倚是不可避免的。
总之,本研究为CD247基因与DCM的潜在临床关联提供了一些依据,需进行全面的分析以确认本研究的结果是合理的。今后需探讨SNP潜在的细胞生物学机制。

