骨恶性肿瘤 RANKL 表达分析及地舒单抗疗效观察
王君 鲍其远 彭程 温竣翔 沈宇辉 张伟滨 杨孝清
骨原发恶性肿瘤是一组具有高度异质性的恶性肿瘤,其包含 50 多种病理亚型,临床特征及生物学行为各不相同[1]。骨原发恶性肿瘤一旦发生远处转移,往往对传统化疗及放疗敏感性欠佳,缺乏有效治疗手段,临床预后较差[2-3]。近年来,随着对肿瘤微环境研究的不断深入,针对肿瘤微环境相关靶点设计的分子靶向治疗药物相继问世,采用靶向药物治疗进展期难治性骨原发恶性肿瘤已成为目前国内外临床研究的热点。
骨保护素 (osteoprotegerin,OPG)、核因子-κB受体活化因子 (receptor activator of NF-κB,RANK)及核因子-κB 受体活化因子配体 (receptor activator of NF-κB ligand,RANKL) 是近年发现的属于肿瘤坏死因子家族的细胞因子。其中 RANKL 是表达于淋巴组织及成骨细胞表面的一种膜蛋白,其可通过 RANKL / RANK / OPG 信号通路活化破骨细胞(osteoclast),加速骨质破坏和异常吸收,导致骨组织发生溶骨性破坏[4]。目前已知,RANKL 也高表达于多种骨转移性肿瘤中,RANKL / RANK / OPG 系统激活介导的骨质破坏是各种常见实体肿瘤发生骨转移并形成骨性破坏的必要条件。通过靶向阻断RANKL 信号通路已成为目前临床上有效治疗骨转移性肿瘤的重要方法之一[4]。然而对于骨原发恶性肿瘤,特别是其肺转移病灶微环境内的 RANKL 表达情况研究甚少,RANKL 在骨原发恶性肿瘤肺转移中是否可作为潜在的治疗靶点尚不得而知。本研究回顾分析了本中心骨原发恶性肿瘤肺转移病灶内 RANKL表达水平及其影响因素,以观察进展期难治性骨原发恶性肿瘤患者接受 RANKL 抑制剂地舒单抗治疗的临床疗效,探讨 RANKL 在骨肿瘤肺转移中的潜在价值。
资料与方法
一、纳入标准与排除标准
1.纳入标准:(1) 2018 年 1 月至 2021 年 12月,在我院手术切除原发恶性骨肿瘤肺转移者;(2) 既往接受手术及正规一线治疗者;(3) 原发灶、转移灶手术后病理检查符合骨肿瘤肺转移者;(4)临床资料完整,具有较好质量的病理石蜡标本可进行免疫组化染色研究者。
2.排除标准:(1) 临床及病理资料缺失者;(2)术后病理结果证实非骨与软组织肿瘤者;(3) 肺转移合并肺部感染、脓胸、肺大泡或者其它严重肺部疾病者。
二、临床资料及样本
本研究为回顾性观察性研究,相关伦理通过我院审批 (伦理编号:[ 2020 ]临伦审第 [ 409 ]号)。
本研究共纳入 39 例患者的标本,其中 31 例骨肿瘤组织标本,8 例原发病灶标本。所有患者均常规接受化疗联合靶向的综合治疗。术后定期行胸部 CT、肝胆 B 超、血清肿瘤标志物、骨手术区域 MRI 检查,直至患者死亡或失访。患者临床资料包括年龄,性别,既往治疗线数,既往是否接受放射治疗,美国东部肿瘤协作组 (Eastern Cooperative Oncology Group,ECOG) 体能状态评分,肿瘤受累部位,标本取材部位,病灶数量,病理类型。每次患者随访常规进行肺部薄层 CT 检查,并记录患者的靶向治疗方案、再次进展时间、总生存期等。肿瘤病灶疗效的影像学评估采用实体肿瘤的疗效评价标准1.1 版 (RECIST 1.1),并计算患者的疾病无进展生存期 (progression-free survival,PFS)。PFS 定义为从复发转移确诊后开始接受靶向治疗日期,至肿瘤进展、死亡或最后一次随访日期间的时间,以先达到者为准。
三、肿瘤基因表达检测
所有肿瘤样本委托武汉良培基因生物公司 (中国,武汉) 采用 Trizol 法提取肿瘤 RNA 并进行全转录组建库及二代测序 (next generation sequencing,NGS)。全转录组建库采用 KAPA RNA HyperPrep Kit with RiboErase (KAPA # KK8481, Roche, 美国) 并依照说明书步骤进行操作。首先,采用寡核苷酸探针杂交对样本进行 rRNA 去除,通过 PCR 合成第一链 (25 ℃,10 min,42 ℃,15 min,70 ℃,15 min,4 ℃,hold) 及合成第二链 (16 ℃,30 min,62 ℃,10 min,4 ℃,hold)。然后依次进行接头连接、纯化及文库扩增并进行文库纯化。最后使用 Qubit 2.0(ThermoFisher,美国) 对文库进行定量,并通过Bioanalyzer (Agilent,美国) 分析仪对文库片段分布进行检测。最终采用 illumina Hiseq2500 平台对文库进行双末端长度 150 bp (PE 150) 进行测序。测序后下机数据首先采用 cutadapt (v 1.2.1) 进行去接头及质控过滤,过滤后数据采用 STAR 软件依据 Hg18版本人类参考基因组进行比对,并通过 RSEM 软件进行 RNA 表达定量,结果通过 TPM (transcripts per million) 方式进行标准化处理分析。
由于既往缺乏骨肿瘤肺转移灶 RANKL 表达的公认标准,本研究以骨肿瘤原位灶作为参考,将肺转移灶 RANKL 表达接近骨原发病灶表达水平者称为“中等表达”,显著高于该水平者称为“高表达”,而显著低于该水平者称为“低表达”。肿瘤内免疫细胞浸润评估及巨噬细胞表型分析采用CIBERSORT 软件[5]。考虑到本研究中组织标本数量有限,同时从 TARGET 数据库 (https://ocg.cancer.gov/programs/target/projects/osteosarcoma) 中获取88 例骨肉瘤原位病灶转录组 NGS 数据,从 GTex 数据库 (www.gtexportal.org/) 获得正常骨组织及肺组织的转录组 NGS 数据,作为参考对照。对于转录组 NGS 提示 RANKL 高表达的标本,采用免疫组化染色进一步验证,并判定 RANKL 表达的主要细胞类型。免疫组化染色标本首先经 10% 中性甲醛固定并予以常规脱水,石蜡包埋,4 μm 厚切片,继而对标本进行苏木精 - 伊红染色 (HE),同时连续切片采用 EnVision 二步法进行免疫组织化学染色,所用抗体 CD68、RANKL、CD31 和 Ki67 均购自 Dako公司。
四、统计学处理
本研究使用 SPSS 26.0 版 (IBM,纽约,美国)对数据进行分析。分类变量采用频数及百分比表示患者流行病学特征。使用 Spearman 方法分析连续变量间相关性,利用 Kaplan-Meier 生存曲线进行生存分析,并用 Log-rank 检验分析组间差异及 95% 置信区间 (95%CI)。本研究中,RANKL 表达水平采用转录组二代测序结果 (TPM) 进行定量分析,为了分析 RANKL 表达在不同临床亚组之间表达差异,进一步采用广义线性回归模型进行单因素分析,评估不同临床因素 (如年龄、性别、病灶数量等) 对于RANKL 表达的预测效应值 (Beta 值),并绘制相应森林图进行亚组比较。P< 0.05 为差异有统计学意义,考虑到本研究样本量相对有限,笔者认为P值接近 0.05 可判定为接近有统计学意义。在评估骨恶性肿瘤肺转移使用地舒单抗治疗的临床疗效中,本研究参考了既往进展期骨肿瘤历史对照对于 PFS 进行评估[6],若药物治疗的中位 PFS 超过 12 周则视为具有潜在临床疗效,反之则认为并不优于历史对照,临床疗效意义不明。
结 果
一、一般资料
本组 39 例中,男 27 例,女 12 例;≥ 20 岁者 17 例,< 20 岁者 22 例。病理类型包括骨肉瘤34 例,尤文肉瘤 3 例,骨未分化肉瘤 2 例。以 39 例肿瘤标本获取时间计算,21 例为抗血管靶向药物治疗期间 (包括阿帕替尼 17 例,帕唑帕尼 3 例,安罗替尼 1 例),10 例为抗血管靶向药物治疗耐药后(包括阿帕替尼 9 例,安罗替尼 1 例),8 例无靶向治疗。39 例中,21 例既往接受 1 种化疗方案,16 例接受 2 种化疗方案,2 例接受 3 种化疗方案。除了 2 例曾接受过放疗外,其余患者未接受放疗。31 例复发转移者中,24 例病灶数量超过 5 枚,其余患者复发转移灶在 1~5 枚之间。39 例病灶的累及部位包括肺 (7 例),骨与肺 (30 例),骨及肺合并淋巴结转移 (2 例) (表1)。
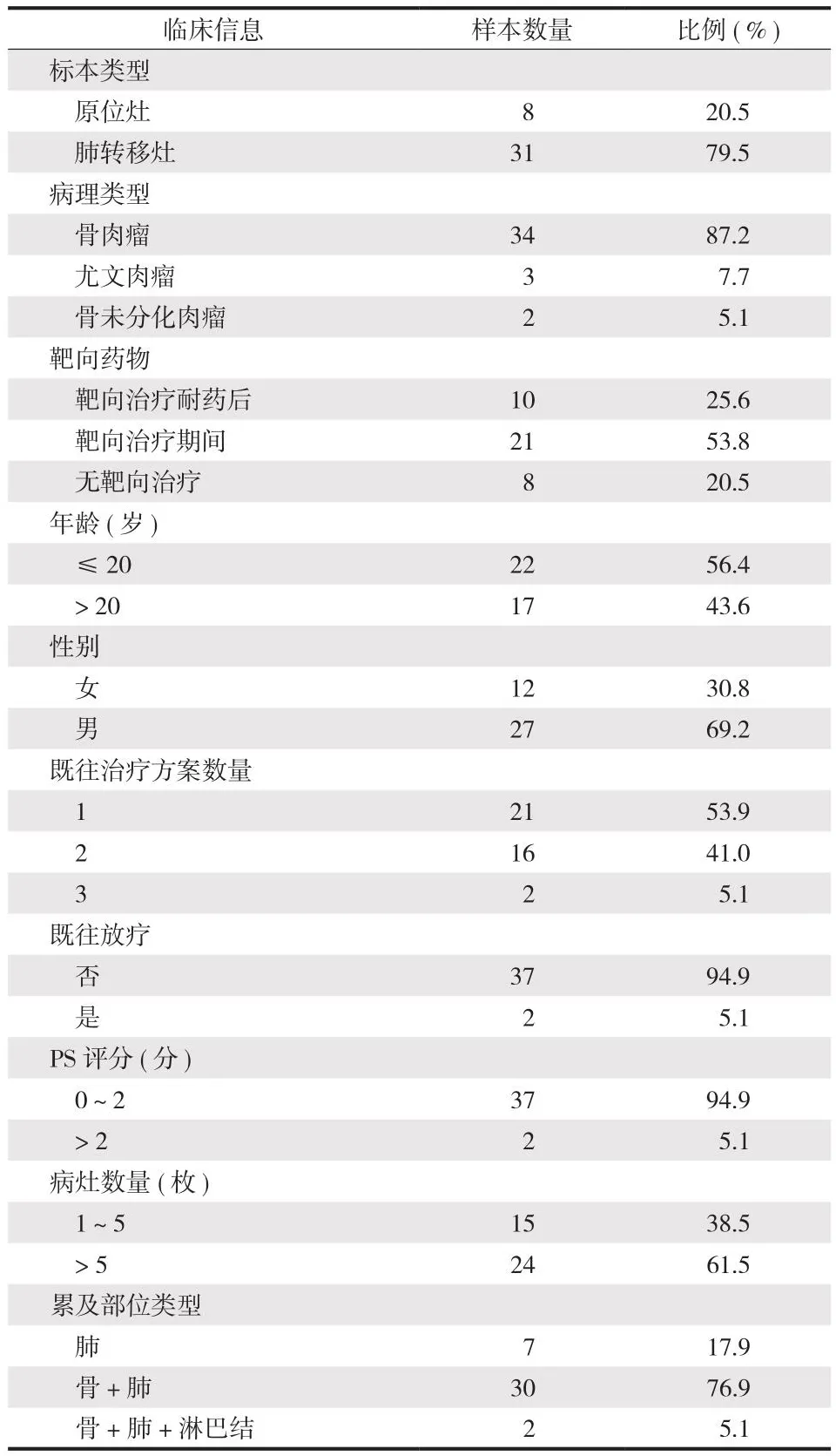
表1 患者一般资料及样本信息Tab.1 The general clinicopathological characteristics of the patients
二、骨肿瘤肺转移标本 RANKL 表达分析
本研究对 31 例骨肿瘤肺转移标本及 8 例骨肿瘤原位灶标本进行全转录组测序,分析 RANKL 基因表达水平,并将分析结果与公共数据库数据相互比较。结果提示,RANKL 在正常肺和正常骨组织中不表达,与 TARGET 数据库中骨肉瘤类似。本组病例中骨肿瘤原发病灶内 RANKL 呈较高表达,而骨肿瘤肺转移总体呈现低表达,少部分样本呈现高表达 (图1)。标本中 RANKL 表达水平与肿瘤内巨噬细胞比例呈现显著性正相关 (R= 0.445,P= 0.004)(图2)。本研究对骨肿瘤肺转移高表达患者的RANKL 标本进行免疫组化验证,结果提示 RANKL阳性标记细胞主要位于单核 - 巨噬细胞 (CD68 标记),少部分散在分布于肿瘤间质内,肿瘤细胞表面未见明显 RANKL 表达 (图3)。为了进一步观察 RANKL 表达与肿瘤微环境内巨噬细胞的潜在联系,根据基因表达谱特征将肿瘤相关巨噬细胞分为M0、M1、M2 3 种表型。与 RANKL 低表达 (低于中位值) 组相比,RANKL 高表达 (高于中位值) 组标本中 M0 及 M2 型巨噬细胞浸润程度显著增加 (P<0.05),而 M1 型巨噬细胞浸润程度差异无统计学意义 (P= 0.74) (图4)。

图1 骨原发恶性肿瘤 RANKL 表达情况分析 31 例骨肿瘤肺转移标本、8 例骨肿瘤原位灶标本以及公共数据库中骨肉瘤及正常对照组织的 RANKL 表达情况Fig.1 Analysis of RANKL expression of primary bone malignancy The expression of RANKL in 31 lung metastatic lesions, 8 primary lesions of bone malignancy as well as the osteosarcoma and control tissue in public database
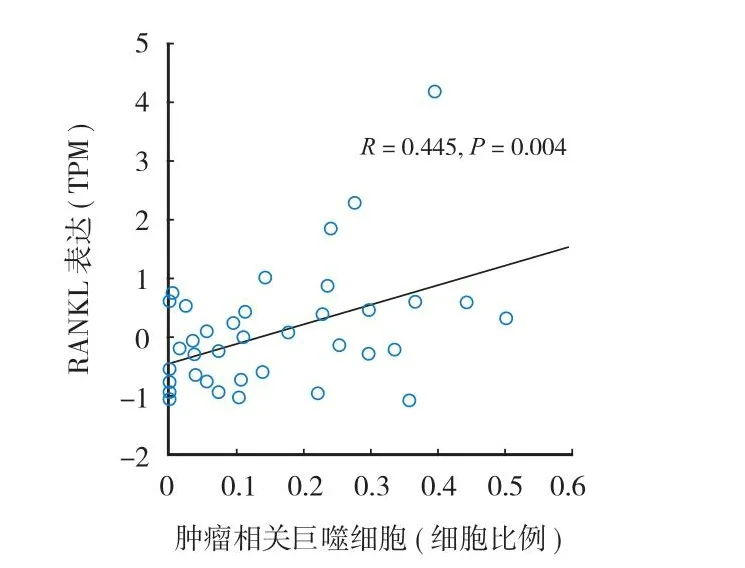
图2 骨原发恶性肿瘤 RANKL 表达与肿瘤内巨噬细胞浸润程度的相关性分析Fig.2 Correlation analysis of RANKL expression and intratumor macrophage infiltration in primary bone malignancy
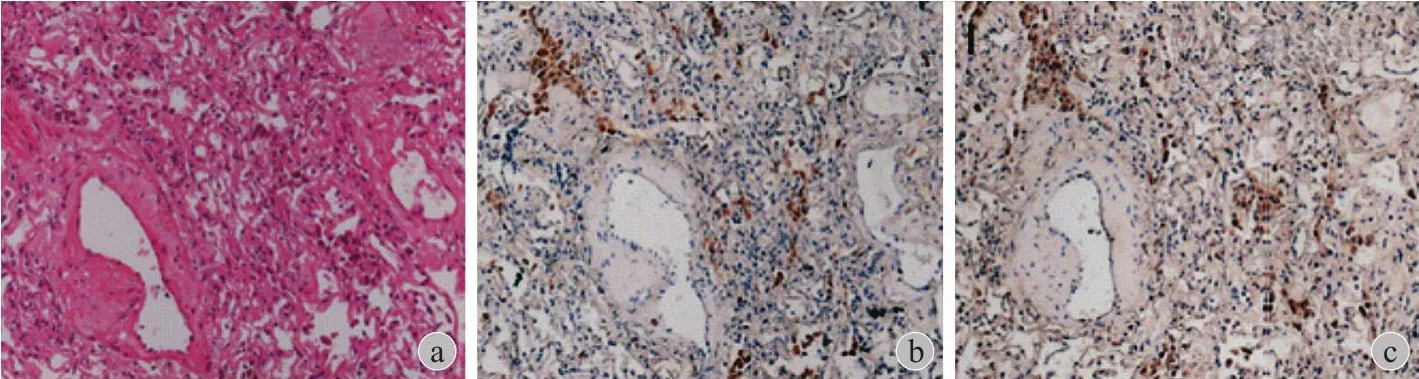
图3 骨原发恶性肿瘤 RANKL 表达病理学观察 骨肉瘤肺转移标本 a (HE×200)、b (RANKL×200)、c (CD68×200) 的免疫组化(IHC) 染色,可见骨肉瘤转移灶的瘤床区域存在明显 CD68 (巨噬细胞) 及 RANKL 表达共定位现象Fig.3 Pathological evaluation of RANKL expression in primary bone malignancy The HE staining × 200 (a), and immunohistochemistry of RANKL × 200 (b), CD68 × 200 (c) in lung metastatic lesions of osteosarcoma.Co-localization of CD68 (macrophages) and RANKL was observed in the tumor bed of metastatic osteosarcoma
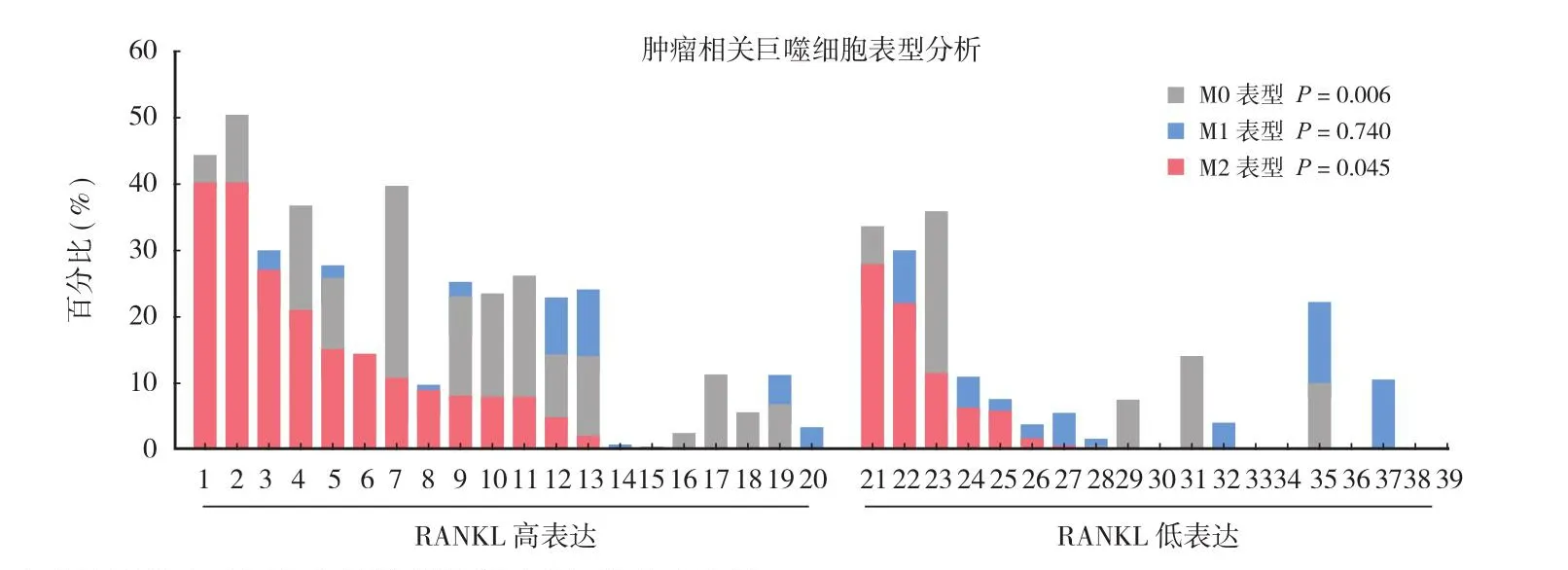
图4 RANKL 高表达及低表达标本之间肿瘤相关巨噬细胞表型比较Fig.4 The phenotype comparison of tumor associated macrophages between high- and low- RANKL expression samples
三、骨肿瘤标本 RANKL 表达的影响因素
为了进一步明确骨原发恶性肿瘤 RANKL 表达的影响因素,进一步根据不同临床病理学因素对患者进行分组比较,观察不同亚组间 RANKL 表达差异是否具有统计学意义。本研究结果,显示肿瘤内RANKL 表达在不同年龄、性别、病理类型、病灶数量以及 ECOG 评分患者间差异无统计学意义 (P>0.05),然而与靶向治疗期间患者相比,靶向药物耐药后病灶内 RANKL 表达显著升高 (P= 0.001);此外,既往接受多种化疗患者与仅接受一线化疗者相比,病灶内 RANKL 表达呈现升高趋势并接近差异有统计学意义 (P= 0.063)。相反,既往接受放疗患者与未接受者相比,肿瘤内 RANKL 表达无明显改变(图5)。该结果提示,骨原发恶性肿瘤内 RANKL 升高可能与多种化疗耐药及靶向药物耐药有关。
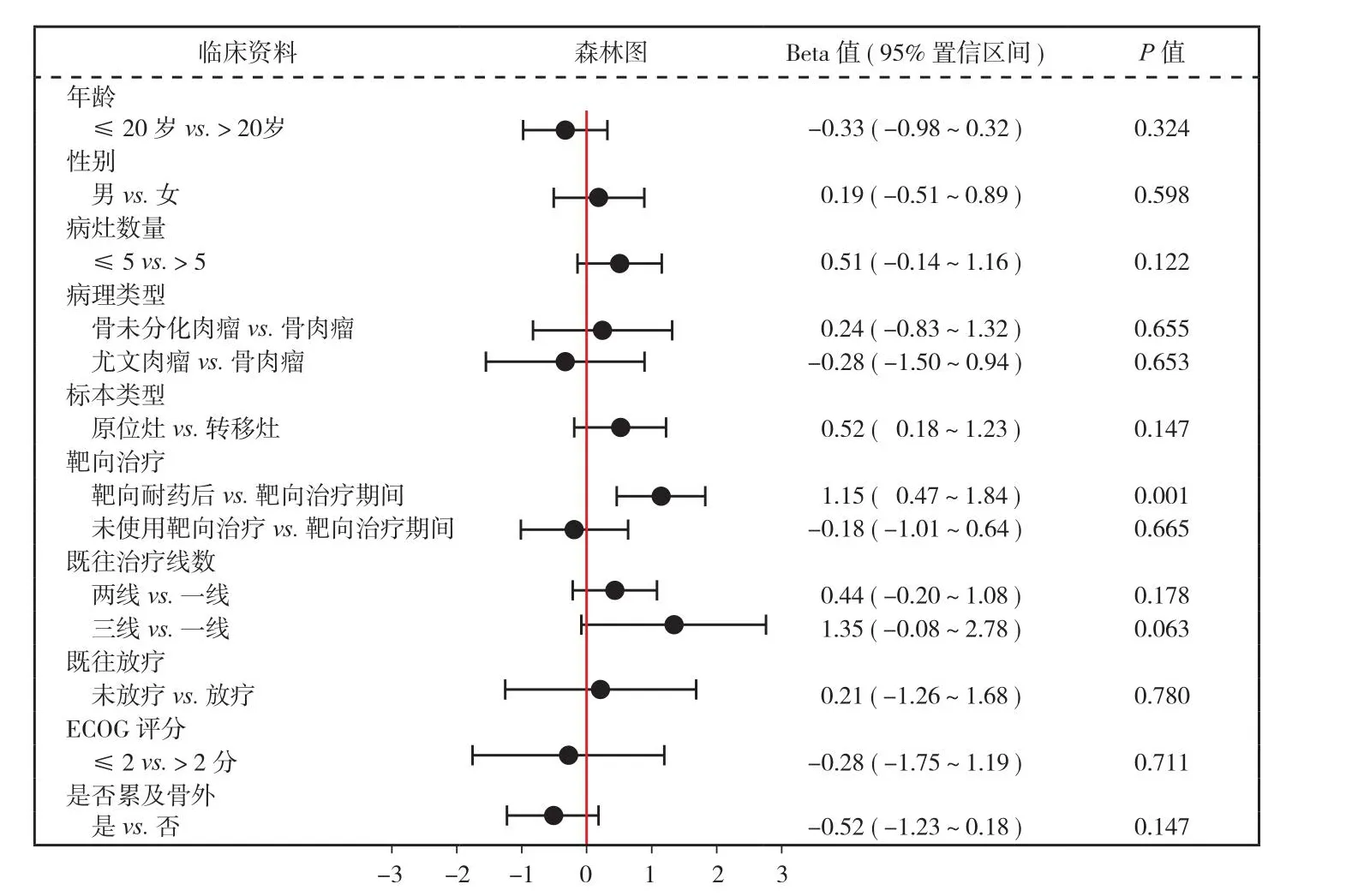
图5 骨原发恶性肿瘤 RANKL 表达根据不同临床病理因素进行亚组分析Fig.5 Subgroup analysis of RANKL expression in primary bone malignancy according to the clinicopathological factors
四、骨肿瘤肺转移 RANKL 抑制剂疗效观察
为进一步明确 RANKL 抑制剂地舒单抗对于骨肿瘤肺转移是否具有临床疗效,本研究观察了 14 例应用地舒单抗后的 (PFS),包括骨肉瘤肺转移患者10 例,骨未分化肉瘤肺转移患者 2 例,尤文肉瘤及软骨肉瘤肺转移患者各 1 例。其中 8 例为抗血管靶向药物耐药后联合使用地舒单抗药物治疗,6 例为地舒单抗联合抗血管靶向药物作为初始治疗。14 例中 5 例有肺转移标本,其中 4 例为 RANKL 高表达,1 例为 RANKL 低表达。影像学评估结果提示,地舒单抗治疗在骨肿瘤肺转移总人群 (n= 14) 的中位PFS 为 2.87 个月,其中骨肉瘤患者 (n= 10) 的中位PFS 为 2.82 个月,与对照相比,其疗效并无显著临床意义。由于本研究上述结果提示 RANKL 表达在靶向治疗耐药患者中显著升高,本研究进一步观察了骨肿瘤肺转移中,靶向治疗耐药患者 (n= 8) 及RANKL 高表达患者 (n= 4) 的治疗效果。本研究结果显示,骨肿瘤肺转移靶向治疗耐药后联合地舒单抗治疗后 PFS 时间位于 2.5~11.7 个月,平均 3.5 个月 (图6a)。在 RANKL 高表达的 4 例中,中位 PFS更是长达 8 个月,而 RANKL 低表达的 1 例 PFS 仅为 2.5 个月 (图6b)。该结果提示 RANKL 抑制剂对于骨肿瘤肺转移患者中靶向治疗耐药患者和 RANKL高表达患者可能具有一定潜在临床价值,其有待进一步验证。
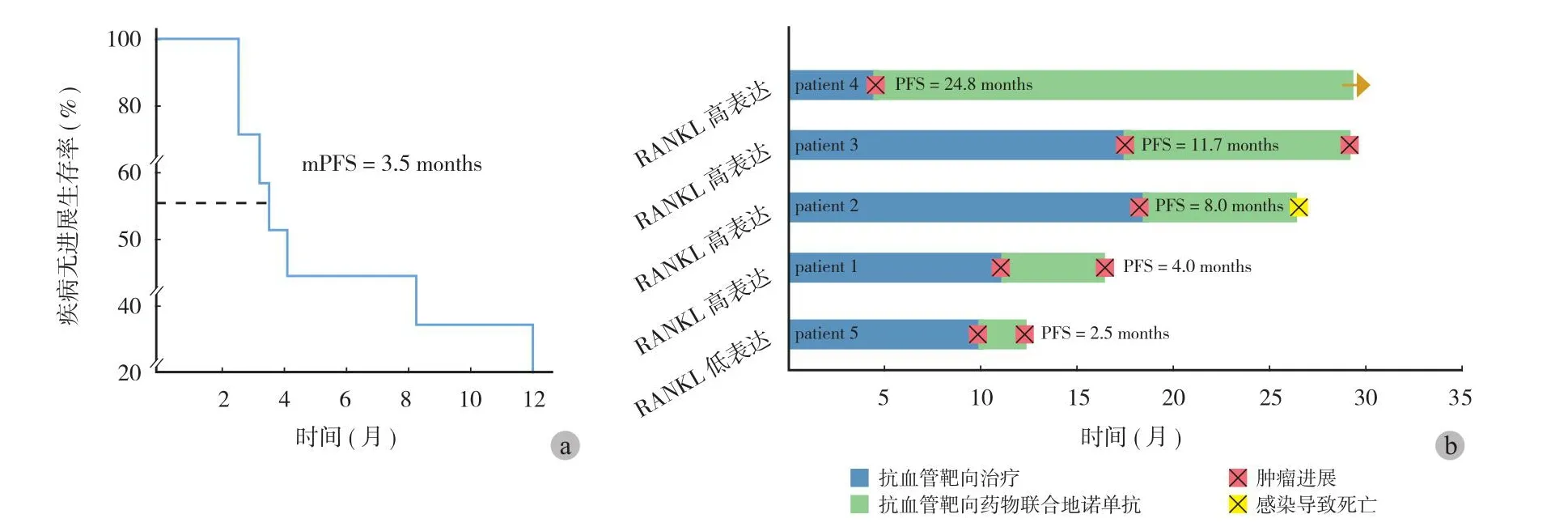
图6 骨肿瘤肺转移患者联合 RANKL 抑制剂的疗效观察 a:7 例骨肿瘤肺转移患者发生靶向药物耐药后联合 RANKL 抑制剂治疗后的PFS;b:5 例骨肉类肺转移患者病灶 RANKL 表达与临床疗效的相关性Fig.6 The efficacy of RANKL inhibitor in patients with lung metastatic bone malignancy a: The progression-free survival (PFS) of 7 patients with lung metastatic bone malignancy who developed secondary resistance to targeted agents; b: The correlation of RANKL expression and clinical efficacy in 5 patients with lung metastatic osteosarcoma
图7 示 1 例二线化疗耐药的骨肉瘤肺转移患者(2 号患者) 影像学资料,抗血管靶向治疗 (阿帕替尼) 前其肺部转移灶从 1.0 cm (2018 年 7 月) 缓慢增大至 2.5 cm (2019 年 5 月)。该患者 2018 年 7 月肺部转移灶切除术后病灶免疫组化及转录组 NGS 结果提示 RANKL 高表达,从 2019 年 5 月起,患者在原有阿帕替尼药物治疗基础上联合应用地舒单抗120 mg 每个月,肺部病灶持续稳定直至 2020 年 1 月(2.6 cm),患者死于肺部感染继发血液感染,PFS长达 8 个月。由于病例数较少,其感染发生是否与RANKL 治疗有关?尚待进一步确认。
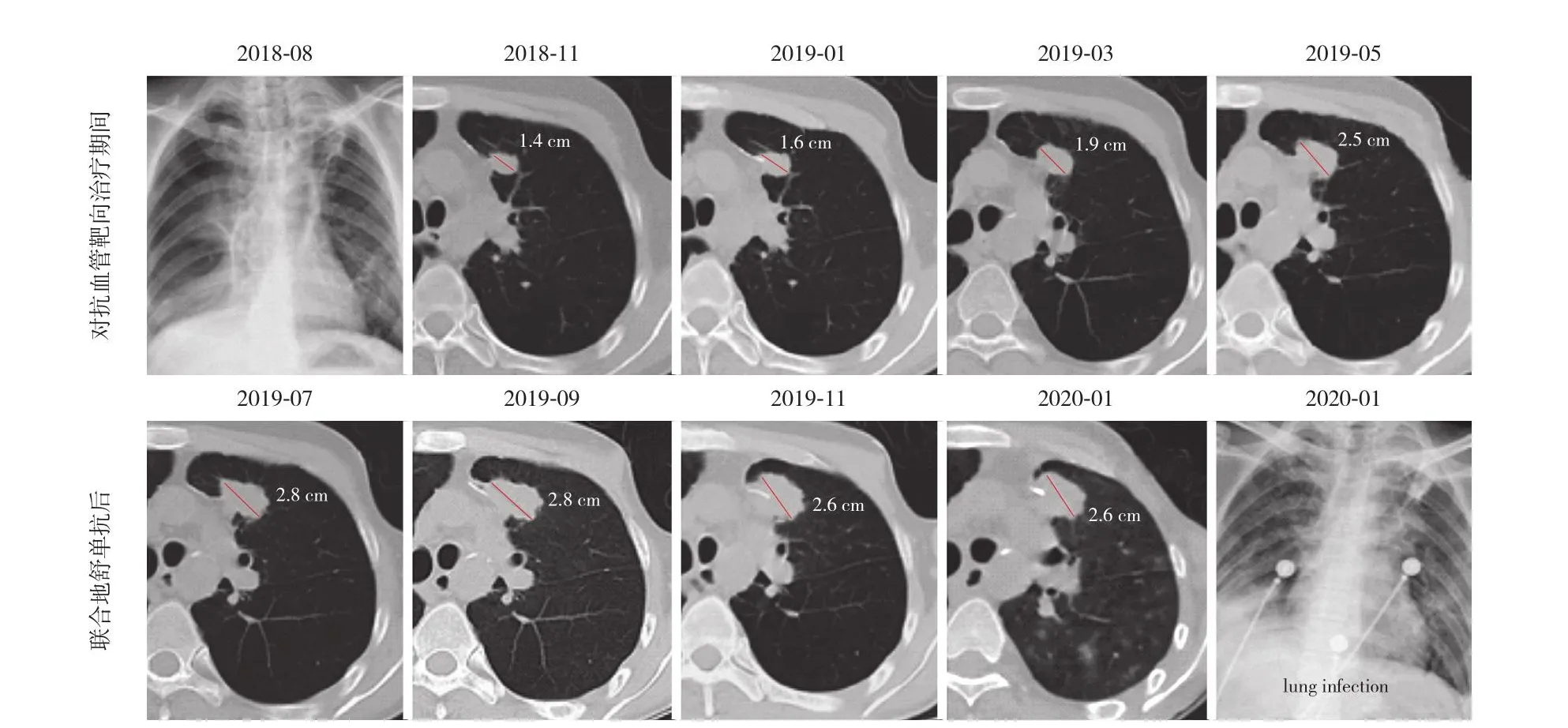
图7 1 例 RANKL 高表达患者发生靶向药物耐药后联合地舒单抗治疗的肿瘤影像学改变。如图中数字标注所示,患者转移瘤对抗血管靶向治疗产生耐药后于 2019 年 5 月开始联合 RANKL 抑制剂治疗,肿瘤体积稳定无明显进展。2020 年 1 月患者因肺部感染去世,X 线片所示,双肺可见多发渗出影Fig.7 The radiological evaluation of a patient of metastatic osteosarcoma with RANKL-high expression receiving RANKL inhibition therapy after developing resistance to anti-angiogenic targeted agent.As indicated by the measurement, the tumor progressed on anti-angiogenic therapy until May 2019 when RANKL inhibitor was added in combination.The tumor volumn then remained stable until the patients died of lung infection in Jan 2020.The chest X-ray demonstrated bilateral exudative change of lungs
讨 论
约 30%~50% 的骨原发恶性肿瘤经过一线治疗后发生药物抵抗及远处转移[7],临床预后较差[8],骨肿瘤远处转移目前仍缺乏有效治疗措施[8]。尽管 RANKL 抑制剂对于癌症骨转移显示出了一定的疗效,然而,其对于骨原发恶性肿瘤是否具有抗肿瘤效果?目前尚不明确。近年来,针对血管内皮表面的 VEGFR 的抗血管生成靶向药物已经对包括骨肉瘤在内的多种骨原发恶性肿瘤显示出一定的临床疗效[9],然而研究表明,靶向药物疗效往往仅持续4~6 个月,靶向治疗产生的继发性耐药问题是目前亟待解决的临床难点[10-11]。研究表明,骨原发恶性肿瘤内富含肿瘤相关巨噬细胞[12],其接受化疗及抗血管靶向治疗后可诱导形成肿瘤内低氧环境[13],后者可通过 Semaphorin 3A / Neuropilin-1 信号通路进一步诱导并招募单核 - 巨噬细胞局部浸润[14],同时肿瘤内的低氧微环境可以改变巨噬细胞表型,使其从抗肿瘤的 M1 表型转换为促肿瘤的 M2 表型,M2 型巨噬细胞可进一步招募免疫抑制相关的 Treg 及 Th2细胞[15],抑制免疫激活相关的 NK 细胞及 Th1 细胞[16],从而促进肿瘤转移灶的形成和发展[17]。
以往认为,癌症骨转移时,肿瘤细胞通过RANKL / RANK 信号通路激活破骨细胞,诱导其释放溶骨性因子,诱导局部形成有利于肿瘤细胞生长的微环境,即“恶性循环理论”[18]。尽管有研究发现骨肉瘤肿瘤内破骨细胞含量与其肿瘤侵袭性[19]及临床预后有关[20],既往一项大规模临床试验 (OS2006 试验) 研究结果提示,加入破骨细胞抑制药物唑来膦酸并不能改善骨肉瘤一线化疗的临床疗效[21],据此认为,RANKL / RANK 信号通路在骨原发恶性肿瘤中发挥的作用可能不同于骨转移性肿瘤。目前研究发现,骨肉瘤作为最为常见的骨原发恶性肿瘤,是一种富含巨噬细胞的肿瘤。米伐木肽(Mifamurtide) 作为一种非特异性的巨噬细胞和 T 细胞激动剂,其对预防骨肉瘤发生肺转移显示出了一定的临床疗效[22],然而其对于已经形成的远处转移灶是否同样具有抑制作用尚不得而知。目前研究表明,靶向干预巨噬细胞表面 CD47[23],CCL2[24]以及CSF1R[25]分子可抑制 M2 型巨噬细胞形成,而靶向干预巨噬细胞表面 IL-10[26]及 CCR5[27]分子可能诱导肿瘤相关巨噬细胞由 M2 型向 M1 型转化,从而起到抗肿瘤作用。尽管有研究表明,RANKL / RANK通路也可能参与了皮肤癌症中肿瘤相关巨噬细胞的促肿瘤作用[15],然而相关研究仍处于初步阶段。本研究结果显示,RANKL 高表达患者肿瘤内巨噬细胞总量及 M2 型巨噬细胞显著增加,免疫组化提示RANKL 与巨噬细胞标记物 CD68 存在共定位现象,然而 RANKL 在机制上是否参与了骨肿瘤肺转移灶内的巨噬细胞调控尚有待进一步证实。
本研究首次报道了地舒单抗可能对抗血管靶向治疗继发耐药后的骨肉瘤肺转移具有一定临床疗效。既往文献曾报道 1 例索拉菲尼联合地舒单抗治疗骨肉瘤脊柱转移有效的病例报道[28],然而由于肺是骨肉瘤转移最为常见的靶器官,该病例的治疗经验能否推广至骨肉瘤肺转移仍值得商榷。本研究纳入的 14 例骨肿瘤患者均有肺转移,接受 RANKL 抑制剂地舒单抗治疗后,本研究结果显示,对于抗血管靶向治疗耐药后加入 RANKL 抑制剂,进行联合治疗可能逆转靶向药物耐药,通过潜在协同作用推迟转移瘤进展。其机制可能与靶向药物继发耐药后局部 RANKL 表达升高以及 M2 型肿瘤相关巨噬细胞增加有关。此外,本研究结果显示骨肉瘤肺转移病灶的 RANKL 表达具有较大的患者间异质性,其在大部分患者中表现为低表达,而其在少数患者中可呈现高表达,甚至超过骨原发病灶,该现象可能解释了为何 RANKL 抑制剂对于骨肿瘤肺转移患者总体人群疗效欠佳,但部分患者的疗效显著 (图6)。本组发现 4 例肺转移灶 RANKL 高表达的患者对地舒单抗联合治疗均显示出较为理想的临床疗效,而 1 例RANKL 低表达患者疗效不佳。该现象提示肺转移病灶内 RANKL 表达情况可能是地舒单抗敏感性的潜在生物标志物。
综上所述,本研究发现 RANKL 在骨肿瘤肺转移标本中呈现总体低表达,少部分高表达趋势。病灶内 RANKL 高表达与肿瘤相关巨噬细胞及 M2 型巨噬细胞浸润水平有关。与骨肿瘤肺转移患者总体相较而言,抗血管靶向药物耐药及病灶 RANKL 高表达的患者亚组可能是 RANKL 抑制剂治疗敏感的优势人群。须指出的是,由于本组病例样本量较小,该结论尚待大规模研究进一步确认;此外,RANKL 抑制剂对于骨肿瘤肺转移病灶靶向药物耐药产生疗效的潜在机制值得进一步研究。

