HBV核酸血筛试剂国家参考品的研制
李克坚,郝晓甜,周诚
中国食品药品检定研究院传染病诊断一室,北京 100050
乙型肝炎病毒(hepatitis B virus,HBV)感染呈世界性分布,全世界约有2.57 亿人感染HBV[1-2],我国为肝病大国,2019 年中国疾病预防控制中心统计数据显示,在乙类传染病中,病毒性肝炎的报告发病率位列首位,报告死亡率位列第三,其中HBV 报告发病率为71.77/10 万[3]。HBV 传播途径与丙型肝炎病毒(hepatitis C virus,HCV)和人类免疫缺陷病毒(human immunodeficiency virus,HIV)相同,主要是通过接触受感染的血液或血液制品、某些体液或组织,以及母婴传播,HBV、HCV 和HIV 均为输血相关的重要病原体[4-7]。我国血站、浆站用于从献血者采集的血浆和血清样本中进行血液筛查的HBV、HCV及HIV 核酸检测试剂为乙型肝炎病毒丙型肝炎病毒人类免疫缺陷病毒核酸检测试剂盒(通常称HBVHCVHIV 核酸血筛试剂盒),根据国家药品管理办法[8],该品种按药品管理,实行批签发。本文研制了HBV 核酸血筛试剂国家参考品,用于HBVHCVHIV 核酸联检血筛试剂盒检测中,为我国HBV 核酸血筛试剂的质量控制和标准化提供依据。
1 材料与方法
1.1 样品 从上海、甘肃、河南、湖南、湖北等地域的血液中心、浆站、生物制品公司等收集到的多份人HBV抗体阳性或HBV感染者血浆样品,为本室库存。
1.2 现行HBV DNA标准品 第四代WHOHBVDNA国际标准品(4th WHO International Standard for HBV DNA forNAT,NIBSCcode:10/266),定量值为955000IU/mL,对数值为5.98 lgIU/mL;HBV DNA 国家标准品(批号:340021-201701),定量值为1.0 × 108IU/mL,对数值为8.0 lgIU/mL。
1.3 主要试剂 乙型肝炎病毒核酸检测试剂盒(荧光PCR 法)为罗氏诊断产品(上海)有限公司的Roche Diagnostics GmbH 产品;乙型肝炎病毒五项(HBsAg、HBsAb、HBeAg、HBeAb、HBcAb)测定试剂盒(化学发光微粒子免疫检测法)为北京东南悦达公司的雅培贸易(上海)有限公司产品;HBVHCVHIV 核酸血筛检测试剂为罗氏诊断产品(上海)有限公司的cobas®Taq Screen MPX Test(cobas s 201 系统)产品及上药康德乐(上海)医药有限公司代理销售的Grifols Diagnostic Solutions Inc.产品,ProcleixUltrio Elite Assay。
1.4 HBV DNA参考品候选品的筛选 将收集的血浆样品进行HBV五项检测、HBV DNA检测及HBVHCV HIV 核酸血筛检测,选择HBsAb 抗体水平较高、HBV DNA 结果为阴性的样品作为阴性参考品候选品;选择HBV DNA 检测结果为阳性的样品作为阳性参考品候选品。
1.5 最低检出量(limit of detection,LOD)参考品的制备 取2支第四代WHO HBV DNA 国际标准品(每支加0.5 mL无菌水溶解后,浓度为9.55×105IU/mL),用人无HBV DNA、HCV RNA、HIV RNA 及HBV 五项全阴性血(本室库存临床血浆样本)进行10倍系列稀释,共4 个浓度梯度,作为标准待测定;同时,取1 支HBV DNA 国家标准品,用相同的人HBV DNA、HCV RNA、HIV RNA及HBV五项全阴性血,进行10倍系列稀释至1.0×103IU/mL,作为LOD 参考品候选品。将上述两种稀释好的样品同时进行HBV DNA 测定;以国际标准品为定量标准,绘制标准曲线,根据标准曲线计算LOD 参考品候选品中HBV DNA 含量。计算方法①:将WHO 国际标准品系列稀释实测值与其理论浓度绘图,根据得到的方程,计算LOD 参考品3个实测值均值相对该WHO 国际标准品的相对浓度值;计算方法②:将WHO 国际标准品及待标定LOD参考品浓度均值进行比较,计算待标品相对该WHO国际标准品的相对浓度值。
1.6 HBV 核酸参考品候选品的协作标定 将上述HBV 核酸血筛国家阴性及阳性参考品候选品、1 支LOD 参考品待标品,分发至8 家企业实验室(编号为①~⑧),分别进行HBVHCVHIV核酸血筛联检测定。
1.7 阴性参考品及阳性参考品的定量测定 将上述标定后筛选出的阴性及阳性参考品,分别用罗氏诊断产品(上海)有限公司的HBV DNA 检测试剂、湖南圣湘生物科技有限公司的HCV RNA 检测试剂及北京万泰生物药业股份有限公司的HIV RNA检测试剂,进行病毒核酸载量检测;同时,验证标定分装后结果是否正确。
1.8 均匀性考察 分别随机抽取分装过程中前、中、后的阳性参考品P1 ~P9及LOD 参考品分装样品,各2 支,分别测定HBV DNA 2 次,根据《中国药典》三部(2020 版)要求进行结果判定[9],采用SPSS 22[10]分别进行方差分析比较,以P<0.05为差异有统计学意义。
1.9 稳定性验证 根据生物制品稳定性试验指导原则,将参考盘中的阳性参考品P1 ~P9 及LOD 参考品分别按以下条件处理:反复冻融2、3、4 次;4 ℃放置2、3、4、5 d;室温保存16、24 h。用乙型肝炎病毒核酸检测试剂盒(荧光PCR 法)进行检测,重复3次,分别取均值(lgIU/mL),结果与存放于-80 ℃条件下的参考品进行比较,计算出绝对偏差,考察参考品的冻融稳定性及加速稳定性。
2 结果
2.1 HBV DNA参考品候选品的筛选
2.1.1 阴性参考品 共选择出18 份HBV、HCV、HIV均为阴性的样品作为阴性参考品候选品。
2.1.2 阳性参考品 共选择出18 份HBV 为阳性的样品作为阳性参考品候选品。
2.2 LOD参考品的标定 方法①计算结果:相对WHO国际标准品的浓度值为1.07 × 103IU/mL;方法②计算结果:相对WHO 国际标准品的浓度值为1.06×103IU/mL。最终,确定LOD 相对第四代WHO 国际标准品的浓度值为1×103IU/mL(n=3,CV为4.2%),作为HBV核酸血筛国家参考品LOD的定值。
2.3 HBV 核酸参考品候选品的协作标定 根据8 家企业实验室用HBVHCVHIV 核酸血筛试剂标定结果,18 份阴性参考品候选品均为阴性,从中选择出8份阴性参考品候选品,作为国家HBV 核酸血筛试剂国家阴性参考品(N1 ~N8)。18 份阳性参考品候选品标定结果均为HBV 阳性,从中选择出9 份阳性参考品,作为国家HBV 核酸血筛试剂国家阳性参考品(P1 ~P9)。
2.4 阴性参考品及阳性参考品的定量 阴性参考品HBV DNA、HCV RNA及HIV RNA病毒载量均为0 IU/mL。阳性参考品HBV DNA 病毒载量为103~105IU/mL,其中,P6、P9为HBV DNA及HCV RNA共感染样品;P1、P8为HBV DNA、HCV RNA 及HIV RNA 共感染样品。见表1。特别指出,该定量值仅作为验证存在HBV、HCV或HIV核酸,不能作为病毒定量标准值使用。

表1 HBV DNA、HCV RNA 及HIV RNA 3 种病毒载量测定(IU/mL)Tab.1 Determination of viral loads of HBV DNA,HCV RNA and HIV RNA(IU/mL)
2.5 均匀性 阳性参考品P1 ~P9 及LOD 参考品均匀性考察结果经方差分析,差异无统计学意义(P均>0.05),分组比较结果差异也无统计学意义(P均>0.05),见表2。表明分装均匀性好,分装的参考品支与支间无差异。

表2 均匀性分析Tab.2 Homogeneity analysis
2.6 参考品稳定性
2.6.1 反复冻融稳定性 分别与存放于-80 ℃条件下的相应参考品进行比较,绝对偏差均小于PCR 误差允许范围0.50 lgIU/mL,见表3。表明参考品反复冻融2 ~4次稳定性好。
表3 反复冻融的稳定性比较(lgIU/mL,,n=3)Tab.3 Comparison of stability of repeated freeze-thaw measurements(lgIU/mL,,n=3)

表3 反复冻融的稳定性比较(lgIU/mL,,n=3)Tab.3 Comparison of stability of repeated freeze-thaw measurements(lgIU/mL,,n=3)
参考品LOD P1 P2 P3 P4 P5 P6 P7 P8 P9-80 ℃保存3.06 4.75 4.88 4.12 5.25 4.60 4.73 4.81 3.99 5.49冻融2次0.01 0.05-0.05-0.04-0.01-0.02-0.01 0.07-0.06-0.05冻融3次0.00 0.07-0.07 0.00-0.03 0.01 0.02 0.09-0.05-0.11冻融4次-0.01 0.06-0.07-0.02-0.05 0.01-0.02 0.02 0.41-0.15
2.6.2 4 ℃保存稳定性 分别与存放于-80 ℃条件下的相应参考品进行比较,绝对偏差均小于PCR 误差允许范围0.50 lgIU/mL,见表4。表明参考品4 ℃保存2 ~5 d稳定性好。
表4 4 ℃保存不同时间的稳定性比较(lgIU/mL,,n=3)Tab.4 Stability comparison under different storage durations at 4 ℃(lgIU/mL,,n=3)

表4 4 ℃保存不同时间的稳定性比较(lgIU/mL,,n=3)Tab.4 Stability comparison under different storage durations at 4 ℃(lgIU/mL,,n=3)
参考品LOD P1 P2 P3 P4 P5 P6-80 ℃保存3.06 4.75 4.88 4.12 5.25 4.60 4.73 2 d 0.01-0.01-0.08 0.01-0.04-0.01-0.05 3 d 0.01-0.36-0.05 0.02-0.04-0.01-0.03 4 d 0.04-0.26-0.21 0.05-0.01-0.03-0.36 5 d 0.03-0.42-0.28-0.02-0.04 0.00-0.49
2.6.3 室温保存稳定性 分别与存放于-80 ℃条件下的相应参考品进行比较,绝对偏差均小于PCR 误差允许范围0.50 lgIU/mL,见表5。表明参考品室温保存16 ~24 h稳定性好。
表5 室温保存不同时间的稳定性比较(lgIU/mL,,n=3)Tab.5 Stability comparison under different storage durations at room temperature(lgIU/mL,,n=3)
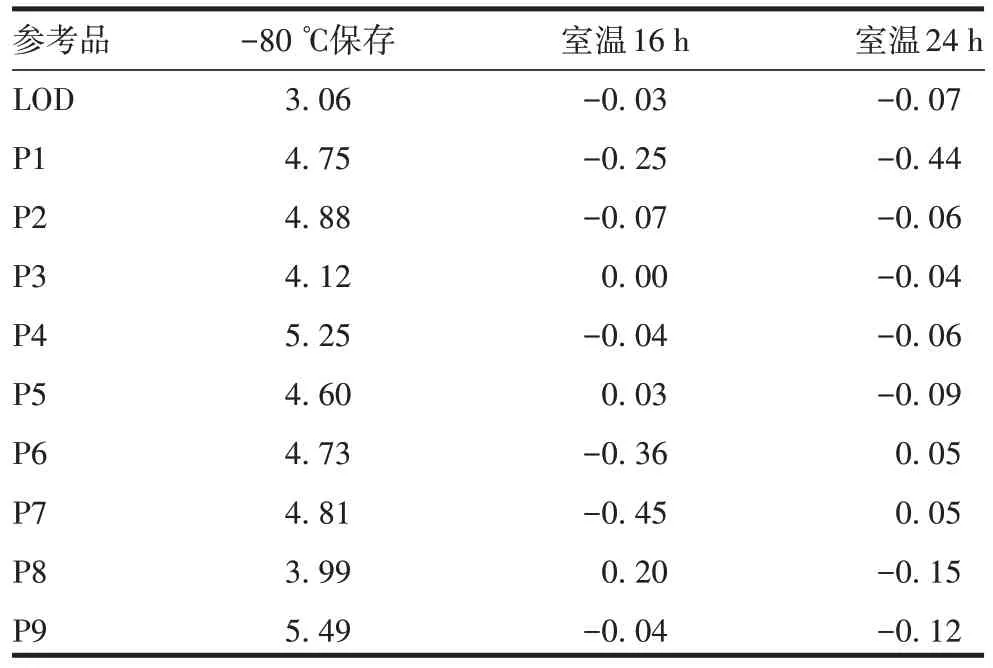
表5 室温保存不同时间的稳定性比较(lgIU/mL,,n=3)Tab.5 Stability comparison under different storage durations at room temperature(lgIU/mL,,n=3)
参考品LOD P1 P2 P3 P4 P5 P6 P7 P8 P9-80 ℃保存3.06 4.75 4.88 4.12 5.25 4.60 4.73 4.81 3.99 5.49室温16 h-0.03-0.25-0.07 0.00-0.04 0.03-0.36-0.45 0.20-0.04室温24 h-0.07-0.44-0.06-0.04-0.06-0.09 0.05 0.05-0.15-0.12
2.7 参考品标准 根据《中国药典》三部(2020版)乙型肝炎病毒丙型肝炎病毒人类免疫缺陷病毒1 型核酸检测试剂盒部分,制定HBV 核酸血筛试剂国家参考品标准。本参考品用于HBV 核酸血筛检测试剂的质量评价时,应满足以下要求:8 份HBV 核酸血筛试剂阴性参考品,符合率(-/-)为8/8;9份HBV核酸血筛试剂阳性参考品,符合率(+/+)为9/9;HBV核酸血筛试剂LOD 参考品,用HBV、HCV、HIV 核酸检测均为阴性人血清/血浆为稀释液进行稀释后检测,混样检测系统的LOD不低于15×nIU/mL(n为混样系数),单检/拆分/鉴别检测模式LOD不低于15 IU/mL,且稀释用人血清/血浆HBV、HCV、HIV核酸检测均为阴性。
3 讨论
HBV 属于嗜肝DNA 病毒科,为目前发现最小的DNA 病毒,具有独特的带有部分单链区的双链DNA环状模式[11]。研究表明,HBV DNA 核酸检测,能在检测出HBsAg 之前数周检测出HBV 感染,可在感染早期阶段血清阴性样品中,以及感染晚期阶段HBc抗体阳性/HBsAg阴性样品中,检测出低水平的HBV DNA,是机体内HBV 的数量、复制水平、传染性、药物治疗效果、制定治疗策略等评估指标,也是唯一能帮助确诊隐匿性HBV 感染和隐匿性慢性HBV 的实验室检测指标[12-14]。
目前无偿献血是我国临床用血的主要来源[15],随着对输血相关病原体的认识日益深化,经血传播疾病的严重性引起社会广泛关注。根据《血站技术操作规程》[16]要求,血站除了使用传统ELISA 方法检测献血者血液中各种病原体的抗原、抗体外,核酸检测(nucleic acid testing,NAT)作为一种新的检测策略被纳入整体检测体系中。对献血者血液进行HBV、HCV及HIV核酸检测,可大大缩短“窗口期”,更好地控制血液质量,最大程度地减少输血传播疾病的风险。该HBV、HCV及HIV核酸联合检测,主要检测方法为实时荧光PCR 法、转录介导的扩增(TMA)法等,为定性分析,不能定量检测。主要用于血液中心、血站、浆站,测试个体血浆样本或多个合并在一起的混合血浆样本,即单人份(拆分/鉴别)及混样检测。混样检测主要包括6、8、16、24、48及96混样检测等,因各企业产品不同而有不同混样的设置。
本参考品建立的目的即为了该HBVHCVHIV 核酸血筛试剂盒检测中HBV 核酸血筛检测试剂的质量评价和控制而设立。目前已经实行批签发的生产企业共9 家(进口两家、国产7 家),分别为上药康德乐医药科技(上海)有限公司(Grifols公司产品)、罗氏诊断产品(上海)有限公司(Roche)、湖南圣湘生物科技有限公司、苏州新波生物技术有限公司、北京万泰生物药业股份有限公司、珠海丽珠试剂股份有限公司、上海科华生物工程股份有限公司、中山大学达安基因股份有限公司及苏州华益美生物科技有限公司。
由于不同企业在检测模式、LOD 上的不同设置,考虑到有企业单人份检验,如果HBV、HCV或HIV中有任何一项为阳性,检测结果为阳性,需要进一步鉴别检测,才能准确判定出为HBV、HCV 或HIV 阳性。为了不必要的麻烦,阴性参考品样本的选择,采用人HBV、HCV或HIV核酸全阴性血浆。阳性参考品样本的选择,考虑HBV与HCV重叠感染的发生率比较高,HBV 与HIV 共感染的情况也时有发生[17-18],不排除HBV 阳性样本中混有HCV 或HIV 共感染的血浆,同时,考虑到该参考品设立的目的是质量控制,如果HBV DNA 浓度太高,易引起仪器污染,影响后续正常工作,因此选择HBV DNA 病毒载量不超过105IU/mL的HBV DNA阳性血浆。对于LOD国家参考品,考虑到核酸血筛试剂的灵敏度较高,由于各企业检测标准中LOD的要求不同,检测模式的不同,将LOD国家参考品的浓度设置为1 支高于所有企业所有检测模式的样本,使用时,可按照不同企业药品注册检验标准或产品制检规程,用人HBV、HCV或HIV全阴性血浆稀释后检测判定。溯源上可以溯源至现行的第四代WHO HBV DNA国际标准品(NIBSC code:10/266)。
综上所述,HBVHCVHIV 核酸血筛试剂是按药品管理的品种,实行批签发,但一直未单独用于其中HBV 核酸血筛试剂部分用的国家参考品,该参考品的建立弥补了这一空缺,有利于保证血液质量和安全用血,极大地促进了该产品批签发的发展,有利于该产品的标准化、规范化研究。

