黑杨根围木霉菌的分离鉴定及短密木霉T09生防特性1)
张玉洲 余花 文涵泳
(宁夏回族自治区森林病虫防治检疫总站,银川,750001) (宁夏大学)
席娜 杨艳 任宇航 周金秋 蒋朝阳 顾沛雯 于泽洋
(宁夏回族自治区农村科技发展中心) (宁夏大学)
木霉菌(Trichodermaspp.)是一类兼具生物农药、生物肥料和土壤改良剂等应用价值的生防真菌。木霉菌具有抗菌和抑菌的广谱性,对植物的生长发育和抗病性具有促进作用[1],且可通过螯合或降解作用溶解金属氧化物[2],而改良土壤的营养结构。近年来,随着农药化肥大量施用带来的水质富营养化、土壤理化性质恶化、土壤板结等问题的不断加重,生物防治有效缓解了化学农药的副作用。木霉菌作为有效的生防真菌,在农业生产中的应用越来越广泛,木霉菌的资源收集与储备已经引起世界很多国家的重视。目前,世界各国都已开展了对木霉菌菌种的收集工作,据统计,中国已分离木霉种类61种[3],菌株分离省份主要集中在我国南方地区,东北地区相对较少[4-5]。黑龙江省位于中国最东北部,大部分区域处于中温带,四季分明,独特的气候条件影响木霉菌的抗寒性、抗病性和适应性等,导致北方与南方的木霉菌的特性具有差异。因此对木霉菌进行分离鉴定及功能分析,筛选适应黑龙江气候的优质木霉菌株,为黑龙江地区的生物防治提供技术支持。
杨树(PopulusL.)外形美观,生长迅速,种植杨树不仅对改善和绿化环境具有重要作用,而且具有经济效益、生态效益和社会效益。中国是世界上杨树人工林面积最大的国家,杨树的病虫害问题是制约杨树林各种效益充分发挥的关键因素[6]。据统计,杨树的真菌病害多达300多种[7],但目前病害的防治多以化学防治为主,化学防治不仅污染环境,还容易导致病害产生抗药性,因此发展生物防治对杨树林的健康长期发展有着重要意义。本研究从黑杨(Populusnigra)根围土壤分离生防木霉,并对木霉种类进行种类鉴定,了解黑杨根围木霉的分布和生防特性,为林业病害生物防治提供理论支持。
1 材料与方法
1.1 试验材料
采集东北林业大学校园内人工黑杨林根围土壤土样15份,密封于无菌塑料袋,带回实验室,置于冰箱内-20 ℃冻存备用。
1.2 菌种分离
分别从每份土样中称取10 g,置于100 mL的无菌水中溶解,摇匀,采用稀释平板法,依次稀释为10-1、10-2、10-3、10-4倍。用移液器分别吸取不同稀释倍数的土壤悬浮液0.15 mL,用无菌涂布器均匀涂布于孟加拉红培养基平板上,每个稀释倍数涂布5皿,放置培养箱中28 ℃倒置培养3 d后,挑出木霉菌落,转接到PDA培养基上,进行纯化培养。
1.3 形态学及分子生物学鉴定
将分离纯化的木霉菌,接种到PDA培养基平板上,温度28 ℃暗培养144 h,观察描述其形态和培养特征(包括生长速度、菌落形状及色素的有无等);培养48~72 h时,挑取少量白色菌丝,用棉蓝染液染色后,在显微镜下观察并记录木霉菌产孢区的分生孢子梗及分生孢子的形态特征(分生孢子的形状、大小、长宽比及表面纹饰的有无等[2,8])。
形态学鉴定后,每种选取1株木霉进行后续的分子生物学鉴定。将木霉菌的分生孢子接种到PD液体培养基中,温度25~28 ℃,转速180 r/min,摇瓶培养48 h,无菌纱布过滤收集菌丝体。利用奥美嘉生物技术公司(Omega)DNA提取试剂盒提取木霉菌丝体DNA。根据White et al.[9]的方法,选用内转录间隔区序列(ITS)通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’);再参照O’Donnell et al.[10]的方法,选用转录延长因子(tef1)引物EF1(5’-ATGGGTAAGGARGACAAGAC-3’)和EF2(5’-GGARGTACCAGTSATCATGTT-3’)。分别以木霉菌基因组DNA为模板,扩增不同菌种的ITS、tef1-α序列。聚合酶链式反应(PCR)体系(50 μL):双蒸水(ddH2O,25.5 μL)、缓冲液(10×Ex Buffer,5 μL)、tef1引物EF1(2.5 μL)、tef1引物EF2(2.5 μL)、脱氧核糖核苷三磷酸(dNTP,4 μL)、DNA聚合酶(Ex Taq,0.5 μL)、模板DNA(10 μL)。聚合酶链式反应(PCR)程序为:94 ℃预变性3 min,94 ℃变性30 s,50 ℃退火20 s,72 ℃延伸30 s 35个循环,72 ℃总延伸7 min。用普洛麦格(Promega)胶回收试盒回收纯化获得的聚合酶链式反应(PCR)产物,并送至上海生物工程有限公司进行序列测定。测序结果经BioEdit等软件分析和手工校正后,通过上海交通大学木霉菌菌种保藏管理中心(http://mmit.china-cctc.org/action1.php)[11]进行在线比对。
将木霉分离株的内转录间隔区序列(ITS)、转录增强因子(tef1-α)序列与美国国家生物技术信息中心(NCBI,https://www.ncbi.nlm.nih.gov/)部分序列通过MEGA7.0软件分别构建进化树,分析其亲缘关系。构建进化树的方法为最大似然法(ML),设置3个水平、1 000次重复。
1.4 短密木霉T09生防特性
在花盆中移入组培山新杨幼苗,培养约15 d,挑选长势相近的幼苗备用。将分离到的短密木霉(Trichodermabrevicompactum)T09培养至产孢,用无菌水冲洗制备孢子悬浮液(1 010个孢子/L),孢子悬浮液即配即用。将山新杨苗分为处理组和对照组:处理组山新杨,每株浇灌孢子悬浮液200 mL,喷施孢子悬浮液100 mL;对照组山新杨,每株浇水200 mL,喷施水100 mL;温度28 ℃、光照16 h、黑暗8 h以及湿度50%的条件下继续培养30 d,两组树苗每隔5 d补浇自来水100 mL。随后测定山新杨株高、茎粗,并取叶片测定叶绿素质量分数[12]、可溶性糖质量分数[13]、可溶性蛋白质量分数[14],叶片中硝酸还原酶活性、过氧化氢酶活性和超氧化物歧化酶活性分别用北京索莱宝科技有限公司生产的硝酸还原酶活性检测试剂盒BC0085、超氧化物歧化酶活性检测试剂盒BC0170和过氧化氢酶测定试剂盒BC0205测定,设置3个重复。处理组和对照组种植后的土样留存备用。
在花盆中装土,花盆规格和土均与种植山新杨的相同,随后将盛有土的花盆分为处理组和对照组,处理组花盆每盆浇灌孢子悬浮液200 mL,对照组花盆每盆浇灌水200 mL,在温度28 ℃、光照16 h、黑暗8 h、空气湿度50%的条件下放置30 d,每隔5 d补浇100 mL自来水。随后取土,连同在种植后留存的土样,测定土壤的速效氮和速效磷质量分数,测定方法参照《土壤学实验》[15],设置3个重复。
2 结果与分析
2.1 木霉菌的分离与形态学初步鉴定
由图1可知,从黑杨根围土壤分离纯化,获得27株木霉菌,依据菌落颜色、产孢簇、轮纹有无、色素产生与否、分生孢子梗特征等形态学特点,结合《木霉分类与鉴定》[2]中的描述,初步将这27株木霉鉴定为5种:哈茨木霉(T.harzianum)(图1a),棘孢木霉(T.asperellum)(图1b),长枝木霉(T.longibrachiatum)(图1c),拟康氏木霉(T.koningiopsis)(图1d),短密木霉(T.brevicompactum)(图1e)。
木霉菌培养48 h:短密木霉菌丝生长速度最慢,菌落半径为19.5 mm;长枝木霉菌丝生长最快,菌落半径为33 mm;棘孢木霉已经从接种点开始产孢。
木霉菌培养72 h:哈茨木霉出现产孢簇,开始产孢;棘孢木霉产孢量继续增加,呈同心轮纹;长枝木霉从接种点开始产孢;拟康氏木霉从菌落外缘开始产孢;短密木霉没有产孢。
a.哈茨木莓(Trichodermaharzianum),b.棘孢木霉(Trichodermaasperellum),c.长枝木霉(Trichodermalongibrachiatum),d.拟康氏木霉(Trichodermakoningiopsis),e.短密木霉(Trichodermabrevicompactum);A.48 h正面图,B.72 h正面图,C.96 h正面图,D.144 h正面图,E.产色素情况(背面图),F.分生孢子梗,G.分生孢子。
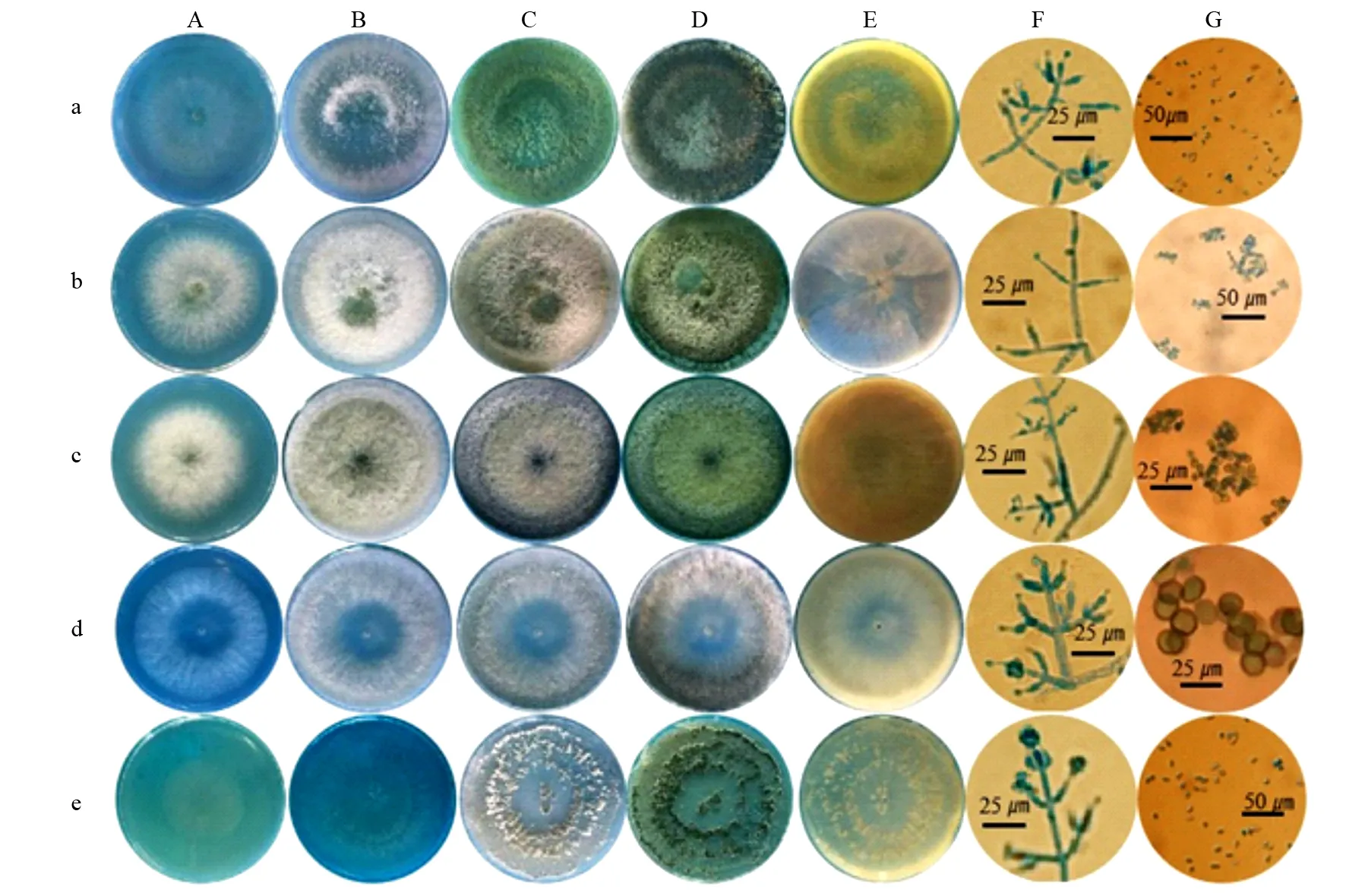
图1 5种木霉的形态学鉴定
木霉菌培养96 h:哈茨木霉、棘孢木霉、拟康氏木霉和短密木霉的菌落呈同心轮纹状;哈茨木霉产孢量丰富,表面呈粉状;棘孢木霉的同心轮纹由密集的分生孢子组成;长枝木霉的菌落呈粘状,分生孢子堆呈黑绿色,有白色菌丝条纹产生;拟康氏木霉的分生孢子分布于气生菌丝上,形成比较宽的分生孢子带;短密木霉以产孢簇状态形成同心轮纹,中心不育。
木霉菌培养144 h:哈茨木霉的孢子由浅绿色变至暗绿色,有分泌物产出,菌落背面乳黄色;棘孢木霉的孢子变为深绿色,有分泌物产出,没有明显气味,菌落背面无色;长枝木霉不形成分生孢子簇,菌落背面暗黄色;拟康氏木霉的产孢簇呈絮状,无明显气味,菌落背面淡黄色;短密木霉孢子变为灰绿色,没有明显气味,菌落背面无色。
5种木霉的显微形态特征:哈茨木霉分生孢子梗第一级分支几乎呈直角,向顶部弯曲,分生孢子倒卵形;棘孢木霉菌的分生孢子梗产生成对的侧生分支,分生孢子球形;长枝木霉菌分生孢子丛生;拟康氏木霉菌分生孢子梗有主轴,分支依次对生,分枝与主轴呈锐角,分生孢子球形;短密木霉菌分生孢子梗分枝对生,分生孢子卵圆形。
2.2 分子生物学鉴定
将5种木霉的基因组DNA经PCR扩增获得ITS片段和tef1-α片段,其中长枝木霉的tef1-α片段未能成功扩增,将这些序列在上海交通大学木霉菌菌种保藏管理中心(http://mmit.china-cctc.org/action1.php)网站进行在线比对后,发现哈茨木霉(T21)、拟康氏木霉(T02)和短密木霉(T09)的比对结果与形态学鉴定结果相吻合,而形态学鉴定为棘孢木霉(T18)的木霉在线比对结果显示为类棘孢木霉(T.asperelloides),长枝木霉(T22)由于仅有ITS序列,无法准确比对。
由图2、图3可知,根据ITS序列构建的进化树和tef1-α序列构建的进化树结果相近,5种木霉分别为哈茨木霉、类棘孢木霉、拟康氏木霉、长枝木霉和短密木霉。同时发现,棘孢木霉和类棘孢木霉的亲缘关系非常近,有的甚至没有遗传距离的出现。
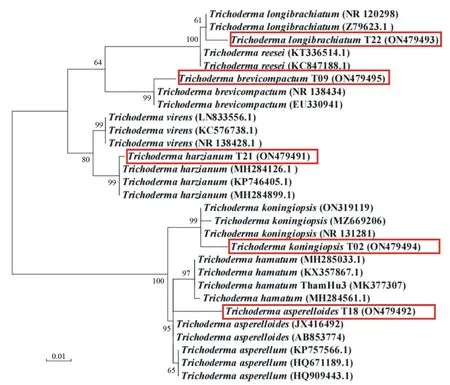
分支点上的数字表示基于1 000次Bootstrap重复的自举值,括号中的序号表示GenBank数据库中的登录号;方框标注本研究中鉴定的木霉。
结合形态学鉴定结果和比对结果,最终5种木霉被鉴定为哈茨木霉(T.harzianum)、类棘孢木霉(T.asperelloides)、长枝木霉(T.longibrachiatum)、拟康氏木霉(T.koningiopsis)和短密木霉(T.brevicompactum)。将这些序列提交于GenBank,获得相应的登录号。
2.3 黑杨根围木霉种类及数量
从黑杨根围共获得15份土样中共获得27株木霉,分离效率每个土样1.8株。其中短密木霉(T.brevicompactum)17株,占分离总数的63%;哈茨木霉(T.harzianum)3株,占分离总数的11%;类棘孢木霉(T.asperellum)4株,占分离总数的15%;拟康氏木霉(T.koningiopsis)1株,占分离总数的4%;长枝木霉(T.longibrachiatum)2株,占分离总数的7%。
2.4 短密木霉T09对山新杨(Populus davidiana×P. alba var. pyramidalis)生理指标的的影响
由表1可知,短密木霉为所获木霉当中的优势种,对短密木霉T09进行后续生防特性研究发现,短密木霉T09对山新杨处理30 d后(处理组),茎粗达到3.73 mm,与对照(3.04 mm)相比差异极显著(p<0.01);处理组的叶绿素质量分数为4.48 mg·g-1,与对照(3.96 mg·g-1)相比差异极显著(p<0.01);处理组的可溶性糖质量分数为2.70 mg·g-1,与对照(2.10 mg·g-1)相比差异显著(p<0.05);处理组可溶性蛋白质量分数为0.56 mg·g-1,与对照组(0.44 mg·g-1)相比差异极显著(p<0.01);处理组硝酸还原酶活性为2.95 nmol·g-1·min-1,显著高于对照组(2.40 nmol·g-1·min-1)(p<0.05);处理组过氧化氢酶活性为3 425.84 nmol·g-1·min-1,与对照组(2 461.75 nmol·g-1·min-1)差异极显著(p<0.01);处理组的超氧化物歧化酶活性为66.80 nmol·g-1·min-1,与对照组(58.80 nmol·g-1·min-1)相比差异显著(p<0.05)。

分支点上的数字表示基于1 000次Bootstrap重复的自举值,括号中的序号表示GenBank数据库中的登录号;方框标注本研究中鉴定的木霉。

表1 山新杨(Populus davidiana×P. alba var. pyramidalis)生理指标
2.5 短密木霉T09对土壤养分的影响
由表2可知,T处理(短密木霉T09处理)的土壤速效氮质量分数显著高于对照组(CK,没有种植山新杨也没有经过短密木霉T09处理的土壤)(p<0.05),表明短密木霉T09能够增加土壤中的速效氮质量分数;P处理(只种植山新杨的土壤)土壤的速效氮质量分数显著低于对照组(p<0.05),表明植物生长会吸收土壤中的速效氮,导致土壤速效氮质量分数减小;T+P处理(经过短密木霉T09处理种植山新杨的土壤)的土壤速效氮质量分数显著低于P处理(p<0.05),短密木霉T09的存在有利于山新杨对土壤速效氮的吸收。
T处理的土壤速效磷质量分数与对照组(CK)差异不显著,表明短密木霉T09不能增加土壤的速效磷的质量分数。同时,P处理的土壤中速效磷质量分数要显著低于对照组(p<0.05),山新杨生长吸收土壤速效磷导致速效磷含量减少。用短密木霉T09处理山新杨后土壤速效磷含量(表2,T+P组)与只种植山新杨的土壤(表2,P组)相比差异不显著,表明短密木霉不能促进山新杨吸收更多的速效磷。

表2 不同处理的土壤养分质量分数
3 结论与讨论
从黑杨根围土壤中分离获得27株木霉菌,依据形态学初步鉴定为短密木霉、哈茨木霉、长枝木霉、拟康氏木霉和棘孢木霉5个种。传统的真菌分类鉴定主要依据菌丝及孢子的生长特性和表型差异(如:菌落形态、生长速度、分生孢子梗的形态等),但是木霉菌株之间形态特征复杂多样,缺乏稳定性,相近种间鉴定易混淆,所以木霉菌种类鉴定比较困难。随着分子生物学技术的发展,基于保守功能区(如ITS序列、翻译延伸因子tef序列等)序列的分子鉴定已经在木霉菌的分类和系统发育关系研究上的广泛应用[16]。Dou et al.[11]建立了木霉菌多样性鉴定系统,极大的方便了对木霉的鉴定。本研究应用了分子鉴定技术来确保鉴定结果的准确性,短密木霉、哈茨木霉、长枝木霉、拟康氏木霉分子生物学鉴定结果与形态学鉴定结果一致。但是棘孢木霉(T.asperellum)在分子生物学鉴定中为类棘孢木霉(T.asperelloides),通过文献查阅,Samuels et al.[17]研究发现类棘孢木霉是棘孢木霉的姊妹种,形态极为相近,并表明这两种无法在形态上区分,因此本研究以分子鉴定结果为准,认为形态学鉴定为棘孢木霉的分离株应该为类棘孢木霉(T.asperelloides)。
Zhou et al.[4]分离了黑龙江省胡桃楸(Juglansmandshurica)、糖槭(Acersaccharum)和榆树(Ulmuspumila)根围木霉,发现深绿木霉(T.atroviride)为优势种。Yu et al.[18]分离了黄菠萝(Phellodendronamurense)根围土样木霉,发现棘孢木霉(T.asperellum)和哈茨木霉(T.harzianum)为优势种。而在对黄菠萝、紫丁香、水曲柳、香蕉根围木霉的研究中,短密木霉均为数量最少的木霉种[4-5,18-19]。本研究分离到的27株木霉,短密木霉占63%,为黑杨根围木霉的优势种。这些研究结果不同,表明不同植物根围木霉种类和数量有差异,这与植物根部分泌的代谢物有关,因此短密木霉更适应黑杨的根围环境,更加适用于黑杨乃至其他杨树病害的生物防治。
短密木霉BF06能够显著促进黄瓜侧根形成和黄瓜生长,给黄瓜接种短密木霉BF06后,对黄瓜枯萎病、茎基腐病、菌核病、根腐病和疫病的防效达60%以上[20]。深绿木霉MUCL45632能够显著增加番茄株高和根部干重[21]。非洲哈茨木霉(T.afroharzianum)处理丁香后,丁香过氧化氢酶活性显著升高,H2O2质量分数也显著降低[5]。经过哈茨木霉处理的南瓜,南瓜的过氧化氢酶活性、过氧化物酶活性和多酚氧化酶活性显著提升[22];经哈茨木霉处理的番茄,显著提升了番茄可溶性蛋白质量分数和脯氨酸质量分数,使番茄对逆境的抗性增加[23]。因此木霉能够使植物抗性相关指标升高,从而提升植物抗性。本研究中,短密木霉T09也具有类似的功能,经过短密木霉T09处理的山新杨茎直径显著增大,山新杨叶片的叶绿素质量分数、可溶性糖质量分数和可溶性蛋白质量分数显著提高,硝酸还原酶、过氧化氢酶和超氧化物歧化酶活性更强,因此短密木霉T09能够使山新杨具有更好的长势和更强的抗性,具有生防潜力。深绿木霉能促进植物吸收氮元素,并使植物根、茎重量增加[20];棘孢木霉能够提升烟草对氮素的利用率[24];短密木霉可促进木质素的降解,增加土壤养分[25]。短密木霉T09能够提升土壤的速效氮质量分数,并促进植物对速效氮的吸收,从而保证植物更好的生长。但是短密木霉并不能增加土壤的速效磷质量分数,也不能促使植物对速效磷的吸收。
综上所述,黑杨根围木霉的优势种为短密木霉,短密木霉T09具有较强的生防能力,能够成功诱导山新杨产生抗病性,同时也能提升土壤的速效氮质量分数并促进植物吸收利用氮元素。

