4种薰衣草耐高温潮湿性评价
张振国 郭丹丽 赖刚刚 李子玉 戴忠良 李敏

摘要:为研究高温潮湿条件下不同薰衣草品种的差异变化,以不同高温潮湿耐性的薰衣草(新薰1号、新薰2号、新薰3号和新薰4号)为试材,研究在自然高温高湿条件下,对4种薰衣草叶片的含水量、叶绿素含量、可溶性蛋白含量、电解质渗透率、丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性进行测定,并利用模糊数学中隶属函数法对其高温潮湿耐性进行综合评价。结果表明,在高温潮湿条件下,新薰3号叶片含水量和电解质渗透率显著高于其他3个品种;新薰4号的叶片SOD活性显著低于其他3个品种;新薰4号CAT活性显著低于新薰1号和新薰2号;新薰2号的叶片叶绿素含量和POD活性显著高于其他3个品种;应用隶属函数分析法对薰衣草的高温潮湿耐性进行综合评价,得出4种薰衣草的耐性顺序为新薰2号>新薰1号>新薰3号>新薰4号。综上,高温潮湿条件下,不同薰衣草品种的生理响应存在显著差异。本研究结果为进一步研究薰衣草抵御高温潮湿伤害的生理机制提供了理论支持。
关键词:薰衣草;耐高温潮湿;抗氧化;隶属函数法;生理指标;综合评价
中图分类号:S685.990.1 文献标志码:A
文章编号:1002-1302(2023)08-0119-05
基金项目:新疆生产建设兵团第四师科技项目(编号:2021GXPT02、2022NY08)。
作者简介:张振国(1967—),男,新疆伊宁人,硕士,高级农艺师,主要从事特色作物遗传育种研究。E-mail:183196764@qq.com。
通信作者:李 敏,研究员,主要从事香料作物新品种选育及栽培技术研究。E-mail:1341997078@qq.com。
薰衣草(Lavendula angustifolia)是唇形科薰衣草属多年生亚灌木,原产于地中海沿岸,在欧洲各地及大洋洲列岛均有栽培,尤以保加利亚、法国、意大利、西班牙等国家栽培居多。目前,薰衣草全世界有37个种,100多个品种[1]。我国自20世纪初开始在新疆引种和栽培薰衣草,目前在伊犁建有大面积薰衣草种植基地。由于薰衣草叶形优美,花色典雅,全株具有芳香味,是一种举世闻名的天然香料植物和观赏植物[2],继新疆之后,我国的陕西、河南、河北、江苏、浙江等地也陆续大量引种栽培[3]。
目前,关于植物耐高温和耐潮湿的研究相对较少,而植物的高温、潮湿耐性对于引种和育种工作具有重要意义。在北方地区,高温是影响植物生长的主要限制因子之一,通过影响植物基因表达和生理特性,从而改变植株外观形态和产量品质[4]。苏齐珍等对11种芳香植物在强光、高温、高湿条件下的生长特性进行了研究,通过植物的外观形态可评价植物的耐高温高湿性[5]。伊犁地区夏季多高温阴雨天气,形成高温高湿的气候环境,选育耐高温耐高湿的薰衣草品种是主要研究方向之一。
薰衣草喜冷凉全日照的环境,忌高温潮湿[6-7]。虽然薰衣草在江苏地区已有种植,但是在栽培生产中经常遇到高温潮湿天气,给薰衣草的栽培带来一定影响,制约了薰衣草的生产。鉴于此,了解和掌握薰衣草的耐高温潮湿特性,并筛选出耐高温潮湿薰衣草品种显得尤为必要。因此,本研究以新薰1号、新薰2号、新薰3号和新薰4号4种薰衣草为试材,对其在江苏高温潮湿地区的生理变化开展试验研究,旨在为我国南方高温潮湿地区薰衣草的引种栽培和产业发展提供科学理论依据。
1 材料与方法
1.1 试验材料
供试薰衣草品种为新薰1号、新薰2号、新薰3号和新薰4号,均引种自新疆建设兵团第四师农业科学研究所(81°32′E,43°92′N)。试验于2019年 6—8月在江苏省镇江市农业科学院试验基地(118°86′E,32°03′N)进行。试验期间天气炎热(最高温度≥35 ℃有14 d),且连续多次降雨,于高温多雨季节过后的8月25日采样,选取平均株高 28.9 cm、平均冠幅37.1 cm的4种薰衣草植株为试材,于08:00—09:00采集薰衣草的叶片,用于生理指标的测定。
1.2 测定指标与方法
利用烘干称重法测定叶片含水量,按照下式计算:叶片含水量=(鲜质量-干质量)/鲜质量×100%。叶绿素含量参照王学奎等的方法[8]进行测定;可溶性蛋白含量采用考马斯亮蓝法[9]进行测定;丙二醛(MDA)含量参照Fu等的方法[10]进行测定;电解质渗透率参照Bajji等的方法[11]进行测定,按照下式计算:电解质渗透率=煮前电导率/煮后电导率;超氧化物歧化酶(SOD)活性参照 Cervilla等的方法[12]進行测定;过氧化物酶(POD)活性参照黄洁等的方法[13]进行测定;过氧化氢酶(CAT)活性参照马超等的方法[14]进行测定。每个指标测定3次重复,结果取平均值。
1.3 数据统计分析
试验数据采用 Excel 2010 及 SPSS 16.0 统计软件进行分析处理。利用模糊数学中的隶属函数法对测定的各个指标按以下公式进行标准化处理:
X(u)=(Xj-Xmin)/(Xmax-Xmin)(j=1,2,…,n)[15-16]。
式中:Xj为第j个指标的测定值;Xmin、Xmax分别表示第j个指标中测定的最小值、最大值。若某一个指标与耐高温潮湿性为负相关,则用反隶属函数值 X(u)=(Xmax-Xj)/(Xmax-Xmin)进行计算,最后把每个品种各指标的耐性隶属函数进行累加,求平均值,作为该品种最终的耐高温潮湿隶属函数值,平均数越大,则表示耐高温潮湿性越强。
2 结果与分析
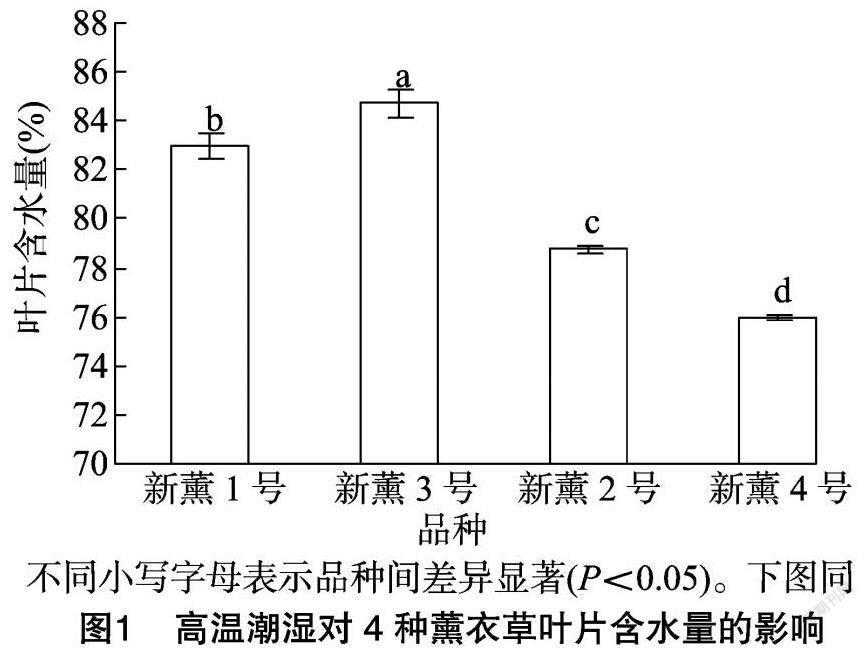
2.1 高温潮湿对薰衣草叶片含水量的影响
由图1可以看出,4个薰衣草品种在高温潮湿环境下其叶片含水量存在差异,其中新薰3 号叶片的含水量最高,为84.73%,显著高于其他3个品种;新薰1号含水量次之,为82.97%;新薰4号含水量最低,为75.97%。
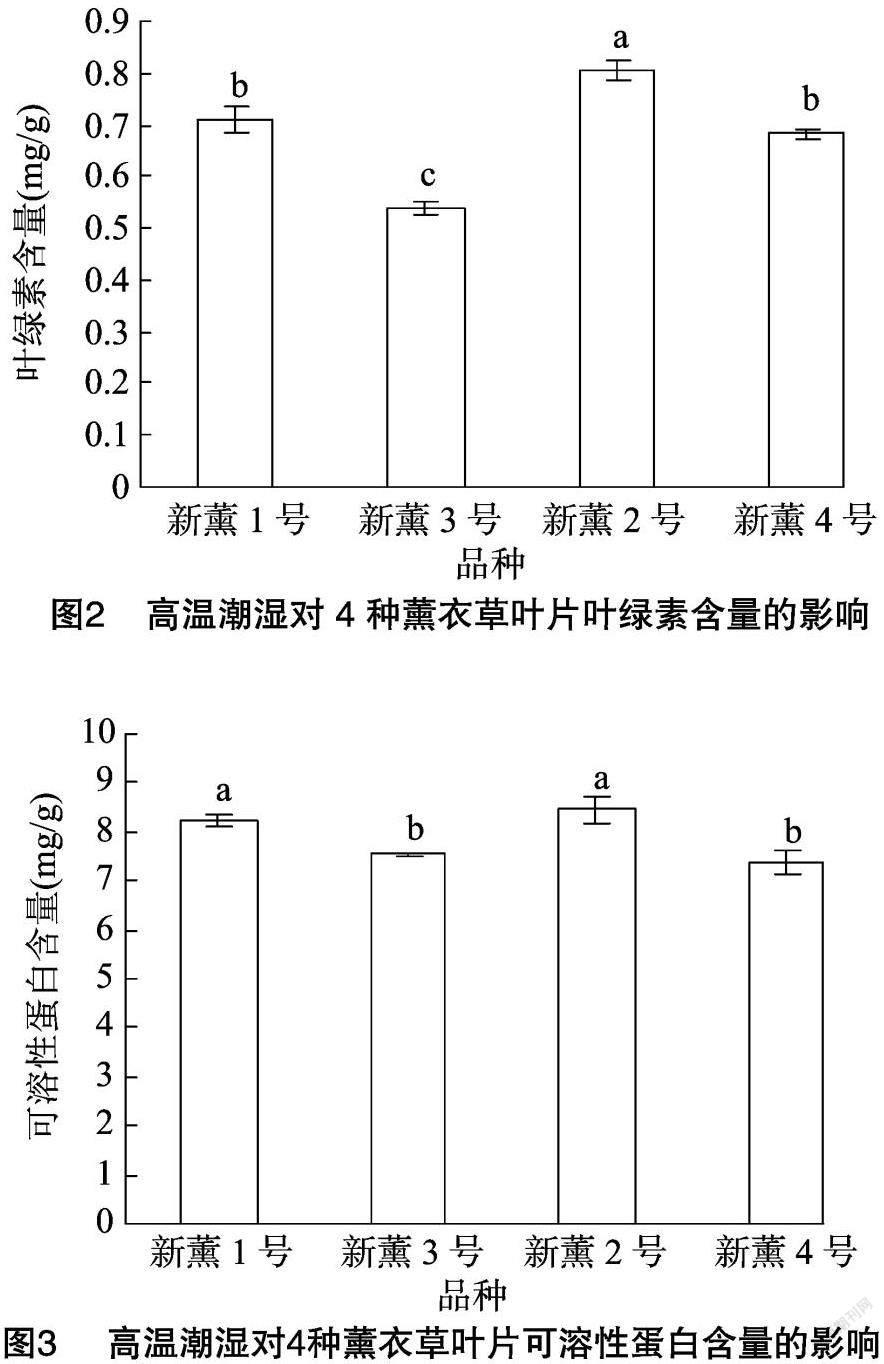
2.2 高温潮湿对薰衣草叶片叶绿素含量的影响
由图2可以看出,高温潮湿条件下新薰2号叶片的叶绿素含量最高,为0.81 mg/g,显著高于其他3个品种;新薰1号和新薰4号次之,且两者之间无显著差异;新薰3号含量最低,显著低于其他3个品种,为0.54 mg/g。
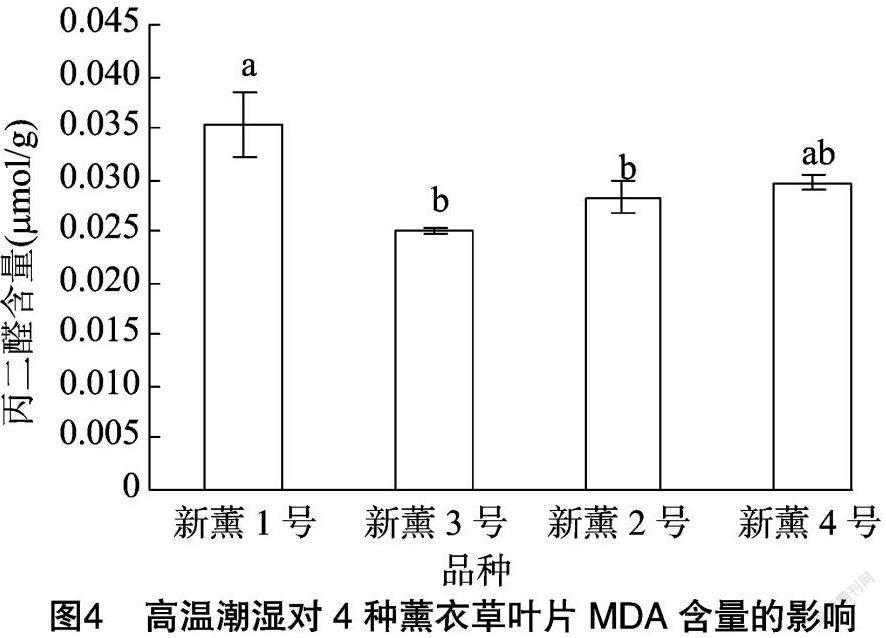
2.3 高温潮湿对薰衣草叶片可溶性蛋白含量的影响
由图3可以看出,4个薰衣草品种在高温潮湿环境下其叶片可溶性蛋白含量存在差异,其中新薰1号和新薰2号的可溶性蛋白含量分别为8.25、8.45 mg/g,二者之间无显著差异,但均显著高于新薰3号和新薰4号,而新薰3号和新薰4号可溶性蛋白含量分别为7.53、7.38 mg/g,两者之间也无显著差异。
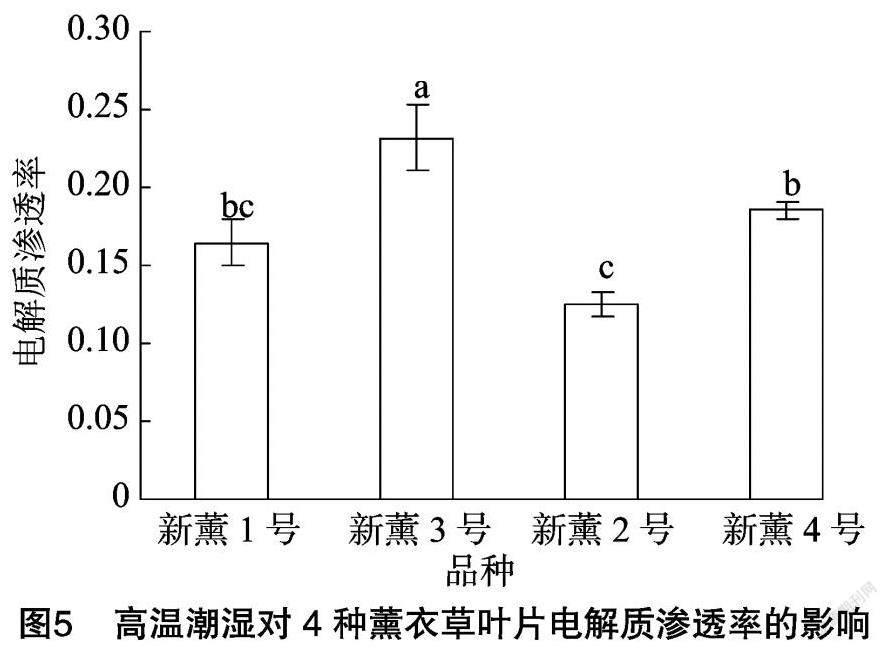
2.4 高温潮湿对薰衣草叶片MDA含量的影响
由图4可以看出,4個薰衣草品种在高温潮湿条件下其MDA含量也存在差异,其中新薰1号MDA含量最高,为0.035 μmol/g,新薰2号含量为0.028 μmol/g,新薰3号含量为0.025 μmol/g,新薰4号含量为0.030 μmol/g,新薰1号显著高于新薰3号和新薰2号,但与新薰4号无显著差异。
2.5 高温潮湿对薰衣草叶片电解质渗透率的影响
由图5可以看出,在高温潮湿条件下4个薰衣草品种间叶片的电解质渗透率存在差异,新薰1号、新薰2号、新薰3号和新薰4号的电解质渗透率分别为0.165、0.125、0.232、0.186;其中新薰3号电解质渗透率最高,显著高于其他3个品种;新薰4号次之,且与新薰1号之间差异不显著。
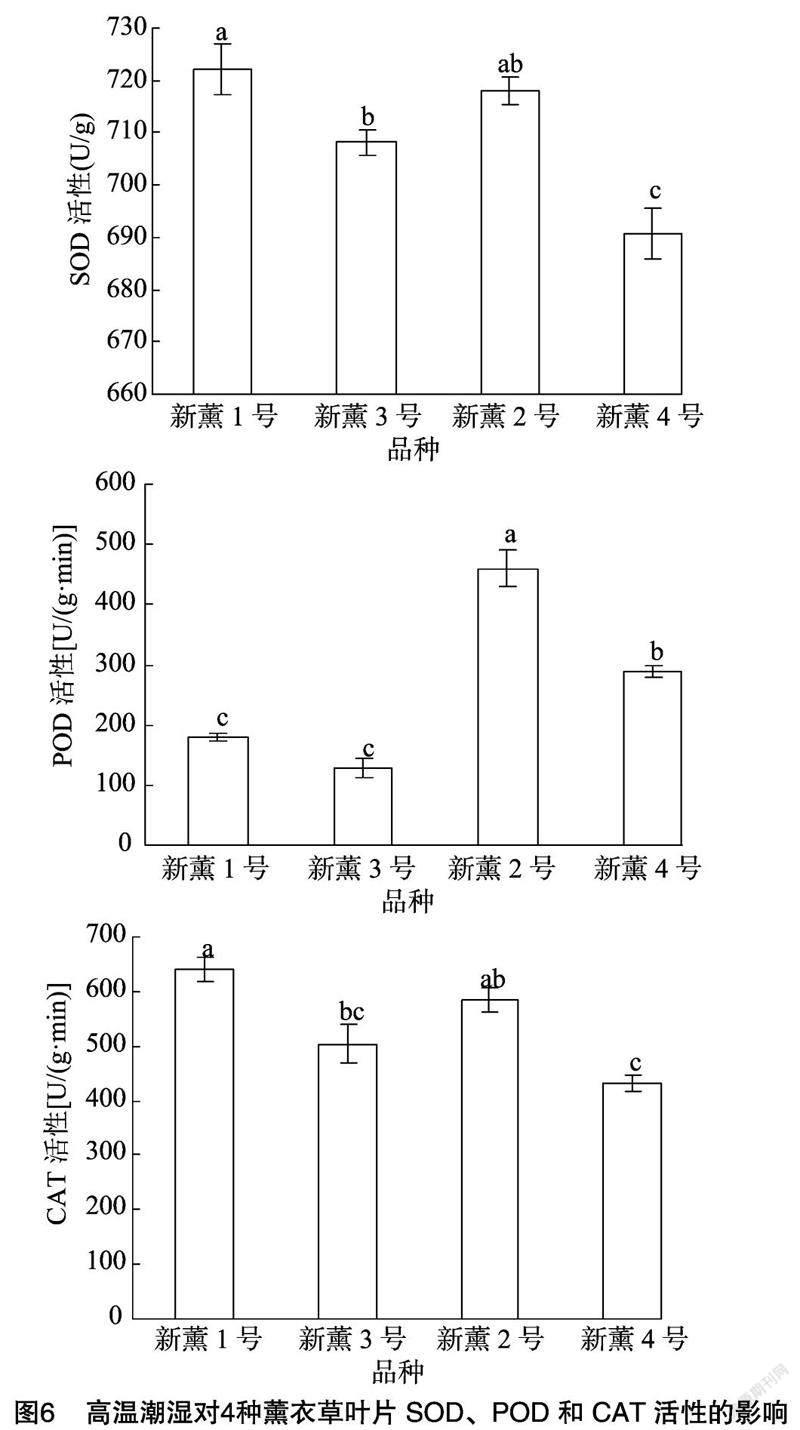
2.6 高温潮湿对薰衣草叶片抗氧化酶活性的影响
由图6可以看出,新薰1号、新薰2号、新薰3号与新薰4号叶片的SOD活性分别为722.03、717.92、708.19、690.65 U/g,新薰1号与新薰2号无显著差异;新薰3号次之;新薰4号最低,显著低于前3个品种。
对于POD活性而言,新薰2号品种叶片的POD活性最高,为460.00 U/g,显著高于其他3个品种;新薰4号次之,为288.00 U/g;新薰1号和新薰3号分别为180.00、128.00 U/g,二者之间无显著差异,且二者的POD活性均显著低于新薰2号和新薰4号(图6)。
对于CAT活性而言,新薰1号、新薰2号、新薰3号与新薰4号的CAT活性分别为640.00、584.00、504.00、432.00 U/g,其中新薰1号CAT活性最高,显著高于新薰3号和新薰4号品种,与新薰2号之间差异不显著;新薰4号CAT活性显著低于新薰1号和新薰2号,与新薰3号差异不显著(图6)。
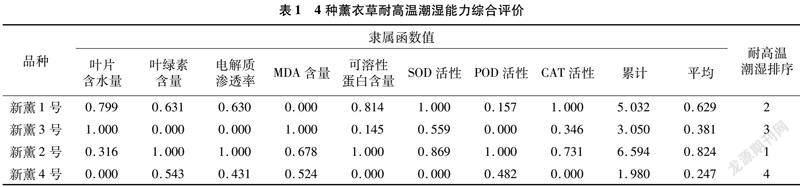
2.7 耐高温潮湿综合评价
本试验在测定多个生理指标的基础上,利用模糊数学中的隶属函数法对4个薰衣草品种的耐高温潮湿性进行综合评价,结果(表1)表明,新薰2号的平均隶属函数值最高,说明其耐高温潮湿性最强,4种薰衣草的耐高温潮湿能力存在差异,耐高温潮湿性从强到弱的次序为新薰2号>新薰1号>新薰3号>新薰4号。
3 讨论与结论
薰衣草性喜冷凉气候,忌高温潮湿,具有观赏、食用、药用、绿化和可深加工等广泛用途[17]。近年来,薰衣草在长江中下游地区陆续引种栽培,但其生长易遭受高温、多雨等自然天气情况的影响,因此,了解薰衣草的耐高温潮湿性、筛选出耐高温潮湿品种尤为重要。
水分是维持植物体正常生理作用的基础。一般情况下,植物体内含水量越高,其代谢越旺盛。在本试验中,在高温潮湿条件下,新薰3号叶片的含水量最高,说明新薰3号代谢旺盛,其耐高温潮湿性较强。此外,水分还是植物组织中重要的溶剂和反应物,当水分含量减少时,叶绿素含量的合成将会受阻,甚至会加速叶绿素含量的分解。本研究中,新薰2号叶片的叶绿素含量显著高于其他3个品种,由此推测,新薰2号在高温潮湿条件下耐逆性较强。
可溶性蛋白是植物体内的一种重要渗透调节物质。植物在逆境条件下通过增加可溶性蛋白含量束缚更多的水分,降低因渗透胁迫造成的伤害,这是植物本身对环境胁迫的一种适应机制[18]。本试验中,在高温潮湿条件下,新薰1号和新薰2号的可溶性蛋白含量显著高于新薰3号和新薰4号,说明新薰1号和新薰2号能维持较稳定的渗透势,具有较强的耐逆性。
活性氧(reactive oxygen species,ROS)是植物体内有氧气参与的所有代谢活动必然产生的物质,为维持活性氧动态平衡,抗氧化酶积极参与了抗氧化防御,其中 SOD、POD和CAT是植物抗氧化防御系统中较关键的酶,三者协同作用,共同消除细胞内的活性氧自由基,减轻活性氧对细胞膜系统的损害[19-21]。在本试验中,新薰1号和新薰2号的SOD活性均高于其他2个品种,且新薰2号的POD活性显著高于其他3个品种,由此可以推测,在这4个薰衣草品种中,新薰2号的抗氧化能力最强,新薰1号抗氧化能力次之。
膜是植物遭受逆境伤害时受到伤害的主要部位[22]。在逆境条件下,植物体内的活性氧增加,大量的活性氧与不饱和脂肪酸发生反应,引起膜脂发生过氧化,产生MDA。因此,MDA含量的高低可以反映膜脂过氧化的程度,进而反映出膜受伤害程度。随着MDA大量积累,膜脂发生相变,原生质的流动性发生改变,原本无序排列的脂肪酸链转变为有序排列状态,使得膜上的孔道增大,膜的透性增强,大量的电解质不断外渗,电解质渗透率增大[23]。因此,电解质渗透率的高低也可以反映膜的受伤害程度。在本研究中,新薰1号和新薰4号的MDA含量高于另外2个品种,说明新薰1号和新薰4号膜脂过氧化程度较大;从电解质渗透率来看,新薰3号电解质渗透率最高,新薰1号和新薰4号次之,新薰2号电解质渗透率最小,说明新薰3号膜受损伤程度最重,新薰1号和新薰4号次之,新薰2号膜完整性最好。
植物的耐逆性是一个受多种因素影响的综合指标,利用单一指标对其耐逆性进行评价是片面的。近年来,借助统计学方法利用多个指标对其耐逆性进行综合评价已有大量报道[17,24-26]。4个薰衣草品种在高温潮湿条件下各指标变化不一,因而单独利用某一指标对薰衣草耐高温潮湿性进行评价是片面的。因此,在本研究中,笔者在多个指标测定的基础之上,利用模糊数学中的隶属函数法对其耐高温潮湿性进行综合评价,既将多个指标考虑在内,又客观、正确地对耐逆性进行评价。目前该方法已经在植物耐旱性评价[17]、耐低温性评价[27-28]、耐矿物质营养评价[29]等方面广泛应用,说明该方法具有一定的适用性。因此,本试验在8个生理指标测定的基础上,应用隶属函数分析法对薰衣草的耐高温潮湿性进行综合评价,得出4种薰衣草的耐性顺序为新薰2号>新薰1号>新薰3号>新薰4号。
参考文献:
[1]郝俊蓉,姚 雷,袁关心,等. 精油类和观赏类薰衣草的生物学性状和精油成分对比[J]. 上海交通大学学报(农业科学版),2006,24(2):146-151.
[2]陈 策,任安祥,王羽梅. 芳香药用植物[M]. 武汉:华中科技大学出版社,2013.
[3]姚 雷,张少艾. 芳香植物[M]. 上海:上海教育出版社,2002.
[4]王 涛,田雪瑶,谢寅峰,等. 植物耐热性的研究进展[J]. 云南农业大学学报,2013,28(5):719-726.
[5]苏齐珍,赵 锦,朱 琳. 11种芳香植物生长特性研究[J]. 热带农业科学,2018,38(8):18-23.
[6]王有江,朱红霞. 芳香花草[M]. 北京:中國林业出版社,2004.
[7]蔡永智,郝晓云,王 力,等. 中国薰衣草产业发展现状及对策[J]. 北方园艺,2020 (12):142-147.
[8]王学奎. 植物生理生化实验原理和技术[M]. 3版. 北京:高等教育出版社,2015.
[9]李合生. 植物生理生化试验原理和技术[M]. 3版. 北京:高等教育出版社,2015.
[10]Fu J M,Huang B R. Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress[J]. Environmental and Experimental Botany,2001,45(2):105-114.
[11]Bajji M,Bertin P,Lutts S,et al. Evaluation of drought resistance-related traits in durum wheat somaclonal lines selected in vitro[J]. Australian Journal of Experimental Agriculture,2004,44:27-35.
[12]Cervilla L M,Blasco B,Ríos J J,et al. Oxidative stress and antioxidants in tomato (Solanum lycopersicum) plants subjected to boron toxicity[J]. Annals of Botany,2007,100(4):747-756.
[13]黄 洁,孙其松,吴晓静,等. 花后不同时期模拟酸雨对小麦叶片光合作用和抗氧化系统的影响[J]. 核农学报,2015,29(9):1782-1790.
[14]马 超,孔蓓蓓,张 均,等. 不同引发剂处理对水分胁迫下小麦发芽及幼苗生理特性的影响[J]. 核农学报,2017,31(2):357-363.
[15]刘美迎,李小龙,梁 茁,等. 基于模糊数学和聚类分析的鲜食葡萄品种综合品质评价[J]. 食品科学,2015,36(13):57-64.
[16]陈永义,刘云丰,汪培庄. 综合评判的数学模型[J]. 模糊数学,1983(1):61-69.[HJ1.9mm]
[17]陈淑燕,毛培春,田小霞,等. 4种薰衣草属植物抗旱性综合评价[J]. 干旱地区农业研究,2013,31(6):152-158.
[18]杜长霞,李 娟,郭世荣,等. 外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响[J]. 西北植物学报,2007,27(6):1179-1184.
[19]Alscher R G,Erturk N,Heath L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J]. Journal of Experimental Botany,2002,53(372):1331-1341.
[20]王荣华,石 雷,汤庚国,等. 渗透胁迫对蒙古冰草幼苗保护酶系统的影响[J]. 植物学通报,2003,20(3):330-335.
[21]杨 芳,乔 岩,金中辉,等. 高温胁迫对马铃薯幼苗活性氧代谢及生理特性的影响[J]. 江苏农业科学,2022,50(11):97-103.
[22]黄其椿,赵洪涛,刘吉敏,等. 实生苗嫁接对红麻细胞质雄性不育系与保持系的生长发育及越冬抗寒性的影响[J]. 华中农业大学学报,2013,32(3):8-14.
[23]庞士铨. 植物逆境生理学基础[M]. 哈尔滨:东北林业大学出版社,1990.
[24]Guo Y P,Mi F G,Yan L J,et al. Physiological response and evaluation of drought resistance in different cultivars of bluegrass[J]. Acta Prataculturae Sinica,2014,23(4):220-228.
[25]徐小万,雷建军,李 颖,等. 基于数学模型的辣椒芽期耐高温多湿性综合评价方法[J]. 中国农业科技导报,2013,15(6):174-180.
[26]Cao X,Jiang F L,Wang X,et al. Comprehensive evaluation and screening for chilling-tolerance in tomato lines at the seedling stage[J]. Euphytica,2015,205(2):569-584.
[27]高青海,徐 坤,高辉远,等. 不同茄子砧木幼苗抗冷性的筛选[J]. 中国农业科学,2005,38(5):1005-1010.
[28]徐海成,尹燕枰,蔡 铁,等. 冬小麦拔节期不同茎蘖对低温胁迫的反应及抗冻性评价[J]. 应用生态学报,2013,24(8):2197-2204.
[29]李晓云,赵 勇,王 杰,等. 不同小麦品系耐低钾性的综合评价[J]. 麦类作物学报,2014,34(6):842-846.

