食药用菌多糖抗肿瘤机制的研究进展
刘学娟 张洁 王晶 尚校兰 乔洁 李战永 常世民 闫训友

摘要 肿瘤发病率逐年升高,对人类的危害不容忽视。天然活性物质食药用菌多糖提取工艺成熟,对机体毒副作用小,且具有较高的抗肿瘤药用价值。总结近十年来食药用菌多糖抗肿瘤机制的研究结果,分析了重要食药用菌的抗肿瘤特点、食药用菌抗肿瘤的调控机制及其功效,對多糖作为抗肿瘤纳米药物载体进行了阐述,对促进食药用菌多糖抗肿瘤应用的研究具有指导意义。
关键词食药用菌多糖;肿瘤;调控机制;功效
中图分类号R730.5文献标识码A
文章编号0517-6611(2023)08-0010-06
doi:10.3969/j.issn.0517-6611.2023.08.003开放科学(资源服务)标识码(OSID):
Research Progress on Antitumor Mechanism of Polysaccharides from Edible and Medicinal Fungus
LIU Xue-juan ZHANG Jie WANG Jing et al(1.College of Life Sciences,Langfang Normal University,Langfang,Hebei 065000;2.Technical Innovation Center for Utilization of Edible and Medicinal Fungi in Hebei Province,Langfang,Hebei 065000;3.Langfang Key Laboratory of Cell Engineering and Application Research,Langfang,Hebei 065000)
AbstractThe incidence of cancer is increasing year by year,and the harm to human beings cannot be ignored.The natural active substance-edible and medicinal fungus polysaccharide possess mature extraction process,which has little toxic and side effects on the body and high anti-tumor medicinal value.This paper summarizes the research results of the anti-tumor mechanism of edible and medicinal fungus polysaccharide in the past ten years,analyzes the anti-tumor characteristics of important edible and medicinal fungus polysaccharide and anti-tumor efficacy,and expounds the use of polysaccharides as anti-tumor nano drug carrier.It has guiding significance for the research on promoting the anti-tumor application of edible and medicinal fungus polysaccharide.
Key wordsEdible and medicinal fungus polysaccharide;Tumor;Manipulation mechanism;Effect
世界卫生组织国际癌症研究机构(IARC)发布最新数据显示,2020年全球新发癌症1 929万例,死亡996万例,死亡率达51.63%,而中国新发癌症457万例,死亡300万例,居全球之首。因此,癌症逐渐成为威胁人类健康的主要杀手,预防与治疗癌症已上升为我国国家战略,迫在眉睫。
肿瘤是机体在各种致瘤因素的刺激下,局部组织细胞异常增生形成的瘤状物。而癌症起源于上皮组织的恶性肿瘤,细胞分裂几乎不受控制并无限增殖,具有向周围组织侵袭以及向全身各处器官转移的能力,导致机体损伤并最终死亡。肿瘤的发展一般分为5个阶段:①癌前阶段,即每个正常细胞内都存在原癌基因与抑癌基因,当两者相互作用发生失衡,抑癌基因被抑制并且原癌细胞激活,正常细胞最终发生变异;②原位癌阶段,正常细胞发生变异成为癌细胞,通过机体不受控制分裂积聚为肿瘤;③浸润癌阶段,此时癌细胞无限制增殖并与人体正常细胞争夺营养;④转移阶段,俗称癌细胞扩散,症状凸显,很多患者发现肿瘤是在此阶段并已经难以治疗;⑤向远处播散阶段,此时癌细胞开始进入机体其他正常组织,一些器官受到影响,俗称癌症晚期。因此,预防与治疗癌症十分艰难。发现肿瘤后首先可以通过外科手术切除,也可以选择化疗与放疗手段,但化疗药物对人体有很多副作用,损伤正常细胞,长期使用危害很大[1]。相比于放疗、化疗、外科手术等传统的肿瘤治疗方法,天然活性物质中的食药用菌多糖在抗肿瘤方面具有重要意义,而且在人体内几乎没有任何副作用,毒理试验数据显示长期应用很安全,在国际上被称为“生物反应调节物”[2-3]。因此,该研究综述近十年来的研究结果,总结分析食药用菌多糖抗肿瘤的功效及其重要的作用机制,以期对食药用菌多糖抗肿瘤研究提供理论参考并对肿瘤的治疗提供新的思路。
1食药用菌多糖抗肿瘤研究
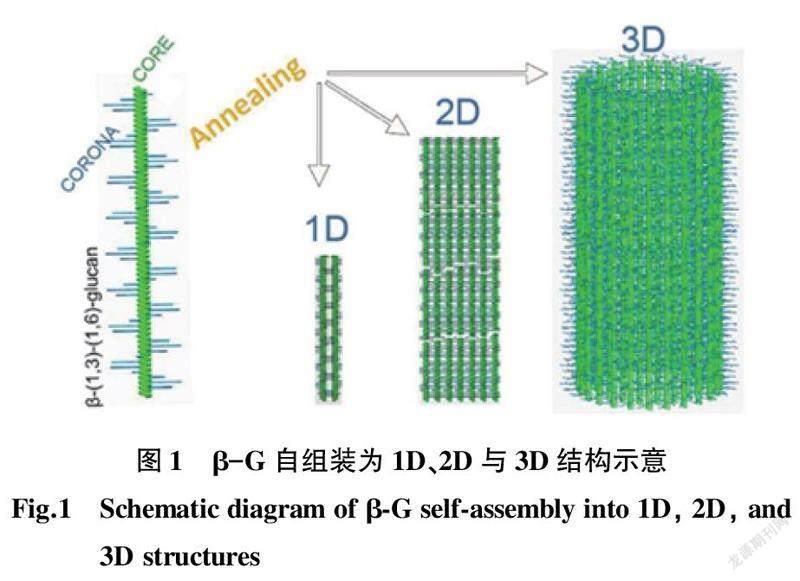
目前研究比较透彻和广泛的香菇多糖(lentinan,LNT)是一类从优质香菇子实体中提取的有效活性成分,其主要成分是具有分支的β-葡聚糖(β-Glucan,β-G),能够提高人体免疫机能,预防和治疗多种慢性疾病,减轻放疗和化疗的毒性反应等[4-6]。肿瘤免疫逃逸可以使肿瘤细胞避免被免疫系统识别和攻击,从而在体内迅速分裂与增殖,并促进其侵袭和转移,因此,免疫功能与肿瘤的形成与治疗有直接联系。目前,大量实验研究已经证实β-G可以通过有效调节和恢复肿瘤微环境免疫平衡而抑制肿瘤的发生与恶化[7-9],在众多研究成果中已有部分已经应用于临床治疗。例如,香菇多糖用于治疗消化道恶性肿瘤,在临床上已有研究发现,用单纯化疗与香菇多糖联合化疗2种方法对患者进行治疗,数据分析后证明香菇多糖对于消化道恶性肿瘤有着较为显著的临床疗效[10];同样,香菇多糖对于肺癌的治疗也有一定的影响,在化疗基础上加用香菇多糖使得患者生存质量大大提升[11];在香菇多糖治疗恶性肿瘤的临床观察中,发现加用香菇多糖的治疗组能够提高患者的免疫功能,从而提高治疗效果[12]。目前,试验研究已经成功实现将β-G自组装成1D到3D的纳米线、纳米片及纳米管结构[13],可作为抗癌纳米药物载体的理想选择对象,并具有优良的生物功能性与稳定性(图1)。纳米载体、食用菌多糖与癌症相关的研究受到广泛关注(图2)。
2重要食药用菌多糖的抗肿瘤特点
具有“药食同源”的食用菌以其营养价值高深受人们青睐,因其包含的生物活性物质潜在的功效,将有可能成为新一代的天然功能性保健品,尤其是其生物活性成分多糖,在辅助治疗肿瘤方面具有十分重要的应用。如鳞柄小奥德蘑多糖、灵芝多糖、茯苓多糖、香菇多糖、姬松茸多糖、羊肚菌多糖等。
2.1鱗柄小奥德蘑多糖鳞柄小奥德蘑原产地为中国,其菌柄表面明显存在褐色小鳞片。笔者发现鳞柄小奥德蘑多糖可以通过影响体外培养的巨噬细胞以抑制结直肠腺癌细胞的增殖。通过建立巨噬细胞和结直肠腺癌细胞的体外共培养体系,采用四甲基偶氮唑蓝法测定存活细胞数量,荧光探针法标记细胞内NO的合成,Griess法检测NO的分泌量,双抗体夹心法测定诱导型一氧化氮合成酶、肿瘤坏死因子-α和白细胞介素-1分泌量,发现鳞柄小奥德蘑多糖可能通过提高巨噬细胞对诱导型一氧化氮合成酶、NO和肿瘤坏死因子-α的合成或分泌,从而抑制结直肠腺癌细胞的增殖、增强巨噬细胞杀伤肿瘤细胞的能力,并降低了共培养体系中结直肠腺癌细胞的数量[14]。
2.2灵芝多糖灵芝是著名的药食两用真菌,为我国传统的名贵中药,药用历史悠久。其化学成分丰富,包括多糖、三萜、多肽、甾醇、核苷酸、脂肪酸、甾体、氨基酸等,其中重要的生物活性成分之一灵芝多糖,存在于担子菌门伞菌纲多孔菌目多孔菌科灵芝属真菌的菌丝体和子实体中,有着抗氧化、抗肿瘤、免疫调节等作用,在临床上应用广泛。李志强等[15]研究灵芝多糖对肺癌细胞A549的作用时,将肺癌细胞设为空白组、药物对照及低、中、高浓度组,用灵芝多糖进行干预并检测其中细胞凋亡蛋白的表达情况。发现灵芝多糖的干预不断延长,高浓度组细胞凋亡率随之增大,说明灵芝多糖能较好地抑制人肺癌的发展与扩散。王成财等[16]以荷膀胱瘤T24细胞小鼠为试验对象,设置对照组、顺铂组、灵芝多糖+顺铂组各10只,以腹腔注射的形式来控制变量,结果发现灵芝多糖能够增强细胞免疫,并且能够调节凋亡基因、AQP1以及AQP3的表达来抑制肿瘤生长。
2.3茯苓多糖茯苓多寄生于松植物的树根上,适应能力强,应用历史长达2 000年。茯苓多糖是茯苓的主要有效成分,具有多种药理作用,包括抗氧化、抗肿瘤、抗炎以及免疫调节等。近代临床及药理研究表明,茯苓多糖具有很好的抗肿瘤作用,具有增强免疫细胞的细胞毒作用,并可以激活机体对肿瘤的免疫监视系统,其机制与激活补体有关。胡康等[17]研究茯苓多糖对人乳腺癌细胞的影响时,发现茯苓多糖能够抑制MDA-MB-231细胞迁移,为茯苓多糖的抗乳腺癌研究提供依据。林丽霞等[18]探究茯苓多糖对胃癌的抑制作用时,通过移植人胃癌细胞的裸鼠作为研究对象,以茯苓多糖的不同剂量作为自变量,对每组小鼠进行给药,观察其肿瘤重量所发生的变化并借此计算抑癌率和肝、脾指数,最终发现茯苓多糖对于人胃癌移植瘤具有明显抑制作用。
2.4香菇多糖香菇为我国最早栽培的药食两用菌,具有多种药理活性。香菇多糖是从优质香菇子实体中提取的有效活性成分,可以作为一种宿主免疫增强剂,它具有抗肿瘤、抗病毒以及免疫调节等作用。其良好的抗肿瘤功效,经过了许多临床与药理研究,得到了较好结果。徐文琴等[19]探讨香菇多糖对乳腺癌的抑制机制时,发现香菇多糖能够使乳腺癌4T1细胞移植瘤小鼠的外周血、肿瘤及脾组织内IL-35表达水平降低,对移植瘤有显著抑制作用。刘亚涛等[20]发现,单纯顺铂治疗的患者与在此基础上联合香菇多糖治疗的患者相比,后者效果更加显著。
2.5姬松茸多糖姬松茸多糖是从姬松茸子实体中提取出来的活性成分,具有良好的药用价值,在抗肿瘤、抗氧化、抗衰老、抗辐射、免疫调节以及降血糖等方面有较好的作用。姬松茸多糖可以迅速有效地减轻化学疗法等传统治疗方法所带来的难受又危险的副作用。Bamba[21]在研究姬松茸多糖提取物对小鼠结肠炎的抑制作用时,发现姬松茸多糖能够减少结肠黏膜组织受到损伤,且能刺激杯状细胞的产生来抑制炎症的发生。冯义伶等[22]分析姬松茸多糖对患有胰腺癌的小鼠代谢作用的影响时,建立小鼠模型并与试验组对照,发现姬松茸多糖能够改善小鼠胰腺癌的情况,提高免疫力。
2.6羊肚菌多糖羊肚菌是羊肚菌科羊肚菌属的真菌,也称羊肚菜、羊蘑等,其味道独特且营养丰富,是一种珍稀药食兼用菌,内含人体需要的多种氨基酸、维生素、矿物质、多糖、脂肪酸化合物、酶类以及有机锗。其中羊肚菌多糖是羊肚菌中能够抑制肿瘤的活性成分,有抑制肿瘤、抗疲劳、抗病毒以及增强机体免疫力的功效。李谣等[23]在研究羊肚菌多糖对乳腺癌细胞的作用时,发现羊肚菌多糖能够使B淋巴细胞瘤-2(Bcl-2)蛋白表达水平降低,而使Bcl-2相关X蛋白表达,后者与前者的比值增加,表现出对乳腺癌的抑制作用。黄瑶[24]对羊肚菌多糖的抗肿瘤机制进行研究时,以S180小鼠为研究对象,发现羊肚菌多糖能够在一定浓度范围内抑制肿瘤细胞增殖的活性,对S180细胞有显著抑制作用。
3食药用菌多糖抗肿瘤的调控机制
肿瘤免疫逃逸可以使肿瘤细胞避免被免疫系统识别和攻击,从而使肿瘤细胞在体内迅速分裂与增殖,并促进其侵袭和转移,因此,免疫功能与肿瘤的形成与治疗有直接联系,通过调节人体的免疫能力预防与治疗肿瘤具有十分重要的意义。天然活性物质中的食药用菌多糖具有“生物反响调理物”的国际称号,可以作为免疫增强剂与免疫激活剂。因此,食用菌多糖可以调节免疫系统来增强抗肿瘤能力,其对免疫系统的影响因素包括细胞因子、免疫细胞与免疫器官。
3.1通过细胞因子增强抗肿瘤能力细胞因子是由免疫细胞和某些非免疫细胞经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质,能够调控免疫应答。食药用菌多糖能够通过调节细胞因子水平来调节免疫系统,继而实现抗肿瘤作用。葛唯佳等[25]在研究杂色云芝酸溶性多糖对H22荷瘤小鼠的抗肿瘤作用试验中,通过空白组与不同剂量的杂色云芝酸溶性多糖组的对照试验分析,发现抑瘤率不仅随着剂量的增加而增大,同时杂色云芝酸溶性多糖组还能改善免疫器官指数,提高血清细胞因子γ-干扰素、肿瘤坏死因子-α的水平,来发挥抗肿瘤作用。刘媛媛等[26]通过研究羟甲基茯苓多糖(CMP)可以增强免疫作用实现抗肿瘤,分析发现CMP对小鼠T淋巴细胞分泌γ-干扰素(IFN-γ)、白细胞介素-10(IL-10)具有重要影响,通过体外观察CMP对T细胞毒性作用,检测IFN-γ、IL-10的含量,发现CMP能够显著提高IFN-γ的水平,降低IL-10的水平,从而增强机体免疫力。吴会清[27]研究灵芝多糖的抗肿瘤作用时,以S180荷瘤小鼠为对象,发现灵芝多糖能够调节血清细胞因子水平,降低脏器指数以增强免疫抑制肿瘤。马高兴[28]在对杏鲍菇多糖(PEP)对肠道免疫功能的研究中,将PEP分离纯化并给患有结肠炎的小鼠灌胃,发现杏鲍菇纯化多糖可显著抑制小鼠结肠炎相关症状。其原因是PEP能够显著提高各脏器指数(包括肝脏、脾脏、胸腺等免疫器官)以及TNF-α、IFN-γ、IL-1、IL-2及IL-6等免疫因子,增强小鼠肠道微环境免疫应答功能。朱薇珊等[29]以非小细胞肺癌合并肺结核患者为研究对象,随机将患者分为化疗组和联合组(化疗+香菇多糖注射)。接受6个月的治疗后,利用SPSS 22.0统计学软件进行数据处理,分析发现联合组患者治疗后,细胞因子IL-2、IFN-γ显著高于化疗组。因此,香菇多糖能够提高免疫细胞因子来增强机体免疫,从而实现治疗效果。姜爽等[30]利用噻唑蓝法计算正常小鼠脾淋巴细胞增殖刺激率,吞噬中性红法检测荷瘤小鼠脾巨噬细胞的活性;随后进行体内抗肿瘤试验,并设置模型组、山慈菇多糖组(低、中、高剂量)、环磷酰胺组,利用流式细胞术以及ELISA法检测荷瘤小鼠脾细胞中T淋巴细胞亚群和血清中细胞因子的含量。经SPSS 16.0统计软件进行数据处理,分析发现山慈菇多糖能够通过提高CD4/CD8比值及白细胞介素-2、肿瘤坏死因子-α、干扰素-γ水平来提升肿瘤抑制作用。刘肖肖等[31]利用流式细胞仪来检测金针菇子实体多糖培养的小鼠脾淋巴细胞CD3/CD25表达水平,CBA试剂盒检测IL-2、IL-4、IL-5、IFN-γ、TNF的分泌量。采用ELISA法检测小鼠骨髓源巨噬细胞IL-6、TNF-α、IL-1β细胞因子的分泌量。通过SPSS 13.0软件对数据进行处理,分析发现金针菇子实体多糖能够显著提高TNF、IFN-γ细胞因子的分泌量,诱导特异性免疫激活,实现肿瘤抑制。张景欣等[32]对恶性肿瘤患者注射香菇多糖注射液并结合化疗,测定其T淋巴细胞亚群及NK细胞的水平,通过对比单纯化疗和化疗基础上联合香菇多糖注射液的治疗结果,发现后者外周血CD3、CD4、CD4/CD8水平要高于单纯化疗组,因此认为香菇多糖注射液能够提高免疫细胞水平,增强免疫力,保护患者免疫机能。
3.2通过免疫细胞增强抗肿瘤能力免疫细胞是参与免疫调节或与免疫调节有关的细胞,一般可以分为3大类,包括淋巴细胞、单核-吞噬细胞和参与免疫应答的细胞。李东东等[33]发现桑黄多糖通过影响肿瘤微环境中的细胞成分(如T、B淋巴细胞,巨噬细胞,NK细胞和LAK细胞,树突状细胞)来调节肿瘤免疫微环境,抑制肿瘤细胞增殖。Li等[34]在研究猪苓多糖时,发现猪苓多糖可以诱导小鼠骨源性树突状细胞的表型和功能成熟。Zheng等[35]由于有研究发现黏附在肿瘤细胞表面的纤维蛋白原涂层可抑制NK细胞对肿瘤的细胞毒性,在体外培养黑色素瘤细胞B16和A375,利用流式细胞仪分析,研究灵芝多糖的作用,结果表明,灵芝多糖能够抑制纤维蛋白原的黏附,促进NK细胞的杀伤肿瘤细胞的作用。蒋定文等[36]在研究灵芝多糖胶囊对免疫抑制小鼠免疫功能的影响时,利用乳酸脱氢酶法来测定NK细胞杀伤活性,用酶标仪在492 nm处测定A值,发现灵芝多糖低、中、高剂量组的NK细胞杀伤活性明显高于空白对照组,因此可以认为灵芝多糖胶囊对NK细胞杀伤活性有一定的促进作用,能够提高对肿瘤细胞的杀伤作用。许晓燕等[37]设置不同浓度的灵芝多糖,用来处理小鼠以及EA.hy926细胞,经统计学方法计算分析得知,灵芝多糖处理过的小鼠抑瘤率明显大于对照组,运用免疫组化法以及Western blot法检测T淋巴细胞浸润情况,发现灵芝多糖可以通过增加T淋巴细胞浸润来抑制肿瘤的生长。
3.3通过免疫器官增强抗肿瘤能力Li等[38]为筛选出具有抗宫颈癌和调节作用的龙葵多糖(SNL-P)抗肿瘤活性成分,并评价其对胸腺的保护作用,利用柱层析法分离纯化SNL-P,以及小鼠腹水U14细胞模型,通过组织学观察和TUNEL染色观察,发现SNL-P组分1a对U14宫颈癌有明显的抑制作用,并对小鼠胸腺组织有明显的保护作用。由此看出,SNL-P可以通过保护免疫器官实现抗肿瘤作用。吕苏成等[39]将S180肉瘤细胞接种至小鼠体内,并将其分为正常对照组、正常+多糖组、肿瘤对照组、肿瘤+多糖对照组,连续用药后,利用ANAE染色法检测ANAE阳性淋巴细胞、吞噬试验以及PFC试验,同时还进行了临床试验观察。发现茯苓多糖在250 mg/(kg·d)时,能够使得胸腺、脾脏重量达到较正常水平,并且瘤重减小,起到保护免疫器官抑制肿瘤发生的作用。王红等[40]研究榆耳酸溶性多糖对小鼠H22移植瘤的抗肿瘤作用时,通过多个指标来观察,利用HE染色法观察肿瘤组织的病理改变,TUNEL法检测细胞凋亡情况,发现榆耳酸溶性多糖可以通过提高小鼠脾脏、胸腺等免疫器官指数诱导肿瘤细胞凋亡来抑制肿瘤的生长。
4食药用菌多糖抗肿瘤功效
4.1抑制肿瘤细胞的迁移肿瘤的迁移是癌症难以治愈的根本原因之一,而食药用菌多糖对其有着明显的抑制作用。万茜淋等[41]采用CCK-8法和流式细胞术以及显微镜结合DAPI染色法分析、检测和观察香菇多糖对SHG-44细胞增殖、周期变化以及细胞凋亡形态,发现香菇多糖通过调节SHG-44细胞周期来抑制细胞的增殖和迁移,借此抑制肿瘤的发展。张密霞等[42]研究茯苓多糖对Lewis肺癌小鼠自发肺转移的影响时,接种肿瘤细胞后开始对小鼠给药,通过分析发现茯苓多糖对Lewis肺癌小鼠的肿瘤体积与质量无直接明显作用,但是高剂量的茯苓多糖可以减少肺表面转移灶个数,增加白细胞 CD11b、CD18mRNA 表达,抑制自发肺转移。最终猜测茯苓多糖抑制肿瘤转移可能通过活化外周血白细胞实现。李颖博等[43]利用荧光染料标记人脐静脉内皮细胞(HUVECs)以及人前列腺癌细胞(PC-3M),给予不同浓度的灵芝多糖进行培养,在荧光显微镜下观察,采用SPSS 11.5统计软件进行数据处理,分析发现在一定浓度范围内,灵芝多糖能够降低HUVECs与PC-3M之间的黏附作用,并降低穿过单层内皮细胞的肿瘤细胞数量,降低肿瘤细胞的转移。胡康等[17]用不同浓度的茯苓多糖对人乳腺癌MDA-MB-231细胞进行处理后,进行染色并在显微镜下观察细胞迁移活动,通过实时荧光定量PCR检测SATB-1基因表达情况。结果发现茯苓多糖对MDA-MB-231细胞迁移有较强的抑制作用,且茯苓多糖对SATB-1的表达有显著抑制,表明茯苓多糖可能是通过抑制SATB-1基因的表达来抑制MDA-MB-231细胞迁移,从而抑制肿瘤发生。梁岚[44]以灵芝多糖作为试验变量,研究其对内皮细胞间的黏附与迁移的影响。将培养好的肿瘤细胞与内皮细胞融合,并设置了空白对照组以及不同浓度的灵芝多糖组,观察两者间的相互作用,最终发现加入灵芝多糖的试验组中,内皮细胞与肿瘤细胞间产生的黏附作用和迁移反应被阻碍,即抑制腫瘤细胞的迁移,从而达到抗肿瘤的效果。张晓春等[45]利用鸡胚尿囊膜血管生成模型探究了灵芝多糖对人前列腺癌PC-3M亚系PC-3M-1E8细胞黏附功能的影响,以药物溶媒PBS作为对照,在培养板上的小孔中分别加入不同浓度的灵芝多糖,根据酶标仪测出的吸光度值计算出细胞黏附抑制率,利用统计学方法进行分析,发现在0.33~33.00 g/L剂量范围内,灵芝多糖能够显著抑制肿瘤细胞间的黏附。吴建珩等[46]设置了不同浓度的桑黄多糖组,并分别处理胶质瘤细胞,利用MTT比色法检测抑瘤率,并用划痕试验和Transwell细胞侵袭试验检测胶质瘤的迁移和侵袭能力,经过统计学方法分析发现桑黄多糖处理48 h后的肿瘤细胞迁移率显著降低,抑制了肿瘤的生长。
4.2抑制血管生成新生血管的形成能够为肿瘤的活动提供营养物质,因此血管生成与肿瘤发生发展密切相关。朱青静[47]通过MTT法与Tuber formation assay法检测出香菇多糖均可抑制人脐静脉内皮细胞增殖、迁移、黏附以及体外血管的生成,发现香菇多糖的抑制作用呈剂量依赖型,剂量越大,抑制作用越强。在500 mg/L的质量浓度下抑制血管生成最显著。因此,香菇多糖可能通过抑制血管生成来实现其抗肿瘤作用。吴凯南等[48]采用BallB/C小鼠乳腺梭形细胞癌模型以及肿瘤诱导的皮肤血管生成技术,将实验小鼠分为对照和治疗组[1 g/(kg·d)云芝胞内多糖,进行管饲给药],利用XTL-II型体视显微镜、HE染色观察及癌组织TGF-β1免疫组化检测,来观察分析。结果发现,云芝胞内多糖能够显著降低TGF-β1的水平,来抑制血管生成,从而达到治疗肿瘤的目的。郭鹏荣等[49]以接种人膀胱癌T24细胞的裸鼠为研究对象,进行体内抑瘤试验,随机分为生理盐水组、顺铂组、顺铂+灵芝多糖组,计算肿瘤体积、绘制肿瘤生长曲线并计算抑瘤率,标记肿瘤微血管,计算肿瘤微血管密度。在一段时间的试验后发现,顺铂+灵芝多糖组微血管分布对其他2组比较稀疏,肿瘤微血管密度明显呈下降的趋势,同时顺铂+灵芝多糖组能够有效抑制肿瘤生长。因此,可以认为灵芝多糖能够抑制肿瘤微血管生成,从而抑制肿瘤生长。
4.3提高凋亡蛋白基因表达诱导肿瘤细胞凋亡细胞凋亡对肿瘤抑制有着至关重要的作用。邢会军等[50]在探讨灵芝多糖体内外抗肿瘤作用的试验中,通过改变使用剂量,发现灵芝多糖能够在体内外抑制胃肿瘤细胞生长,这一作用与增加Bax基因表达、抑制bcl-2基因表达,从而促进肿瘤细胞凋亡有关。王静林[51]探讨香菇多糖在非免疫途径的抗肿瘤作用中,提出了细胞凋亡的2种诱导途径,即内源性途径(线粒体凋亡通路,增加Bax基因表达,活化Caspase-9从而激活Caspase-3,诱导细胞凋亡)和外源性途径(死亡受体凋亡通路,上调TNF-α水平,活化Caspase-8,从而激活Caspase-3,诱导细胞凋亡),首次发现香菇多糖能诱导细胞自噬,其自噬表现为自噬性细胞死亡。甘霓等[52]以B16细胞为研究对象,建立黑色素瘤模型,检测黑木耳多糖对荷瘤小鼠肿瘤大小的影响,发现黑木耳多糖能够促进肿瘤细胞中Bax、P53、Caspase-3 mRNA的表达,诱导肿瘤细胞凋亡。Liu等[53]从蛹虫夏草发酵菌丝体和栽培子实体中分别获得了CMPS-II和CBPS-II多糖抗肿瘤活性的比较。经过一系列试验,发现当浓度为500 μg/mL时,CMPS-II和CBPS-II的抑制率分别为54.55%和34.80%。且CMPS-II和CBPS-II均可提高细胞凋亡因子Caspase-3、Caspase-9和p53的蛋白和mRNA表达水平,同时降低增殖细胞核抗原的蛋白和mRNA表达水平,诱导肿瘤细胞凋亡。唐恩红等[54]对人宫颈癌HeLa细胞进行细胞培养,取对数生长期的细胞进行试验,利用MTT法检测细胞增值率筛选出适宜低、中、高浓度的茯苓多糖。不同浓度下培养HeLa细胞,利用流式细胞仪检测细胞凋亡率和细胞周期,并利用Western blot法检测增殖、凋亡、迁移、ERK通路相关蛋白的表达。通过SPSS 16.0统计软件对数据进行处理,分析发现茯苓多糖能够显著增加HeLa细胞的凋亡率,通过增加Cleaved Caspase 3、Cleaved Caspase 8、Cleaved Caspase 9和Bax的表达来实现。张爱龙等[55]设置不同浓度(0、50、100、200、500、1 000 μg/mL)的金针菇多糖作为试验组,分别处理肝癌细胞HepG2。明确其对肝癌细胞增殖以及细胞凋亡的影响后,利用荧光染色法以及试剂盒法检测肝癌细胞的形态变化以及凋亡蛋白Caspase3、8、9的活性变化,最终发现随着金针菇多糖浓度的增大,Caspase3、8、9的表达增大,细胞凋亡率也增大。因此,可以认为金针菇多糖通过提高凋亡蛋白的表达来诱导肝癌细胞凋亡。朱俭勋等[56]通过不同来源的桑黄粗多糖对肝癌细胞HepG2进行处理,发现大多数桑黄子实体粗多糖对HepG2都有抑制作用,不同的桑黄粗多糖作用效果不同,但基本上都是通过cyclin-cdk复合物来调控HepG2细胞S期的变化,以及增加促凋亡蛋白基因Bcl-XS、Bad、Bax、Bid的表达,诱导细胞凋亡。Lu 等[57]通过一系列体外试验来检测牛樟芝硫酸多糖(SPS)的抗肿瘤作用,发现SPS可以诱导细胞周期阻滞、激活caspase-3和PARP,从而来实现抗肿瘤作用。
4.4食药用菌多糖纳米载体靶向治疗癌细胞该研究分析发现,纳米粒子表面只要有疏水性配体的修饰,就会引起血清蛋白的吸附,而随着亲水性配体(例如多糖修饰)比例的增加,血清蛋白的吸附会降低,从而提升其运输效率,而且纳米载药体表面亲疏水配体的比例也会直接影响其跨膜效率[58]。因此,纳米载体表面修饰食药用菌多糖可以显著提高纳米载体的递送效率。Jia等[59]证明香菇多糖单链(LNT)在复性过程中可以螺旋缠绕到棒状羧基化碳纳米管(SWNT-COOH)上,不仅减小了棒状SWNT-COOH的聚集程度,提高其扩散效率,而且大大降低了细胞毒性,提高了生物相溶性,在药物递送中被寄予厚望并备受学者和临床的高度青睐。多糖除了可以作为修饰载体的配体外,还可以自组装成不同的结构作为纳米载体[13,60],不仅具有优良的水溶性、生物相溶性与稳定性,而且易于化学修饰,可以作为免疫增强剂与免疫激活剂,是抗肿瘤药物载体的理想选擇对象。
5结语与展望
食药用菌多糖的抗肿瘤作用备受关注,并且在临床上已经有所应用。食药用菌多糖通过免疫调节作用抗肿瘤的途径有调节细胞因子水平、提升免疫细胞水平、保护免疫器官等,最终可以抑制肿瘤细胞的生长与迁移、抑制血管生成、诱导肿瘤细胞凋亡与自噬。而且食药用菌多糖作为天然高分子聚合物,是抗癌纳米药物载体的理想选择对象。
然而,食药用菌多糖抗肿瘤机制研究涉及多方面的理论、方法和技术,仍需要在实际应用中不断积累和完善,作进一步研究和开发:①食药用菌多糖的抗肿瘤作用与其自身结构的关系。食药用菌多糖种类繁多,作用机制也不甚相同,因此,明确其结构与抗肿瘤机制间的关系对于抗肿瘤药物的研发与应用具有重要意义。②其作用靶点尚未明确,已知食药用菌多糖既能够直接作用于肿瘤细胞,也能间接作用于免疫系统,但这两者之间是否有紧密关系,还不是很清楚。③食药用菌多糖作为纳米药物载体的研究与应用还不是很成熟,尤其是调控其在肿瘤间质及跨膜运输过程的分子机制尚不明确,载药与释药效率研究也较少。随着科技的发展与抗肿瘤机制的进一步明确,食药用菌多糖在癌症治疗上的应用会不断成熟,给予病人更多战胜疾病的信心。
参考文献
[1] SCHNEIDER G,SELLERS Z P,RATAJCZAK M Z.Induction of a tumor-metastasis-receptive microenvironment as an unwanted side effect after radio/chemotherapy and in vitro and in vivo assays to study this phenomenon[M]∥TURKSEN K.Stem cell heterogeneity.New York:Springer,2016:347-360.
[2] LONSENY T,尹源明,何国庆.复合食用菌多糖抗肿瘤作用的研究[J].中国食品学报,2005,5(2):90-93.
[3] 王思芦,汪开毓,陈德芳.食用真菌多糖免疫调节作用及其机制研究进展[J].动物医学进展,2012,33(11):104-108.
[4] 杨鑫,樊吴静,李丽淑,等.香菇多糖对马铃薯疮痂病抗性及生理特性的影响[J].西南农业学报,2019,32(1):98-103.
[5] ZHANG M,ZHANG Y R,ZHANG L J,et al.Mushroom polysaccharide lentinan for treating different types of cancers:A review of 12 years clinical studies in China[J].Progress in molecular biology and translational science,2019,163:297-328.
[6] 黄在兴,刘凌云,陈华,等.灵芝多糖肽对肝癌细胞Huh7活性、迁移和细胞凋亡的影响[J].西南农业学报,2020,33(4):742-746.
[7] 殷合,林杨光.香菇多糖协同增强GP方案治疗Ⅳ期肺鳞癌的疗效观察[J].癌症进展,2016,14(7):687-689.
[8] 符映均,高欣,田振,等.香菇多糖对肿瘤微环境免疫调节作用的研究进展[J].现代药物与临床,2019,34(9):2870-2875.
[9] LOU X,HUANG S W,LUO S,et al.Identification of genes underlying the enhancement of immunity by a formula of lentinan,pachymaran and tremelia polysaccharides in immunosuppressive mice[J].Scientific reports,2018,8(1):1-10.
[10] 李剑萍,路萍,王冬冬,等.香菇多糖联合化疗治疗晚期消化道恶性肿瘤的临床疗效[J].中国药物经济学,2014,9(S1):151-152.
[11] 赵璐.香菇多糖联合化疗治疗中晚期非小细胞肺癌临床观察[J].安徽医药,2012,16(10):1496-1497.
[12] 安爱军,安广文,叶进科.香菇多糖对中晚期胃恶性肿瘤化疗增效减毒临床观察及安全性评价[J].中国医药导报,2012,9(17):63-65.
[13] WU C X,WANG X Y,CHU B,et al.Self-assembly of core-corona β-glucan into stiff and metalizable nanostructures from 1D to 3D[J].ACS Nano,2018,12(10):10545-10553.
[14] 张绍楠,刘紫征,赵敏,等.鳞柄小奥德蘑多糖对体外培养的巨噬细胞抑制结直肠腺癌细胞生长的影响[J].西南农业学报,2019,32(6):1340-1346.
[15] 李志强,何玉霞.灵芝多糖对人肺癌A549细胞增殖凋亡的作用[J].现代食品科技,2021,37(5):38-42.
[16] 王成财,梁文波.灵芝多糖对荷膀胱癌T24细胞小鼠T细胞亚群及AQP1、AQP3表达的影响[J].中国生化药物杂志,2016,36(12):33-36.
[17] 胡康,罗清,朱晓峰,等.茯苓多糖对人乳腺癌MDA-MB-231细胞迁移的影响及机制[J].中国老年学杂志,2019,39(21):5316-5319.
[18] 林丽霞,薛银萍,陈燕,等.茯苓多糖对人胃癌裸鼠移植瘤的抑制效应研究[J].解放军医药杂志,2015,27(11):60-63.
[19] 徐文琴,吴艳红,余方流,等.香菇多糖抑制乳腺癌4T1细胞小鼠移植瘤增殖机制研究[J].中华肿瘤防治杂志,2021,28(2):111-116.
[20] 刘亚涛,王合法,孙亚鹏.香菇多糖联合顺铂治疗肺癌胸腔积液的效果观察[J].河南医学研究,2017,26(17):3153-3154.
[21] BAMBA D.姬松茸多糖提取物对化学诱导小鼠结肠炎的抑制作用[D].大连:大连医科大学,2016.
[22] 冯义伶,郭仁德,曲雅静,等.姬松茸多糖结合硒对胰腺癌恶病质小鼠代谢作用的影响[J].川北医学院学报,2020,35(3):357-360,383.
[23] 李谣,陈金龙,王丽颖,等.羊肚菌多糖抑制人乳腺癌细胞MDA-MB-231增殖和诱导细胞凋亡研究[J].食品科学,2016,37(21):214-218.
[24] 黃瑶.羊肚菌多糖(ME-X)结构鉴定、生物活性及抗肿瘤机制的研究[D].南充:西华师范大学,2019.
[25] 葛唯佳,赵岩,图力古尔,等.杂色云芝酸溶性多糖对H22荷瘤小鼠的抗肿瘤作用[J].西北农林科技大学学报(自然科学版),2018,46(1):8-14.
[26] 刘媛媛,陈友香,侯安继.羧甲基茯苓多糖对小鼠T淋巴细胞分泌细胞因子的影响[J].中药药理与临床,2006,22(S1):71-73.
[27] 吴会清.灵芝多糖对S180荷瘤小鼠血清细胞因子水平与脏器指数的影响[J].中国药房,2014,25(35):3273-3275.
[28] 马高兴.杏鲍菇多糖对肠道免疫功能的影响及其作用机理[D].南京:南京农业大学,2018.
[29] 朱薇珊,张斌.香菇多糖联合奈达铂和多西他赛对非小细胞肺癌合并肺结核患者血清炎性因子水平的影响[J].中国肿瘤临床与康复,2020,27(1):27-30.
[30] 姜爽,徐婧瑶,苏鑫,等.山慈菇多糖的免疫调节作用及对小鼠骨肉瘤细胞S180体内生长抑制作用[J].食品科学,2018,39(13):216-221.
[31] 刘肖肖,汪雯翰,冯婷,等.金针菇子实体多糖FVPB1对小鼠T细胞和巨噬细胞的免疫调节作用[J].食用菌学报,2019,26(4):123-130.
[32] 张景欣,马明.香菇多糖注射液对恶性肿瘤患者T淋巴细胞亚群及NK细胞的影响[J].中医药学报,2015,43(4):116-118.
[33] 李东东,刘海燕,宿抱玉,等.桑黄多糖对肿瘤微环境影响的研究[J].泰山医学院学报,2020,41(4):318-320.
[34] LI X Q,XU W,CHEN J.Polysaccharide purified from Polyporus umbellatus (Per) Fr induces the activation and maturation of murine bone-derived dendritic cells via toll-like receptor 4[J].Cellular immunology,2010,265(1):50-56.
[35] ZHENG S,JIA Y P,ZHAO J,et al.Ganoderma lucidum polysaccharides eradicates the blocking effect of fibrinogen on NK cytotoxicity against melanoma cells[J].Oncology letters,2012,3(3):613-616.
[36] 蒋定文,张洁,何颖,等.灵芝多糖胶囊对免疫抑制小鼠免疫功能的影响[J].解放军医学杂志,2016,41(9):719-724.
[37] 许晓燕,罗霞,宋怡,等.灵芝多糖通过调节内皮细胞ICAM-1表达促进T淋巴细胞肿瘤浸润的研究[J].中国中药杂志,2021,46(19):5072-5079.
[38] LI J,LI Q W,PENG Y,et al.Protective effects of fraction 1a of polysaccharides isolated from Solanum nigrum Linne on thymus in tumor-bearing mice[J].Journal of ethnopharmacology,2010,129(3):350-356.
[39] 吕苏成,孔玮,曹巧琍,等.茯苓多糖对荷瘤小鼠及老年人和肿瘤患者免疫功能影響的探讨[J].当代医师杂志,1996(9):5-7.
[40] 王红,赵岩,蔡恩博,等.榆耳酸溶性多糖对肝癌H22小鼠的抑瘤作用研究[J].世界科学技术-中医药现代化,2017,19(1):142-148.
[41] 万茜淋,任雨贺,吕瑞娜,等.香菇多糖对神经胶质瘤SHG-44细胞增殖、周期、凋亡及迁移的影响[J].中成药,2019,41(11):2614-2619.
[42] 张密霞,李怡文,张德生,等.茯苓多糖对Lewis肺癌小鼠自发肺转移的抑制作用及其机制研究[J].现代药物与临床,2013,28(6):842-846.
[43] 李颖博,李宇华,王瑞,等.灵芝多糖对肿瘤细胞与内皮细胞相互作用的影响[J].中国药理学通报,2008,24(2):250-253.
[44] 梁岚.灵芝多糖对肿瘤细胞与内皮细胞相互作用的影响[J].中国药房,2012,23(43):4055-4056.
[45] 张晓春,陈赣玲,马兵,等.灵芝多糖抑制鸡胚尿囊膜模型中的血管生成及细胞黏附[J].基础医学与临床,2005,25(9):825-828.
[46] 吴建珩,王振,袁小威,等.桑黄多糖抑制胶质瘤细胞增殖与迁移作用机制研究[J].中华肿瘤防治杂志,2020,27(11):840-847.
[47] 朱青静.香菇多糖体外抗血管生成作用实验研究[J].中医学报,2017,32(12):2426-2429.
[48] 吴凯南,林辉,孔令泉,等.云芝胞内多糖抑制肿瘤血管生成和移植性乳腺癌生长的实验研究[J].中华普通外科杂志,2001,16(2):124.
[49] 郭鹏荣,盛玉文,刘奔,等.灵芝多糖对顺铂抑制荷膀胱癌T24细胞裸鼠肿瘤生长及血管生成作用的影响[J].解放军医学杂志,2014,39(6):470-474.
[50] 邢会军,侯雷,孙勇,等.灵芝多糖对小鼠胃肿瘤活性的体内外抑制作用[J].中国实验方剂学杂志,2017,23(13):116-120.
[51] 王静林.香菇多糖对人HT-29结肠癌的非免疫途径抗肿瘤作用及机制研究[D].武汉:华中科技大学,2019.
[52] 甘霓,吴小勇,郑传进,等.黑木耳多糖对B16黑色瘤细胞抗肿瘤作用研究[J].广东药科大学学报,2017,33(6):758-762.
[53] LIU X C,ZHU Z Y,LIU Y L,et al.Comparisons of the anti-tumor activity of polysaccharides from fermented mycelia and cultivated fruiting bodies of Cordyceps militaris in vitro[J].International journal of biological macromolecules,2019,130(1):307-314.
[54] 唐恩红,蔡旺.茯苓多糖对人宫颈癌HeLa细胞增殖、迁移、促凋亡的影响及其机制[J].肿瘤防治研究,2019,46(8):707-713.
[55] 张爱龙,赵飞,金周雨,等.金针菇多糖抑制肝癌HepG2细胞增殖并诱导细胞凋亡[J].吉林农业大学学报,2019,41(5):521-525.
[56] 朱俭勋,钟石,孙海燕,等.不同来源桑黄粗多糖诱导肝癌细胞HepG2 S期阻滞及凋亡的研究[J].蚕业科学,2020,46(1):96-104.
[57] LU M K,LIN T Y,CHAO C H,et al.Molecular mechanism of Antrodia cinnamomea sulfated polysaccharide on the suppression of lung cancer cell growth and migration via induction of transforming growth factor βreceptor degradation[J].International journal of biological macromolecules,2017,95:1144-1152.
[58] LIU Y C,LI S X,LIU X J,et al.Design of small nanoparticles decorated with amphiphilic ligands:Self-preservation effect and translocation into a plasma membrane[J].ACS applied materials & interfaces,2019,11(27):23822-23831.
[59] JIA X W,CHEN P,XU X J,et al.Lentinan greatly enhances the dispersibility of single-walled carbon nanotubes in water and decreases the cytotoxicity[J].Bioactive carbohydrates and dietary fibre,2013,1(2):111-119.
[60] 鄭荣,李珍,闵洁,等.双亲性多糖胶束的制备及作为纳米药物载体应用研究进展[J].高分子通报,2021(12):1-12.

