基于疫苗研究的非洲猪瘟防控现状
王蒙蒙, 金 鑫
(延边大学 农学院,吉林 延吉 133002)
非洲猪瘟(African swine fever,ASF)是具有急性、热性、出血性等临床特征的高度致死性传染病[1]。20世纪20年代首次在国外发现并公开报道,在欧洲循环传播后传至南美洲,又传入俄罗斯联邦,最后蔓延至我国境内,2018年在辽宁省首次发现ASF疫情[2]。2020—2022年9月2日,已有45个国家相继报告ASF疫情(图1)[3]。

图1 按行政区划显示ASF存在的世界地图
1 ASFV病原体特征
ASF病原体是非洲猪瘟病毒(African swine fever virus,ASFV),它是目前唯一已知的分子结构复杂的线性双链DNA虫媒病毒,属非洲猪瘟病毒科(Asfarviridae)、猪瘟病毒属(Asfivirus)[4]。传播途径较广,可通过间接接触受感染的软蜱(ornithodoros spp)进行媒介传播,也可直接接触感染的家猪或野猪以及饲料、污染物等传播病原体[5]。病毒主要在细胞质复制,早期也在细胞核[6],具有细胞嗜性,天然靶细胞是单核细胞或者是巨噬细胞。从形态学上,ASFV具有二十面体对称型结构,平均直径为260 nm[6],自内向外的结构分别是拟核基因组(nucleoid)、核芯壳(core shell)、内膜(inner envelope)、衣壳 (capsid)和囊膜(outer envelo-pe) 5层结构[7](图2)。毒株基因组大小为170~194 kb,含有150~167个开放阅读框(open reading fra-mes, ORF),编码 150~200种病毒蛋白,包括 68种结构蛋白和100多种非结构蛋白[8]。基因组大小差异主要是源于属于多基因家族(multigene families, MGFs)基因拷贝的增加或丢失以及基因组非编码区串联重复序列数量的变化[9]。

图2 ASFV整体结构切面图
基因组通过编码多种蛋白质,来调控宿主细胞蛋白表达、干扰宿主天然免疫系统和调控细胞周期等, 进而抑制巨噬细胞的免疫应答反应。已有研究表明,ASFV基因组编码调控的晚期蛋白DP71L、早期蛋白A238L等调控宿主细胞蛋白表达;多基因家族蛋白MGF360、MGF530/505、晚期蛋白I329L等抑制I型干扰素表达, 并抑制干扰素的抗病毒效应以及NF-κB信号通路;蛋白A179L、晚期蛋白A224L、蛋白EP153R等在感染初期抑制细胞凋亡;蛋白E183L等在感染后期诱导细胞凋亡;晚期蛋白CD2v等抑制淋巴细胞增殖;早期蛋白L83L等抑制IL-1β的抗病毒效应等[10]。目前还不明确ASFV是如何吸附细胞以及相关的受体,但有相关报道表明,衣壳蛋白P72、内膜蛋白P54、膜相关抗原蛋白P30等参与病毒结合、内化、入侵宿主细胞以及内体(early endosome, EE)迁移等过程[11]。 现已鉴定出的毒株有24种基因型,目前我国、东欧地区及其周边流行的是基因Ⅱ型,西非地区及其周边主要是基因Ⅰ型[10]。ASFV毒株抵抗力强,在低温条件下可以保持稳定,-80 ℃可保持1年,在高温环境中不稳定,60 ℃条件下可存活20 min,常规消毒剂如氢氧化钠、次氯酸钠等均可有效灭活毒株,对一些有机溶剂敏感,如乙醚、氯仿等。早在20世纪60年代,ASFV疫苗就开始进行相关研究,但均以失败告终,其主要原因有ASFV传播能力强,且生物学特性复杂,基因组复杂,无法完全掌握毒力基因;免疫逃逸机制复杂,安全性、保护效力有待提高等[12]。直到2022年4月,中国农业科学院哈尔滨兽医研究所才解析出ASFV A137R蛋白逃逸宿主天然免疫应答的分子机制,这也为蛋白调控ASFV毒力的分子机制研究奠定了基础。随着全球疫情态势发展愈加严峻以及疫情所造成的经济威胁愈加严重,对于安全有效且商业化疫苗的研发需求愈加迫切。应尽快研发出可以消灭ASF的疫苗来预防控制疫情。
2 ASF诊断方法
世界动物卫生组织(World Organization for Animal Health,OIE)将其列为A类疫病,法律规定报告动物疾病,我国也将其列为一类动物疫病。该病分为最急性型、急性型、亚急性型和慢性型4种,其中,最急性型、急性型死亡率及发病率最高[13]。临床特征主要表现为持续性高热、食欲减退甚至废绝、气喘、四肢无力、呕吐、便秘或腹泻、便血等症状。病理解剖方面,眼观病畜体表可见大块紫色瘀斑;剖检可见脾脏显著肿大、呈紫黑色、质地变脆,心肌、肝脏、肺脏、肾脏、肠系膜、肠系膜淋巴结均出现出血肿大现象,以及心包腔、胸腹腔有积液存在[14]。实验室病理组织镜检可观察到组织均以广泛性充血、出血及炎性细胞浸润等病理学变化为主[15]。目前全世界对于ASF疫情主要从血清学检验和分子病原学检测等进行实验室诊断鉴别,在血清学上,致细胞病变效应和红细胞吸附试验呈现的“玫瑰花环”为ASFV感染特有的标志[16];OIE推荐应用病毒分离、荧光抗体检测抗原(FAT)、酶联免疫吸附试验(ELISA)、化学发光免疫分析法(CLIA)、聚合酶链式反应(PCR)等分子生物学检测方法进行检测[17]。同时结合临床、病理特征等进行鉴别诊断,若发现有疫情输入,立即采取隔离、扑杀、消毒等严格的处置措施[18]。
3 常见防控ASF疾病的措施
3.1 ASF疫苗的研究进展
3.1.1 灭活疫苗
灭活疫苗(inactivated vaccine)是指利用物理或者化学方法将毒株灭活,使其丧失感染性、毒性,且保持免疫原性,同时结合相应佐剂而制成的疫苗。由于灭活疫苗制备简便、成本低、保存容易、安全性高等优点,所以针对新发现的一种病毒,会优先研发灭活疫苗[19]。2014年,有研究人员将二元乙炔亚胺(diacetylenimine, DEI)灭活的ASFV制剂分别与PolygenTM和Emulsigen®-D佐剂配伍免疫机体,机体被同源高毒性ASFV攻击,通过结果可知,产生了特异性抗体,但并没有诱导机体产生免疫保护作用,而是抗体依赖性增强,出现急性临床症状[20]。由于灭活疫苗的特性,不能引起完整的细胞免疫反应,故灭活疫苗在现有研究基础上不能作为安全有效的研究途径使用[21]。
3.1.2 减毒活疫苗
减毒活疫苗(live attenuated vaccines, LAV)是指利用分离鉴定、人工制备等方法将病原体毒性减弱,免疫原性保留而制成的活疫苗[22]。LAV分为传统减毒活疫苗和重组减毒活疫苗。可引发机体特异性免疫反应,在理论上,相较于灭活疫苗,减毒活疫苗具有免疫反应时间长、免疫力强等优点[23]。被一些研究学者评为短期内最有希望的疫苗[24]。早在20世纪60年代,西班牙和葡萄牙暴发ASF疫情时,已经有学者进行田间试验,因能为机体提供同源保护和部分异源保护,故在当时大范围应用LAV,却增加了多重感染和再次感染的风险[23],出现肺炎、流产等副作用[25]。毒力减弱的同时免疫原性和稳定性也减弱[20]。因此,提高LAV的有效安全性依旧是未来的主要研究方向。
3.1.2.1 传统减毒活疫苗
对传统减毒活疫苗(traditional live attenuated vaccines)的研究主要集中在天然致弱毒株(OURT88/3或NH/P86)和利用猪骨髓来源细胞、Vero细胞和COS-1细胞等细胞制成的人工传代致弱毒株。
2015年有研究表明,NH/P86接种猪后,自然杀伤细胞(natural killer cell, NK)和细胞毒性淋巴细胞(cyt-otoxic lymphocyte, CTL)活性增强,抵御一些强毒株的攻击[26]。用OURT88/3首免,再用OUR/T88/1加强免疫,分泌γ-IFN的淋巴细胞活性增强,这样诱导交叉免疫有效保护率为60%~100%[27]。以上这些保护作用会随着CD8+T淋巴的不断衰竭,效果逐渐减退[28]。
2021年步志高的研究表明,用ASFV野毒株( ASFV-G )在Vero细胞上连续传代培养,ASFV-G复制次数会随着传代次数的增加而增加,毒力逐渐丧失直至110代完全衰竭,得到致弱株(ASFV-G/V),完全减毒的毒株感染猪后可能由于基因组发生进行性基因缺失造成对强毒株的攻击不能提供保护[29]。
因此,传统减毒活疫苗有着很多不可控的生物安全问题,这可能也是不能广泛应用的原因[21]。
3.1.2.2 重组减毒活疫苗
重组减毒活疫苗(recombinant live attenuated vaccine)是指针对毒株的结构、毒力基因等采用基因编辑或同源重组等分子生物学技术手段,降低毒株毒力,制备成活疫苗[30],属于基因工程疫苗(geneti-c engineering vaccines)。目前ASF的重组减毒活疫苗的研究主要集中在毒力基因缺陷疫苗(分为疫苗免疫和野毒免疫)上[25],即敲除弱毒株或强毒株上单个或多个靶向基因减小毒力或诱发免疫反应,增强免疫应答水平[20](表1)。

表1 ASFV基因缺失疫苗
有研究发现,重组减毒活疫苗能够产生交叉保护作用[31],相较于传统减毒活疫苗来说更具有保护性,对亲本毒株的保护率可达100%[22],更有机会成为广泛应用的商业化疫苗。但对ASFV毒力相关基因或免疫逃逸基因的精准敲除和最优组合以及对其免疫途径、接种剂量、接种时间和安全有效性等方面的确认应该进一步研究[22]。
2008年有研究人员将E70毒株上的A238L基因敲除,免疫机体后研究发现,无任何保护作用且临床上出现细胞凋亡和出血等免疫后不良反应(adverse post vaccination reactions)[32];2017年有研究人员将Benin 97/1上的DP148R基因敲除,研究发现在巨噬细胞中病毒复制并没有减少,但毒力降低,当用亲本强毒株攻击经肌肉注射或经鼻内免疫途径的猪后,可诱导对亲本强毒株的高度保护,即同源保护(homologous protection)[33];将BA71毒株上的CD2v基因敲除,研究发现毒株在机体内高度减毒,免疫机体后,不仅可以抵抗亲本强毒株的攻击,还可以抵抗异源毒株的攻击,即交叉保护(Cross-protection)[34];2018年研究人员将NH/P68上的A238L、A224L基因敲除,研究发现免疫后的机体可抵抗Arm07毒株的攻击,即异源保护(heterologous protection)[35];将ASFV-G△9GL△MGF免疫机体毒株完全致弱,不能引起免疫应答。2020年中国农业科学院哈尔滨兽医研究所研制出一种安全有效的疫苗HLJ/18-7GD,免疫后在机体内完全减毒并能够对机体提供完全保护,截至到2021年已经安全评价生产性试验和第二阶段临床试验[36],有望成为安全有效的商业化的疫苗。2021年研究人员研究了ASFV-G-△I177L疫苗,该疫苗效价和效力不因基因缺失而改变,还可在稳定的细胞培养物中生长,所以同样它也有望成为大规模商业化疫苗[37]。经口给药是该疫苗重要的接种方式[38]。
3.1.3 基因工程疫苗
病毒活载体疫苗、DNA疫苗、亚单位疫苗3者的共同点在于都涉及可以诱导机体产生有效性免疫保护作用的抗原基因,即保护性抗原(protective antigen)[20],都为基因工程疫苗(表2)。研究表明,ASFV保护性抗原基因有p72、p54、p30、CD2v、EP153R、p12等[4]。基因工程疫苗的优点主要有免疫强烈持久、安全性高、稳定等,但其生物安全依旧是未来研发需要解决的难题[23]。
ASFV活载体疫苗(live vector vaccine)是利用基因工程技术将外源性保护性抗原基因插入到无毒或低毒的活病毒基因组非必需区基因中重组表达,诱导机体的细胞毒性T淋巴细胞(cytotoxic T lymp-hocyte,CTL)反应与细胞免疫[39]。用于ASFV活载体的主要有痘病毒(poxvirus)、腺病毒(adenovirus, ADV)、疱疹病毒(herpesviruses)、甲病毒(alpha-virus)、杆状病毒(baculovirus)等[20]。目前对ASFV基因工程疫苗的研究比较少,还缺乏相应的攻毒保护试验,对攻毒保护有效性需要进一步的验证(表2)。2001年研究人员在E183L基因的NotⅠ酶切位点插入CP204L基因,构建嵌合蛋白p54/30,由杆状病毒表达,免疫猪后发现,在机体内产生了中和抗体(neutralizing antibodies),且最大病毒血症滴度减少,可以作为血清学诊断试剂使用[40]。将p54、p30插入到载体后表达免疫猪发现,可诱导机体内产生特异性应答和中和性抗体,但并不能提供完全保护作用[41]。2004年研究人员为评估病毒蛋白p30、p54和p72的免疫保护作用,将分离株Pr4上的p30、p54、p72和p22重组到杆状病毒上进行表达并对猪进行免疫,可检测到中和抗体,但在临床上出现死亡现象,不能产生抗体介导的保护作用[42]。
DNA疫苗(DNA vaccine)也叫核酸疫苗,是将保护性抗原克隆到质粒或非致病性病毒上,表达出天然的保护性蛋白,诱导机体产生体液或细胞免疫应答[43]。研究人员利用CRISPR/Cas9基因工程技术将ASFV的开放阅读框E199L、p30和p22插入伪狂犬病病毒载体中并表达,研究显示密码子显著增强了E199L的表达, 且嵌合的启动子优化了转入基因的表达[44]。将p54、p30和血凝素(ASFV hemagglutinin, sHA)与泛素(Ubiquitin,Ub)融合,并克隆到质粒表达,免疫猪后发现机体可产生特异性机体应答,并且能够提供部分保护作用[45]。
亚单位疫苗(subunit vaccine)是将保护性抗原导入原核或真核细胞内重组表达得到保护性蛋白,再配以合适的佐剂制备成的疫苗。研究人员将p32、p54、pp62、p72基因插入到腺病毒载体表达,配制2种不同的佐剂,采取“鸡尾酒式”免疫猪,结果表明诱导产生了特异性抗体和CTL反应[46]。但是对于免疫疫苗的保护效力仍需进一步评估,也需要找到合适的佐剂。

表2 ASFV基因工程疫苗
3.1.4 单周期病毒疫苗
单周期病毒疫苗(single-cycle virus vaccines)也叫作复制缺陷型病毒疫苗,是利用基因工程技术ASFV复制所必需基因进行缺失对,使其在辅助细胞系中可进行有效复制,在感染动物后不能进行有效复制,故该疫苗以最大程度的原始状态,保持了免疫原性且避免了排毒等免疫副作用,是目前新研发出的一种安全性相对较高的疫苗[47]。现已有研究者Kaori Terasaki等[48]发现,复制缺陷型裂谷热病毒(Rift Valley fever virus, RVFV)进行单周期复制,且不会引起免疫宿主系统性感染,可作为疫苗的候选毒株。也有研究者对实验动物接种了单周期病毒疫苗,发现机体诱导产生了体液和细胞免疫,但其保护效力及能否成为防控ASFV的有效疫苗,需要进一步确认[49]。
3.1.5 纳米疫苗
纳米疫苗(nanovaccine,NVs)是当前疫苗研究的新型热点,具有广阔前景。目前并没有针对ASFV研发的纳米疫苗。NVs是将抗原与佐剂连接,将纳米材料作为载体或免疫调节剂,用于疾病治疗和预防的一类疫苗。NVs自身具有制备材料易得、生物相容性好、安全有效性高、副作用少等优点,在ASF防控上具有减小疫苗带来的毒副作用、诱导高水平体液和细胞免疫作用、提高抗原递送效率等优点。现应用于兽用疫苗的NVs有聚乳酸-羟基乙酸共聚物(ploy D,L-lactic-coglycolic acid, PLGA)、金纳米粒(AuNPs)、聚酸酐(polyanhydrides)以及壳聚糖(chitosan, CS)[50]。NVs的研究发展为ASFV疫苗的研究提供新的思路与方向。
3.2 其他防控措施
除用疫苗免疫接种的防控措施外,还可以根据流行病学调查和实验室、临床诊断,由专业人员针对圈舍环境及其用具等进行科学有效的消毒处理。严格的日常管理和生物安全措施等方法都可以切断传播途径,防止交叉感染的风险,例如,引进新的品种猪时,按照规定进行检疫;定期消灭软蜱、鼠、蝇等可以携带病原体的寄生虫及动物等。
抗ASF药物的应用能够对ASF的防控起到推动作用,有多种抗病毒化合物在体外Vero细胞和猪巨噬细胞中表现出抗ASF活性,(S)-HPMPA 等“核酸类似物”类化合物既能抑制ASF核酸合成,也能够在病毒感染晚期抑制IP-73蛋白的合成[51]。氟喹诺酮类抗生素能够抑制病毒复制,减少感染带来的细胞病变等[43,52]。Pitstop2、dynasore等药物能够抑制病毒网格蛋白介导的内吞作用,阿米洛利 (EIPA)、细胞松弛素D等药物能够有效抑制胞饮作用,降低细胞吸收ASFV作用[53]。已经发现越来越多安全有效的化合物具有抗ASF作用,但无论是人工合成还是天然合成的化合物目前都仅仅涉及体外的研究试验,并没有临床验证结果,所以抗ASF药物的研发也是未来疫情防控的重要途径。
3.3 抗病育种可作为未来防控ASF的新方向
一些研究表明,猪的抗病性是受到遗传因素影响的,故有人在1980年左右就提出过抗病育种(disease-resistant breeding)的构想,并随着基因工程技术和分子遗传学的成熟应用,这一构想逐渐完善。目前已有奶牛乳房炎、猪繁殖与呼吸综合征、猪水肿病等均已在这一方向上进行研究并取得初步研究成果。抗病育种,即将目的基因通过基因工程技术重组到受体基因组内,表达出稳定的性状,最终传代培育出抗病力较强的抗体。抗病育种的机制简单,其中,抗性基因分为抗性主基因与抗性多基因,抗性多基因以主要组织相容复合物(MHC)研究为主(图3)。在防控ASF疾病时,利用猪的抗病性基因可遗传的特征,用基因工程重组技术将可标记辅助选择抗性基因重组到新的受体基因组内表达出抗ASFV强的基因性状。此研究可作为新的研究课题为早日完全控制ASF奠定基础。该技术为疫病防控提供一个新的方向,其主要优势在于提高特异性抗病力,相较于一般性抗病力来说,遗传力会提高。但该技术受到多种因素制约,如遗传因素、个体差异因素,基因和经济因素等。
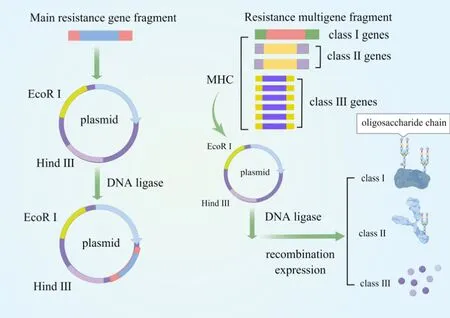
图3 抗病育种简单机制
3.4 目前ASF防控所遇到的难题
1) 在疫苗研发上需要解决的难题:ASF病原体结构复杂,逃避机制复杂,传播能力较快;ASF疫苗安全性有待提高,无可商业化应用的ASF疫苗。
2) 从国家层面上需要解决的难题:防控体系不完善,监督监管责任没有落实到位;生猪市场以及海关检疫存在潜在的ASFV感染风险。
3) 从社会层面上需要解决的难题:民众生物安全意识较差;专业检疫技术人员缺少。
4) 从个人层面上需要解决的难题:个体养殖户防疫意识不到位;对ASF的认识不够,盲目接种ASF疫苗;消毒剂使用错误。
解决这些难题需要全社会的共同努力。例如,在ASF流行的大环境下,应该科学管理饲养猪场;严格执行疫病处理,做好生物安全工作;落实市场责任义务,做好疫病监管监测工作。在疫苗研究以及抗ASF药物研制上,应该加强研发疫苗安全性,完善抗ASF药物的临床试验数据。从目前来看,我国依旧面临着ASF带来的防控压力,全社会各部门之间应相互配合,尽职尽责,最大限度减少ASF带来的损害,保障我国生猪业稳定发展。
4 小结与展望
面对ASF疫情的大流行趋势,全世界围绕着ASF疫情防控正在积极、紧张地展开研究,我国研究者对ASF防控国家重大战略需求开展一系列科技攻关并获得了一些成果。
疫苗作为疫情防控的有效措施之一,研发出安全有效的商业化疫苗的需求已经迫在眉睫。基因工程疫苗比传统疫苗更有可能成为未来疫苗研发的主要方向。其中,ASFV重组减毒活疫苗的相关研究成果比较多,疫苗可降低毒株毒力,诱导机体的免疫反应,保护效力高,大部分疫苗还可抵抗亲本强毒株的攻击,有些甚至可以抵抗异源毒株的攻击,产生交叉免疫。但由于ASFV基因多样性,无法明确毒力基因,有时会出现毒力返强等免疫副作用。随着分子生物技术和疫苗学的发展,病毒活载体疫苗、DNA疫苗、亚单位疫苗也逐渐走向商品化,保护效力更加持久、稳定。单周期病毒疫苗作为新型疫苗,为疫苗的研发提供了更多的可能。纳米疫苗是近些年出现的概念,还没有应用于ASF疫苗中,但在生物医学中广泛应用,且免疫副作用小,安全性高,ASFV纳米疫苗是一个不错的选择。CRISPR/Cas9 基因编辑技术以及ASFV 的反向遗传操作技术应用到新型ASF疫苗候选株的研制中,可以加快安全有效的ASF疫苗的研发脚步。
除疫苗外,也可以借鉴其他用来防控传染病的研究方法,例如抗病育种,该技术为疫病防控提供一个新的方向,其主要优势在于抗性基因具有遗传性,可稳定表达出抗病性状。但该技术受到多种因素制约,如遗传因素、个体差异因素、基因和经济因素等。随着分子遗传学和家畜育种学的发展,该技术一旦突破瓶颈,就会给疫情的防控带来希望和改变。
生物安全是商业化疫苗未来研发的重中之重,随着今后基因工程技术的发展,要进一步深入对ASFV基因组的认知,充分了解其表达蛋白及功能、感染及免疫机制、抗原识别及免疫靶点等,研发出安全有效的疫苗,实现量化生产,为ASFV疫苗研制提供理论依据,也为全世界ASF疫情防控提供科技支撑。

