5种新型冠状病毒核酸检测试剂应用于DXcellenceTM全自动核酸检测分析系统的性能评估*
轩乾坤,吴文娟
(同济大学附属东方医院南院检验科,上海200123)
核酸检测在新型冠状病毒感染的预防、诊断和治疗过程中扮演了重要角色[1-3]。随着新型冠状病毒肺炎在我国归于“乙类乙管”[4],其核酸检测调整为“愿检尽检”,不再开展全员核酸筛查[5],市场开始对中低通量、灵活、快速的一体化全自动核酸检测设备产生需求。本研究使用的封闭式一体化PCR检测系统DXcellenceTM[6],在实现“核酸提取—扩增—检测”整合一体化的同时,还兼具操作简易、快速、密闭的特点,适用于急诊、儿科、发热门诊等小型实验室,同时能保证高特异性和敏感性,可实现样本进结果出的快速检测。
该DXcellenceTM核酸检测系统一般检测单采样本,需要人工对采样管开盖,可原管上机检测,兼容多种型号的采样管,可以在封闭系统内进行自动加样、磁珠法核酸提取、机械臂点样、q-PCR扩增及信号采集、判读,最后系统自动生成检测报告。该系统由控制部件、热盖部件、热循环部件、光电部件、传动部件、电源部件、外壳及嵌入式软件组成,基于磁珠法的核酸提取和经典的实时荧光定量PCR检测原理,可对样本中的靶核酸(DNA/RNA)进行高质量提取及定性、定量检测。该系统包含12个独立的温控模块,可实现多样本不同扩增程序的同时检测,在新型冠状病毒疑似阳性样本复检时,能很好地满足双试剂快速检测的需求。鉴于其全自动、操作方便、节省时间,并具有多重防污染设计等优点,本研究选取5种不同反应条件的新型冠状病毒核酸检测试剂,在DXcellenceTM系统上进行程序适配后,测试其最低检出限、精密度、符合率,以及艾科诺公司的核酸提取纯化试剂盒与硕世病毒核酸提取试剂盒、凯杰公司的QIAamp Viral RNA Mini Kit核酸提取性能的比对,为临床实现新型冠状病毒全自动核酸检测提供参考数据。
1 材料和方法
1.1材料
1.1.1阳性标本 收集2022年4月29日在同济大学附属东方医院南院新型冠状病毒核酸检测为阳性的剩余咽拭子标本10例,于-80 ℃保存待测。
1.1.2阴性标本 收集2022年7月7日在同济大学附属东方医院南院新型冠状病毒核酸检测为阴性的剩余咽拭子标本10例,于-80 ℃保存待测。
1.1.3采样管 江苏康健医疗用品有限公司生产的一次性使用病毒采样管,批号0822220301。
1.1.4标准物质 NIM-RM5207购自中国计量科学研究院,为新型冠状病毒全序列假病毒核糖核酸标准物质,批次2103;包含已公布的新型冠状病毒的4个主要基因,其标准值分别为:核衣壳蛋白N基因(28 274~29 533)84 copies/μL、E基因(26 245~26 472)77 copies/μL、S基因(21 563~25 384)164 copies/μL、ORF基因(18 040~21 552)132 copies/μL、ORF基因(13 025~18 039)116 copies/μL、ORF基因(8 555~13 024)121 copies/μL、ORF基因(2 720~8 554)106 copies/μL和ORF基因(266~2 719)145 copies/μL。由于标准品在ORF1ab的不同区段拷贝数定值不同,不能确定试剂检测具体靶标区段,故本文涉及新型冠状病毒标准品ORF1ab的拷贝数均计算为涵盖各靶标区段的范围。
1.1.5核酸提取试剂 嘉兴艾科诺公司生产的核酸提取纯化试剂盒,批号20220301;江苏硕世公司生产的病毒核酸提取试剂盒,批号T202210216;凯杰公司生产的QIAamp Viral RNA Mini Kit,批号169039436。
1.1.6核酸提取仪 硕世全自动核酸提取仪SSNP-9600A(江苏硕世公司)。
1.1.7新型冠状病毒核酸检测试剂 金迪安®新型冠状病毒核酸检测试剂盒(荧光PCR法,批号22010806,杭州迪安公司,本文中称JDA);新型冠状病毒核酸检测试剂盒(荧光PCR法,批号220122,武汉明德公司,本文中简称MD);新型冠状病毒核酸检测试剂盒(荧光PCR法,批号20220545,江苏硕世公司,本文中简称SS);新型冠状病毒核酸检测试剂盒(荧光PCR法,批号20220608142,北京金豪公司,本文中简称JH);新型冠状病毒核酸检测试剂盒(荧光PCR法,批号QP07220542,上海思路迪公司,本文中简称SLD)。
1.1.8检测仪器 全自动医用PCR分析系统SLAN-96S(上海宏石公司);DXcellenceTM全自动核酸检测分析系统(嘉兴艾科诺公司)。
1.2方法
1.2.1反应体系及参数 5种新型冠状病毒核酸检测试剂盒的反应体系(加样量/总体积)、扩增条件、循环数、结果判读标准均按照各试剂盒说明书中标示的信息,在DXcellenceTM全自动核酸检测分析系统中进行设置和操作。见表1。

表1 5种新型冠状病毒核酸检测试剂基本信息
1.2.2核酸提取性能比对 采用硕世新型冠状病毒核酸检测试剂说明书推荐的硕世病毒核酸提取试剂盒和凯杰公司的QIAamp Viral RNA Mini Kit、艾科诺公司的核酸提取纯化试剂盒分别对2份梯度稀释的新型冠状病毒标准物质NIM-RM5207、10例新型冠状病毒阳性样本、10例新型冠状病毒阴性样本进行核酸提取,使用硕世新型冠状病毒核酸检测试剂分别在宏石全自动医用PCR分析系统SLAN-96S上进行荧光PCR检测,分析阴、阳性符合率和ORF1ab 基因循环阈值(Ct)在3种提取试剂间的相关性。
1.2.3检出限(LoD) 用一次性使用病毒采样管中的保存液将新型冠状病毒标准物质NIM-RM5207分别稀释对应倍数至略低于每种试剂盒说明书标注的LoD,使用5种新型冠状病毒核酸检测试剂盒分别对稀释后标准品进行20次检测,统计各检测试剂对ORF1ab基因和N基因的Ct值分布及检出率。本实验将标准品稀释至ORF1ab 329~450 copies/mL,N基因260 copies/mL,在DXcellenceTM上进行JDA、MD、JH试剂的测试;将标准品稀释至ORF1ab 256~350 copies/mL,N基因203 copies/mL,进行SS试剂的测试;将标准品稀释至ORF1ab 146~200 copies/mL,N基因116 copies/mL,进行SLD试剂的测试。
1.2.4精密度 用一次性使用病毒采样管中的保存液将新型冠状病毒标准物质NIM-RM5207稀释至ORF1ab 1 100~1 500 copies/mL,N基因869 copies/mL,作为弱阳性样本;阴性样本为已检测新型冠状病毒为阴性的剩余标本。使用5种新型冠状病毒核酸检测试剂盒分别对阴性和弱阳性样本进行检测,每天检测3次,连续检测3 d,分别统计各检测试剂检测结果的阴阳性符合率,并计算阳性样本的ORF1ab基因和N基因的Ct值均值和变异系数(coefficient of variation,CV),分析5种检测试剂的精密度。
1.2.5符合率 在DXcellenceTM检测系统上,用5种新型冠状病毒核酸检测试剂分别测试已经确认的10例新型冠状病毒阴性咽拭子样本和10例新型冠状病毒阳性咽拭子样本;同时在经验证的宏石全自动医用PCR分析系统上,使用江苏硕世公司新型冠状病毒核酸检测试剂测试上述10例新型冠状病毒阴性咽拭子样本和10例新型冠状病毒阳性咽拭子样本。
1.3统计学分析 采用IBM SPSS Statistics 26软件。各基因对应测试Ct值为计量资料,进行相关系数(R)的统计;根据Ct值和各自说明书进行阴阳性判定,为等级资料,进行符合率的统计。
2 结果
2.15种新型冠状病毒核酸检测试剂信息分析 本次研究选取的5种新型冠状病毒核酸检测试剂盒均采用RT-qPCR方法检测病毒的RNA。JDA、MD、JH、SS均采用人内源性基因作为试剂盒的检测内标,而SLD采用外源性内标,5种试剂均以新型冠状病毒ORF1ab基因和N基因作为检测靶标,3个靶标在荧光通道的分配上有所不同。反应程序方面,5种试剂均在逆转录、预变性后分别进行40~45个循环。SLD的反应程序与其他四者不同,在每一个反应阶段均压缩了大量的反应时间,加快了反应速度。见表1。
2.2核酸提取性能比对 由硕世病毒核酸提取试剂盒、凯杰公司的QIAamp Viral RNA Mini Kit、艾科诺公司的核酸提取纯化试剂盒提取后的核酸,经宏石全自动医用PCR分析系统SLAN-96S进行PCR扩增后,3种核酸提取试剂检测的阴性符合率、阳性符合率、总符合率完全一致,均为100%;其ORF1ab 基因Ct值的相关系数分别为艾科诺提取(ACNM)与硕世提取(SS)为0.998,艾科诺提取(ACNM)与凯杰提取(QIAmp)为0.958,硕世核酸检测试剂盒中推荐的2种核酸提取试剂盒SS与QIAmp为0.938。
2.3检出限测试 5种检测试剂对新型冠状病毒靶基因检测结果(Ct值)分布见图1,根据说明书的判断标准判断各基因检测的阴阳性结果并计算检出率,结果见表2。5种检测试剂在检出限浓度的标准品检测Ct值分布分别为JDA ORF1ab 34.26~37.96,N基因35.65~39.40;MD ORF1ab 34.31~37.74,N基因34.41~37.13;JH ORF1ab 33.81~36.37,N基因33.73~37.79;SS ORF1ab 34.1~36.12,N基因34.33~36.62;SLD ORF1ab 35.78~38.55,N基因33.93~36.12。5种检测试剂在本次LoD样本测试中的检出率均为ORF1ab 100%(20/20),N基因100%(20/20)。
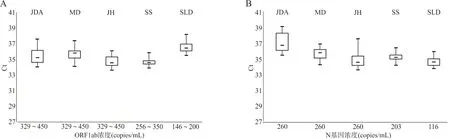
注:A,5种检测试剂对各自LoD浓度的ORF1ab基因检测Ct值分布;B,5种检测试剂对各自LoD浓度的N基因检测Ct值分布。
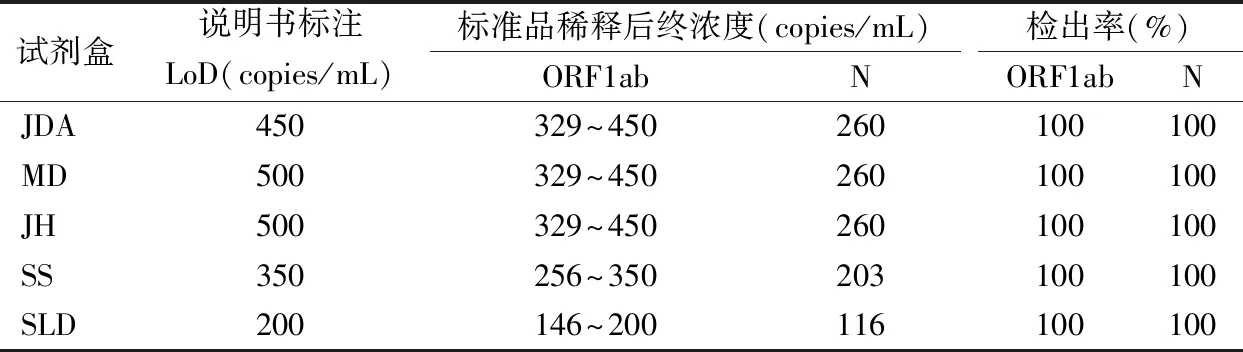
表2 5种试剂盒检出限检测结果
2.4精密度测试 与Accunome核酸提取纯化试剂及DXcellenceTM系统配合,5种试剂的ORF1ab基因的检测Ct值均值在31.91~33.74之间,其CV均在1.6%以内;而N基因的检测检测Ct值均值在32.62~35.57之间,其CV均在2%以内,表现出良好的精密度。同时,5种试剂对阴性样本进行3 d,每天3次,共9次测试,其结果均为阴性。本部分测试阴阳性符合率、总符合率均为100%。见表3。
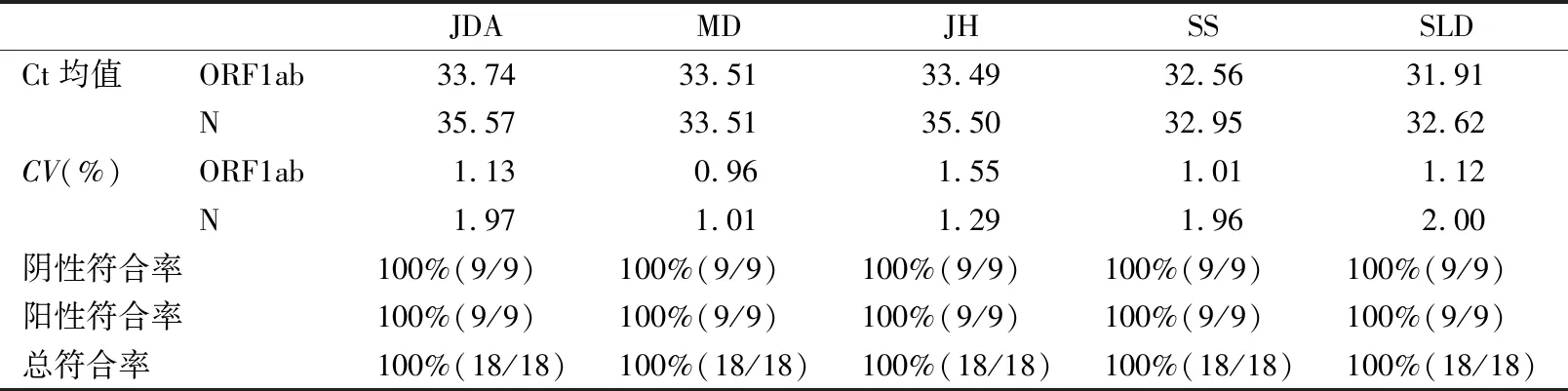
表3 5种新型冠状病毒核酸检测精密度测试
2.5符合率测试 对20例已确认样本进行检测,5种试剂在DXcellenceTM系统上检测结果均为100%(10/10)阳性和100%(10/10)阴性,SS试剂在宏石全自动医用PCR分析系统上检测结果是100%(10/10)阳性和100%(10/10)阴性,阴、阳性符合率均为100%。其中10例阳性样本的ORF1ab及N基因的Ct值分布见图2。比较SS试剂在DXcellenceTM系统(图2 SS/DXcellenceTM)及宏石荧光PCR系统上的Ct值(图2 SS/SLAN),其分布相当,具有可比性。

注:A,5种检测试剂在DXcellenceTM系统上对10例阳性样本ORF1ab基因检测Ct值分布,及SS试剂在宏石荧光PCR系统(SLAN)上对10例阳性样本ORF1ab基因检测Ct值分布;B,5种检测试剂在DXcellenceTM系统上对10例阳性样本N基因检测Ct值分布,以及SS试剂在宏石荧光PCR系统(SLAN)上对10例阳性样本N基因检测Ct值分布。
3 讨论
在本研究中,国家假病毒标准品的稀释、分装和阴阳性样本的相关操作均按照要求在生物安全二级实验室进行,同时采用生物安全三级实验室的个人防护[7],样本准备均在生物安全柜内进行操作。由于DXcellenceTM全自动核酸检测分析系统集加样、核酸提取、PCR扩增及检测为一体,故本研究均在PCR实验室二区完成全部操作和检测,为没有条件建立标准PCR实验室三区分布的情况进行了探索和实践。
本研究主要考察每种检测试剂在DXcellenceTM系统上是否可以满足其说明书声称的主要性能,而选取的5种新型冠状病毒检测试剂中,JDA、MD、JH 3种试剂声称的检出限接近,故使用略低于该3种试剂声称的检出限的标准品对其进行验证。而SS和SLD的试剂声称检出限更低,故使用更低浓度的标准品对其进行验证。同时,本次研究中使用的标准物质来自中国计量科学研究院,其ORF1ab基因浓度在不同序列区段有不同定值,由于不确定5种新型冠状病毒检测试剂的靶标具体位置,故在ORF1ab基因的检测中,标注为不同区段的定值范围,而测试使用的浓度不超过最高标注浓度。
为应对在新型冠状病毒肺炎防控中对核酸检测试剂更高灵敏度和更快速检测的需求,国内各厂家纷纷推出了更加快速的新型冠状病毒核酸检测试剂。本次研究特别选择了SLD的核酸检测试剂作为快速新型冠状病毒检测试剂的代表进行了研究。由于各检测平台在升降温速度、荧光扫描速度、数据处理速度方面均有所不同,本次研究使用DXcellenceTM分析系统与SLD快速新型冠状病毒核酸检测试剂联合使用,达到从提取到出具报告单样本54 min,12个样本共65 min的结果,为快速、高效、准确的新型冠状病毒核酸检测提供了新的检测方法。同时,通过对5种新型冠状病毒核酸检测试剂在DXcellenceTM全自动核酸检测分析系统“样本进、结果出”的无人值守式测试,也为临床新型冠状病毒核酸检测提供一种减少人员操作步骤的便捷、准确的检测方法。
为了满足快速检测的需要,现有的大多能够进行快速新型冠状病毒核酸检测设备均使用了与经典荧光定量PCR不同的方法学,如等温扩增等,故只能提供阴阳性检测结果,不能报告Ct值。而DXcellenceTM检测系统在检测方法学上采用了经典的荧光定量PCR法,其Ct值与常规荧光定量PCR检测平台具有可比性。DXcellenceTM检测系统包含12个独立的温控模块,在同一轮测试内可以实现不同样本不同扩增程序的荧光PCR扩增,故可同时进行双试剂快速自动化检测,能很好地适用于新型冠状病毒疑似阳性样本的复检,且满足临床上需要报告Ct值的要求。

