坏死性凋亡基因在肾透明细胞癌中的表达及对预后影响的研究
张磊 姜经航 邓全红
肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是泌尿生殖系统最常见的恶性肿瘤之一,也是最常见的肾癌组织病理类型[1-2]。尽管ccRCC局部或根治性肾切除有治愈可能性,但术后仍有部分病例复发或发生转移,并导致较高的死亡率。目前针对ccRCC的靶向治疗和免疫检查点抑制剂治疗极大改善了患者的治疗效果,但也会出现耐药情况。因此对于ccRCC发生、发展中分子机制的探讨以及新的靶基因的预测研究将有助于开发新的治疗策略。
坏死性凋亡是一种特殊类型的细胞死亡方式,具有可调控性[3]。坏死性凋亡基因在肿瘤进展、转移、预后、免疫调节、病理分型和治疗中发挥着重要作用,但其与ccRCC预后之间的相关性尚不清楚。本研究从肿瘤基因组图谱(The Cancer Genome Atlas, TCGA)数据库中提取ccRCC转录组数据和临床资料,寻找与ccRCC预后密切相关的坏死性凋亡基因,构建预测预后模型,并使用基因表达综合(Gene Expression Omnibus, GEO)数据库中的GSE29609数据进行验证。
对象与方法
一、研究对象
ccRCC患者RNA转录组数据和临床信息从TCGA数据库中下载。纳入标准:①术后病理诊断为ccRCC;②随访时间<30 d的患者。排除标准:①无完整临床数据;②其他病理类型的肾癌。最终获得539例ccRCC组织转录组数据进行后续分析。
二、数据处理
1.坏死性凋亡基因的获取:从在线数据库(https://www.kegg.jp/)中下载坏死性凋亡基因,总共有159个基因纳入后续的数据分析。
2.生物信息学分析:以筛选条件(|log2FC|>1,FDR<0.05)为基础,使用R软件(4.1.0版本)中limma包(3.13版本)筛选ccRCC和正常组织中的差异表达坏死性凋亡基因。运用基因本体(Gene Ontology, GO)和京都基因和基因组百科全书(Kyoto Encyclopaedia of Genes and Genomes, KEGG)分析差异表达坏死性凋亡基因的功能富集,使用ggplot包对结果进行可视化。然后继续筛选与ccRCC预后相关的坏死性凋亡基因,采用单因素Cox回归分析ccRCC总生存期与坏死性凋亡基因之间的关系。将单因素Cox回归分析筛选出的预后相关坏死性凋亡基因纳入多因素Cox回归分析,确定与ccRCC预后密切相关的坏死性凋亡基因,同时得到预后相关坏死性凋亡基因的回归系数和危险比。通过在线cBioPortal数据库(http://cbioportal.org)分析预后相关坏死性凋亡基因的突变情况。
3.构建ccRCC预后模型:以坏死性凋亡基因表达水平和回归系数的乘积构建预后模型公式。以风险评分中位值为分界线,将ccRCC患者分为高风险组和低风险组,使用Kaplan-Meier法分析两组的生存率。为了探讨风险评分预测ccRCC预后的可靠性及准确性,进一步通过GEO数据库中的GSE29609数据进行验证。
结 果
一、差异表达坏死性凋亡基因的功能富集
使用GO和KEGG分析坏死性凋亡基因的生物学功能和重要调控网络,分析结果见图1。GO分析结果显示坏死性凋亡基因的生物过程主要涉及病毒反应、外源性凋亡信号通路、调节因子介导的信号通路、坏死性细胞凋亡过程以及对细胞因子刺激响应的调节,在细胞组分上主要与膜微囊、膜微区和炎症体复合物密切相关,其分子功能上主要涉及细胞因子受体结合、钙离子依赖、磷酸酯酶A2活性(消耗1,2-二棕榈酸磷脂酰胆碱)以及磷脂结合等。KEGG分析结果显示坏死性凋亡基因与细胞坏死性凋亡、甲型流感、MAPK信号通路以及NOD样受体信号通路等生物学途径密切相关。
二、差异表达坏死性凋亡基因与ccRCC患者生存和预后的关系
与正常组织比较,ccRCC组织中有29个坏死性凋亡基因高表达、7个坏死性凋亡基因低表达。对36个坏死性凋亡基因进行单因素和多因素Cox分析发现,有7个基因与ccRCC患者的生存和预后密切相关,其中3个基因[FAS配体(FAS ligand, FASLG)、溶质载体家族25A4(solute carrier family 25 member 4, SLC25A4)、信号转导和转录激活因子4(signal transducer and activator of transcription 4, STAT4)]是保护性因素,4个基因[BH3相互作用域死亡激动剂(BH3 interacting domain death agonist, BID)、γ干扰素(interferon gamma, IFNG)、干扰素调节因子9(interferon regulatory factor 9, IRF9)和磷酸酯酶A2IVD(phospholipase A2 group IVD, PLA2G4D)]是危险因素。使用在线cBioPortal数据库分析这些基因的遗传突变,发现突变率最高的类型是扩增突变和深度缺失,其中FASLG突变频率最高(4%)。依据坏死性凋亡基因表达的中位值,将ccRCC患者分为高表达组和低表达组,Kaplan-Meier法分析显示差异表达坏死性凋亡基因与ccRCC患者的生存密切相关(图2)。
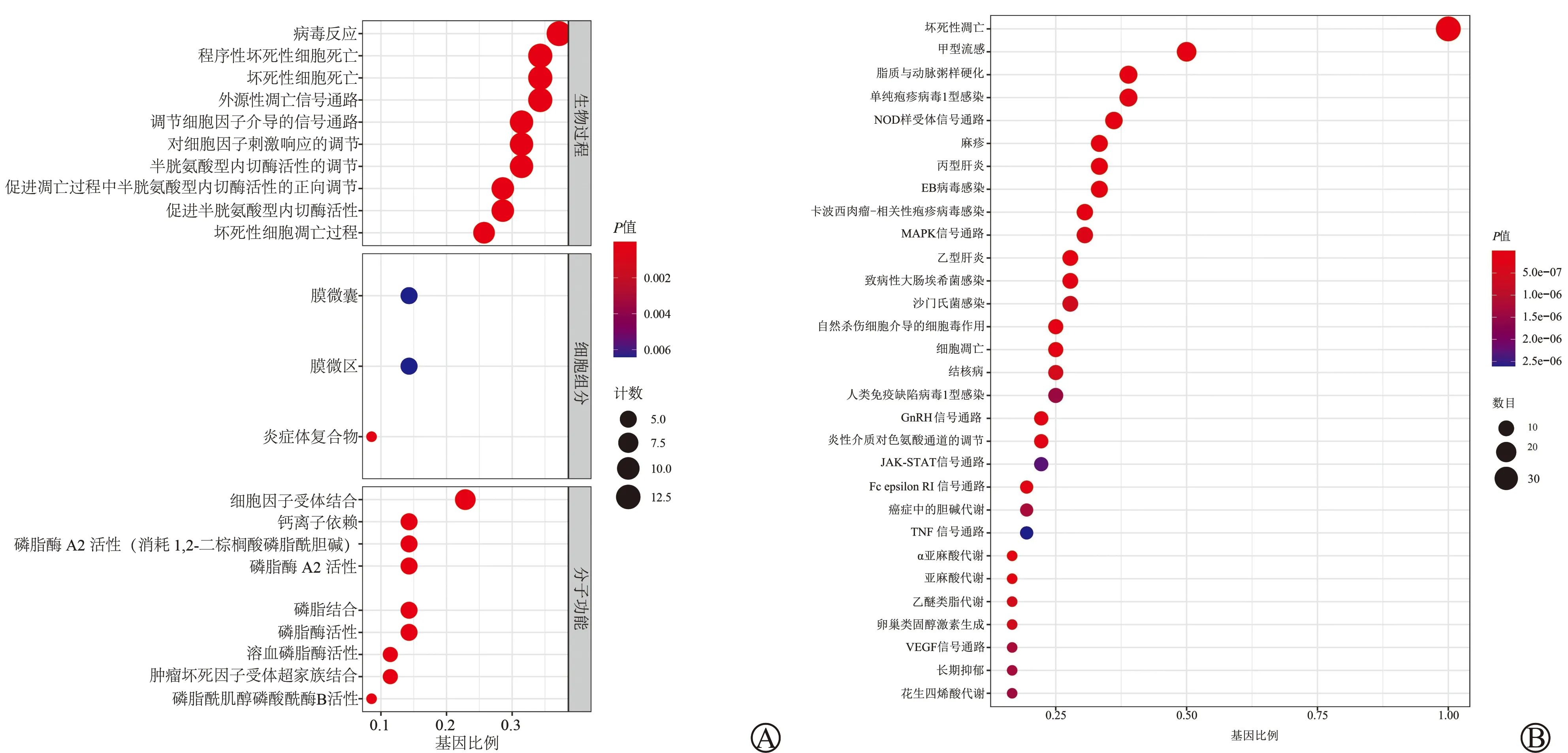
A:GO分析图;B:KEGG分析图图1 差异表达坏死性凋亡基因GO和KEGG分析
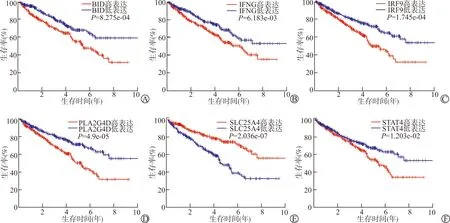
A:BID表达与ccRCC患者预后的关系;B:IFNG表达与ccRCC患者预后的关系;C:IRF9表达与ccRCC患者预后的关系;D:PLA2G4D表达与ccRCC患者预后的关系;E:SLC25A4表达与ccRCC患者预后的关系;F:STAT4表达与ccRCC患者预后的关系图2 不同坏死性凋亡基因表达ccRCC患者的Kaplan-Meier生存曲线
三、ccRCC患者预后模型公式构建与验证
多因素Cox分析发现,有7个基因与ccRCC患者的生存和预后密切相关。根据每个差异表达坏死性凋亡基因的回归系数,构建的预后模型公式:风险评分=0.935×BID表达量-0.647×FASLG表达量+0.816×IFNG表达量+0.499×IRF9表达量+0.587×PLA2G4D表达量-0.328×SLC25A4表达量-0.452×STAT4表达量。根据该公式计算每例ccRCC患者的风险评分,然后以该评分中位值将患者分为高风险组和低风险组。Kaplan-Meier法分析显示,高风险组患者的生存率比低风险组患者低,差异有统计学意义(P<0.001,图3)。使用GSE29609数据进行验证同样发现,高风险组患者的生存率比低风险组患者低,差异有统计学意义(P=0.047,图4)。
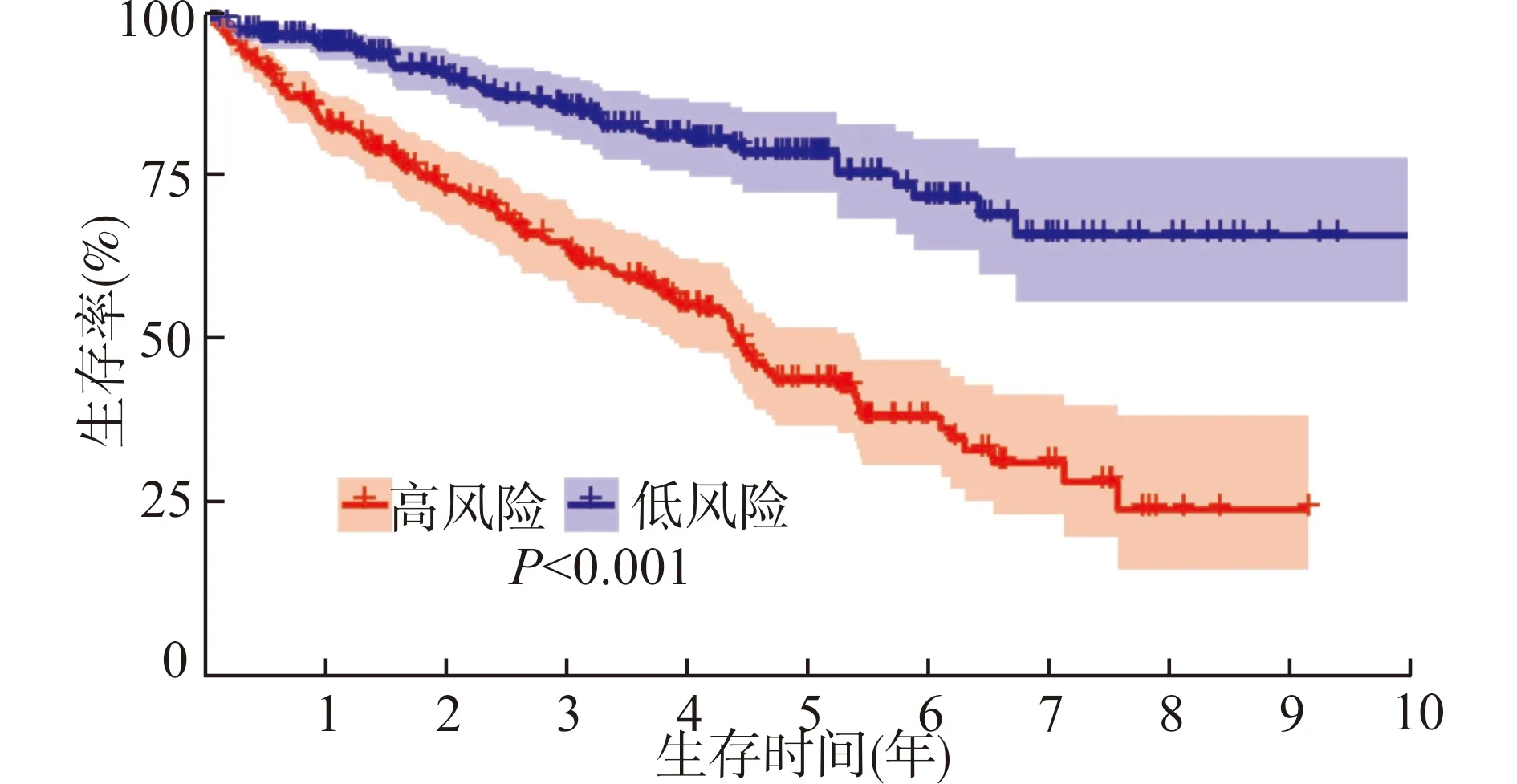
图3 ccRCC高风险组和低风险组患者总体生存率曲线
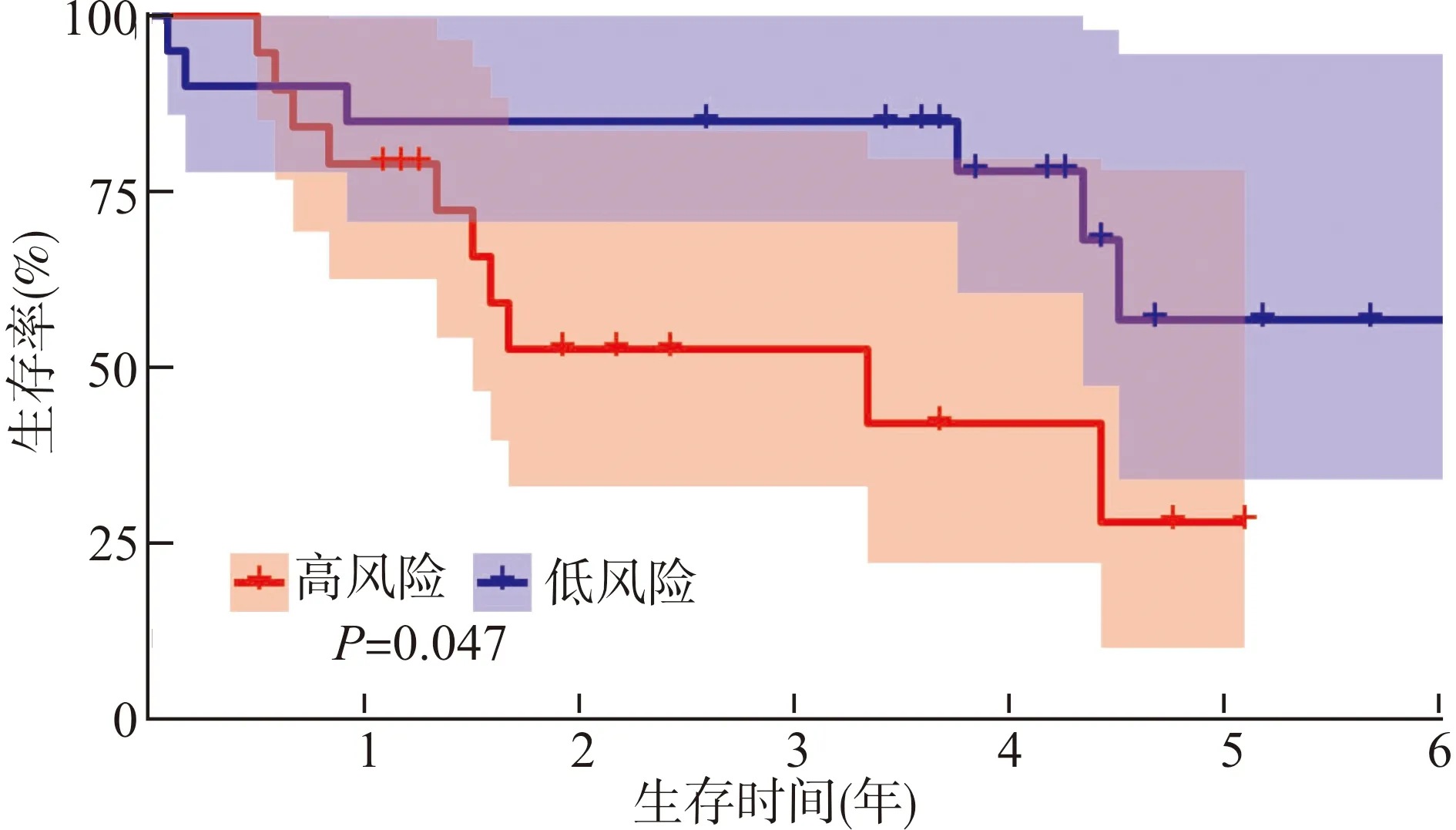
图4 GSE29609数据验证ccRCC高风险组和低风险组患者总体生存率曲线
将患者的临床资料和风险评分结合纳入单因素和多因素Cox分析,结果显示年龄、肿瘤分级和风险评分是影响ccRCC预后的独立危险因素,而其他临床指标不具有预测意义(图5A、B)。同时,以临床资料和风险评分为基础构建预测ccRCC患者预后的诺莫图(图5C),C指数为0.694,用以预测ccRCC患者1年、3年和5年生存率的受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under cure, AUC)分别为0.735、0.702和0.734(图5D),提示构建的预后诺莫图具有较好的预测效能。
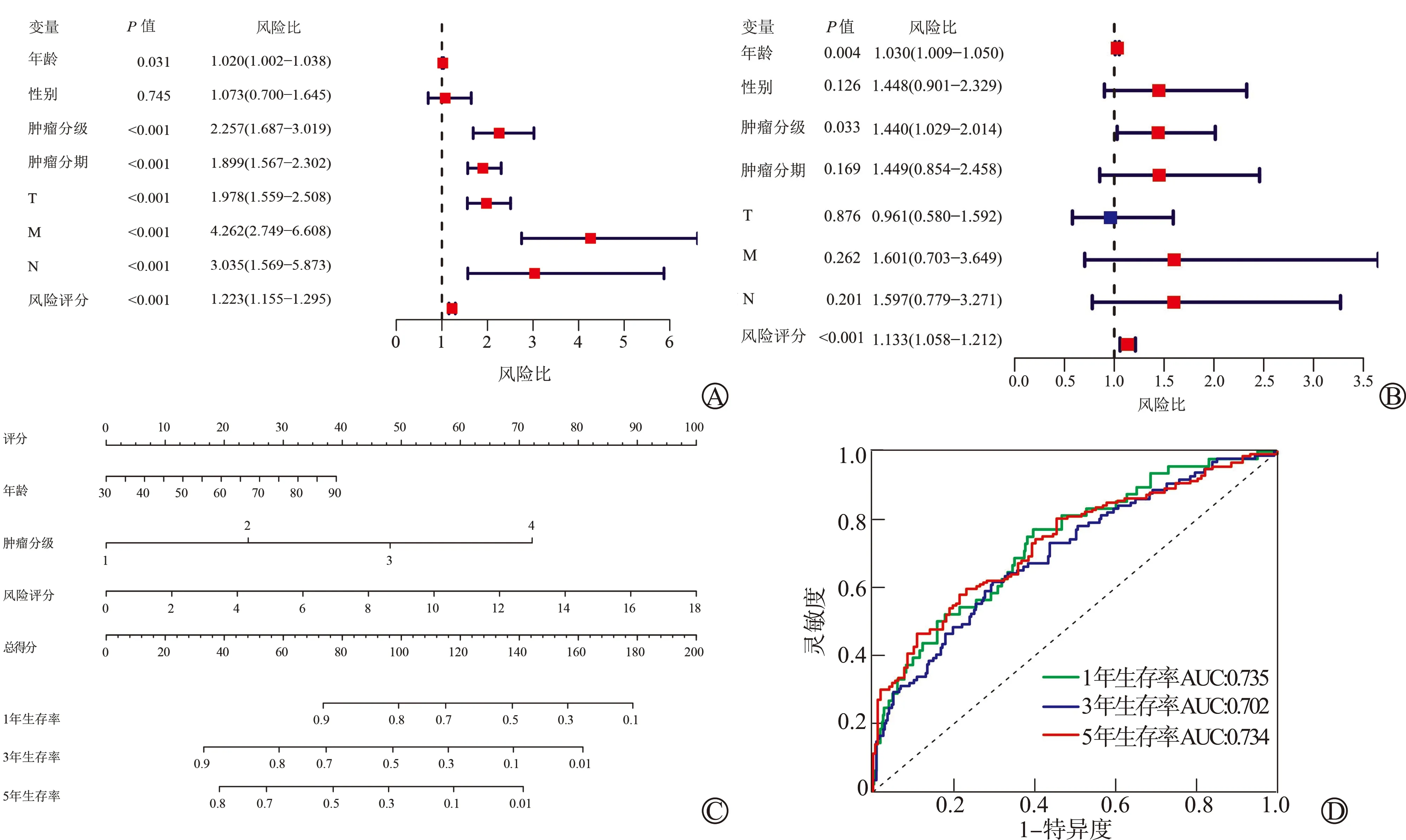
A:单因素Cox回归分析;B:多因素Cox回归分析;C:ccRCC患者1年、3年和5年总生存率的诺莫图;D:预测ccRCC患者1年、3年和5年生存率的ROC曲线图5 ccRCC患者预后危险因素分析和诺莫图模型的构建与验证
讨 论
对于局限性ccRCC,肿瘤切除后复发的风险仍然很高[2]。转移性ccRCC患者使用特异性分子靶向药物酪氨酸激酶抑制剂可以改善生存预后,如肿瘤细胞产生耐药则会导致其预后不佳[4]。而对于无法手术切除或转移性ccRCC患者通常会给予靶向药物和(或)免疫检查点抑制剂治疗,对于这部分患者应增加临床随访时间和频率,适时调整,以选择最佳的辅助治疗方式来改善其预后[5]。因此,寻找影响ccRCC患者预后的因素,用以预测其生存率,指导患者进行系统化和个体化治疗显得尤为重要。
有研究指出,坏死性凋亡是由受体结合丝氨酸/苏氨酸蛋白激酶3以及其底物混合谱系激酶结构域样蛋白共同介导、能够被Necrostain-1抑制的细胞死亡方式,其与细胞凋亡不同,允许免疫原性细胞内容物释放,包括损伤相关分子模式和炎症细胞因子,如白细胞介素-1受体,从而引发炎症[6]。更深入地了解坏死性凋亡的机制和生理作用将有助于了解这些新的细胞死亡效应因子如何靶向治疗炎症性疾病、或触发癌细胞死亡和抗癌免疫反应,以及对肿瘤生物学行为的影响,有可能发现肿瘤治疗的新靶点[7]。本研究通过分析发现,相对于正常组织,ccRCC组织中有36个坏死性凋亡基因表达具有差异性。功能分析显示坏死性凋亡基因主要与炎症体复合物、细胞因子受体结合、坏死性细胞凋亡过程、程序性坏死性细胞死亡、MAPK信号通路以及NOD样受体信号通路等生物学途径密切相关。
本研究发现,有7个坏死性凋亡基因与ccRCC患者的生存和预后密切相关,其中3个基因(FASLG、SLC25A4和STAT4)是保护性因素,4个基因(BID、IFNG、IRF9和 PLA2G4D)是危险因素,并且其表达情况与ccRCC患者生存密切相关。在对深静脉血栓的研究中发现,miR-21在其模型中的表达受到抑制,并通过靶向FASLG调控内皮祖细胞的增殖和血管生成[8]。在肿瘤中,高表达的FASLG可能刺激转化的细胞对抗Fas表达的肿瘤浸润淋巴细胞,并导致这些细胞的免疫逃逸[9]。同样SLC25A4失活会导致乳酸酸中毒、线粒体的过度增殖、氧化磷酸化酶的诱导活性增加、活性氧的增加以及线粒体DNA的过度损伤[10]。STAT4是一种转录因子,受IL-12信号的激活,促进Th1细胞分化和IFN-γ的产生[11]。在卵巢癌中,加入Ad-TBID预处理后,癌细胞对顺铂表现出更高的药物敏感性,线粒体凋亡增加[12]。在胰腺癌患者中使用CDK1/2/5抑制剂可以避免IFNG介导的获得性肿瘤免疫耐药,这种免疫化疗方法可增强肿瘤细胞的凋亡,刺激CD8+T细胞依赖的抗肿瘤免疫[13]。Kaplan-Meier法分析也显示,高风险组患者的生存率比低风险组患者低(P<0.001),进一步使用GEO数据验证也得到相同的结果,证实风险评分与患者的预后密切相关。单因素和多因素Cox分析结果显示年龄、肿瘤分级和风险评分是影响ccRCC预后的独立危险因素,而其他临床指标不具有预测意义。本研究构建的预测ccRCC患者预后的诺模图,C指数为0.694,用以预测ccRCC患者1年、3年和5年生存率的AUC分别为0.735、0.702和0.734,证实该模型在患者的预后预测中有一定的意义,可用于指导ccRCC患者的个体化治疗。
本研究也存在一些局限性。首先,本研究只是从TCGA数据库中获得ccRCC预后相关的坏死性凋亡基因,构建预测预后模型公式,通过GEO数据库中ccRCC患者数据验证预后模型公式的准确性,并未严格区分出人种,所以在应用到我国ccRCC患者中有可能因为人种以及遗传性等存在一定的差异。其次,本研究样本量相对较小,尚需要前瞻性和多中心研究来验证获得标记基因的预测价值。最后,本研究仅单一使用统计学方法对数据进行分析和处理,后续还需要设计一些实验来探讨所获得基因与ccRCC患者预后相关的生物学功能以及作用机制。

