槟榔种质资源离体繁殖体系研究
李栋梁,王景飞,周颖怡,陈业光,张雯婷,戚华沙,陈 宣*
(1.海南省农业科学院 热带园艺研究所,海南省热带特种经济植物种质资源创新利用重点实验室,海南 海口 571100;2.中国医学科学院 药用植物研究所海南分所,海南省南药资源保护与开发重点实验室,海南 海口 570311)
0 引言
【研究意义】槟榔(ArecacatechuL.)是棕榈科槟榔属热带亚热带经济作物,为我国四大南药之一,具有较高的经济效益。海南省槟榔种植面积约20万hm2,收获面积10万hm2,总产量55万~60万t,产值260亿元以上,槟榔是海南省东部、中部和南部农民增加收入的重要途径[1]。然而,槟榔病虫害的发生制约了槟榔产业的发展,尤以黄化病的发生影响最重[2-4]。因此,建立槟榔离体保存技术,可从源头上降低病菌、防止优良种质退化,有利于保护槟榔优良种质资源,也有利于种质资源惠益分享和创新利用。【前人研究进展】槟榔种质资源丰富多样,一般按果形分为长椭圆形、椭圆形、球形、卵形、倒卵形和心脏形等6类,不同槟榔品种果实口感及化学成分存在差异[3]。槟榔为单株单杆植物,主要靠种子育苗繁殖,但存在种子发芽慢、发芽不整齐且易感病菌等问题。棕榈科植物组培快繁技术属于世界难题,目前仅油棕、海枣获得突破[5-6],椰子的组培技术有初步研究[7-8]。我国针对槟榔离体培养研究方面的报道较少。黄丽云等[9]将槟榔幼胚离体培养分为4个阶段,筛选出不同阶段培养基,其中,MS培养基对槟榔种子芽组培生长促进作用效果较好,对根的诱导和生长也有效果。黄丽云等[10]研究表明,以槟榔幼胚为外植体,最佳培养基配方组合为MS培养基+4 g/L活性炭+40 g/L蔗糖。【研究切入点】槟榔作为我国热带地区重要的经济作物之一,其组培技术瓶颈尚待破解,目前尚未建立成熟的组培体系[11-12]。【拟解决的关键问题】以槟榔种子作为试验材料,研究槟榔外植体消毒、芽诱导培养、芽增殖培养及生根壮苗培养,建立槟榔的离体繁殖技术体系,为进一步开发利用槟榔资源及其保护提供技术支撑。
1 材料与方法
1.1 试验材料
成熟健康的槟榔果实采自海南省热带作物标准化生产示范园(海南农垦荣光农场有限公司乐东千家槟榔生产基地),槟榔树龄20年。将成熟健康的槟榔果实在流水下冲洗干净并晾干,置于100 mg/L IAA中浸泡24 h备用。
1.2 试验方法
1.2.1 外植体消毒 将预处理完的槟榔果在流水下冲洗,然后放置于稀释的洗洁精液浸泡摇荡6 min,自来水冲洗干净,装入无菌水瓶中振荡15 min,转速为120 r/min。在超净工作台上用无菌滤纸吸干表面水分,用75%酒精消毒10 s,再用酒精灯烧10 s去皮取种子。种子消毒设置5个处理,即于0.1% HgCl2溶液中分别浸泡2 min、5 min、8 min、10 min和15 min,浸泡完毕后无菌水冲洗5次,并用无菌纸吸干表面水分,备用。
1.2.2 芽的诱导 以MS为基础培养基,以细胞分裂素6-BA和生长素NAA为试验因子,6-BA设置5个浓度梯度(1.0 mg/L、2.0 mg/L、3.0 mg/L、4.0 mg/L、5.0 mg/L),NAA设置4个浓度梯度(0.2 mg/L、0.35 mg/L、0.5 mg/L、0.70 mg/L),进行不同浓度配比的芽诱导正交试验,将消毒后的外植体分别接种至不同浓度配比的6-BA和NAA培养基中,每个处理50个外植体,重复3次,每10 d观察统计芽诱导情况,30 d后统计萌芽率和污染率。
萌芽率=未污染的萌芽种子数/(接种的种子数-污染的种子数)×100%
污染率=(污染的种子数/接种的种子数)×100%
1.2.3 芽的增殖 选取长约1.5 cm的萌芽作为试材,在MS培养基中添加浓度分别为1.0 mg/L、2.0 mg/L、3.0 mg/L的6-BA与浓度分别为0.2 mg/L、0.6 mg/L的NAA溶液,每处理50个萌芽,定期观察,培养30 d后统计增殖系数,筛选增殖培养最佳的6-BA与NAA配比。
增殖系数=总数/接种数
1.2.4 生根培养 在MS培养基中分别添加浓度为0.00 mg/L、1.00 mg/L、1.50 mg/L、2.00 mg/L、3.00 mg/L NAA,待种芽萌发约5 cm后直接转接到生根培养基中。每处理50株,定期观察,培养30 d后统计生根数和生根率,筛选生根最佳的NAA浓度。
生根率=生根苗数/接种苗数×100%
平均根数=根总数/生根苗数
1.3 数据统计分析
采用SPSS 25.0对数据进行统计分析。
2 结果与分析
2.1 不同消毒时间槟榔种子的消毒效果
从表1看出,HgCl2消毒2~5 min的槟榔种子污染率为38%~46%,萌芽率达100%;当消毒时间延长至8 min时,污染率降至36%,萌芽率略降,为94.82%;消毒10 min和15 min时,槟榔种子污染率降至10.00%和10.67%,萌芽率降低至94.75%和85.08%。经观测,消毒时间在2~8 min时槟榔种子接种至培养基上5~10 d内露白,而消毒10 min和15 min的种子接种10 d后才陆续露白。表明,适当的消毒时间可以良好控制槟榔种子离体培养的污染率和萌芽率,但消毒时间过长对槟榔种子会产生一定的毒害抑制作用。综合比较,采用0.1% HgCl2消毒槟榔种子时间以10 min最佳。
2.2 6-BA和NAA不同浓度配比槟榔芽的诱导效果
从表2可知,在不同浓度配比的6-BA和NAA培养基中,槟榔种子均可以萌芽,但萌芽率和芽长势差异较大。在没有添加6-BA和NAA的MS基础培养基(CK)中,槟榔种子萌芽率最低,仅28.33%,且芽长势差。在没有添加6-BA的处理中(处理2~处理5),随着NAA浓度的增加,萌芽率在34.00%~50.33%,呈先升后降趋势,芽长势均不理想。在没有添加NAA的处理中(处理6、处理11、处理16、处理21、处理26),随着6-BA浓度的增加,萌芽率在50.67%~89.00%,呈先增后降趋势,高于仅添加NAA的处理,芽长势除处理16(6-BA浓度为3.00 mg/L)生长良好外,其他浓度均较差。在同时添加6-BA和NAA的处理中,6-BA浓度不变的情况下,萌芽率随着NAA浓度增加呈先增后降趋势;NAA浓度不变的情况下,萌芽率随着6-BA浓度升高呈先增后降趋势。各处理组合中,6-BA浓度为3.00 mg/L与NAA不同浓度配比(处理16~处理20)的萌芽率较高,在82%~95.67%,长势均良好,以处理19的萌芽率最高。综合比较,筛选出槟榔种子萌发最佳培养基为MS+3.00 mg/L 6-BA+0.5 mg/L NAA。
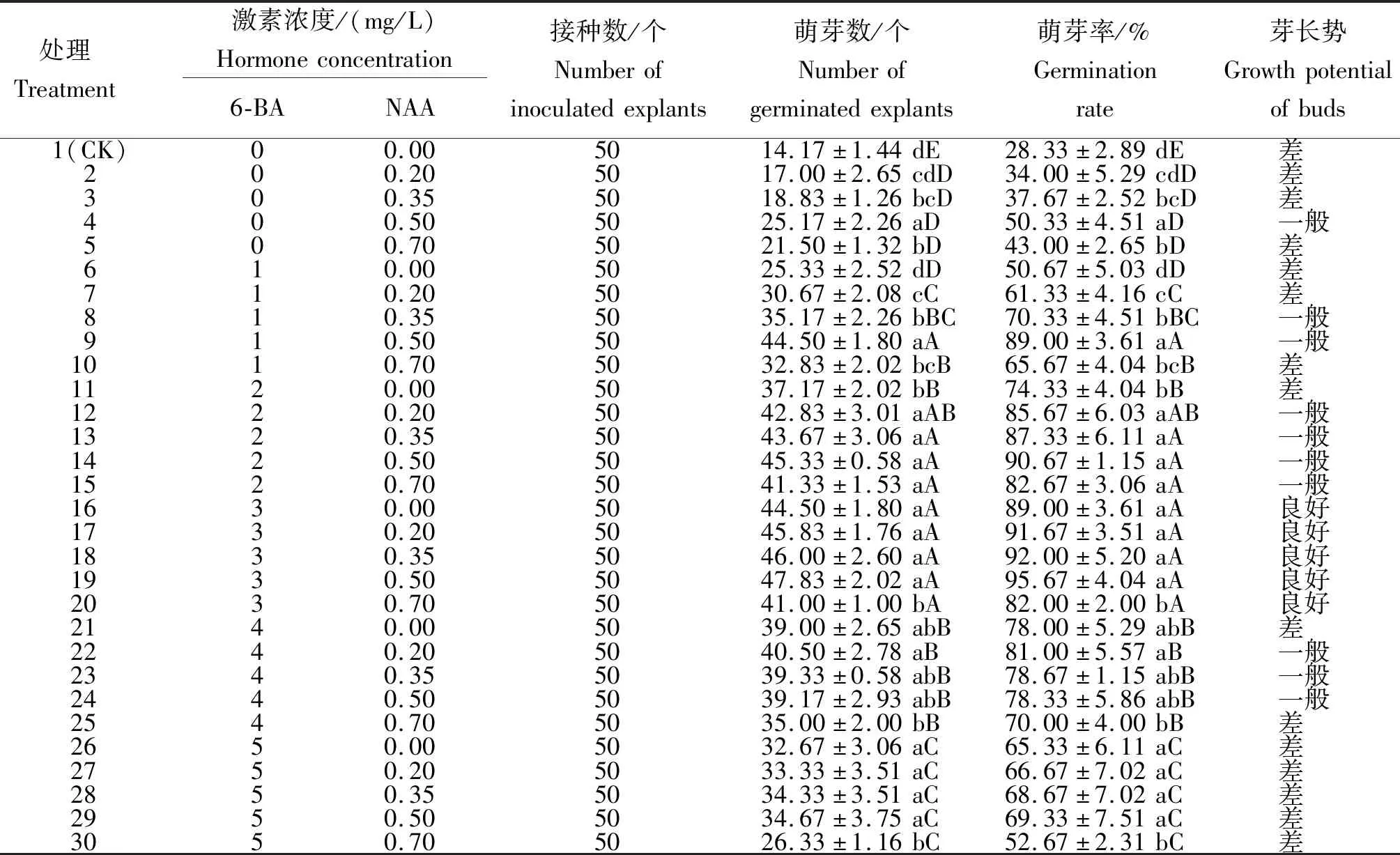
表2 6-BA和NAA不同浓度配比槟榔芽的萌芽率及芽长势Table 2 Germination rate and growth vigor of areca-nut explants cultured with different concentration ratio of 6-BA and NAA
2.3 6-BA和NAA不同浓度配比槟榔芽的增殖效果
槟榔芽增殖试验结果表明,不同浓度6-BA与NAA组合对槟榔芽增殖无影响,增殖系数均为1,符合其植物生物学特性。
2.4 不同浓度NAA下槟榔根系的分化情况
将诱导出芽的槟榔种苗接种到添加有不同浓度NAA的培养基中进行生根培养,8 d后在芽的基部陆续形成不定根。从表3可知,培养基不添加NAA处理的槟榔种苗可以生根,生根率仅70.67%,生根数为4.33条,且12个月离体保存的苗长势一般;随着NAA浓度逐渐升高,槟榔种苗生根率呈先升后降趋势,以添加1.00 mg/L NAA的生根率和生根条数最高,分别达95.33%和7.33条,12个月离体保存苗长势健壮。NAA其他浓度下,槟榔种苗生根率在86.67%~92.00%,生根数在4.67~6.67条,槟榔种苗12个月离体保存的长势一般或偏弱,部分在离体保存11个月出现叶片微黄症状。

表3 不同浓度NAA下槟榔根系分化及苗离体保存生长状况Table 3 Root differentiation and growth status of areca-nut seedlings under different NAA concentration
3 讨论
棕榈科植物组培快繁技术属于世界难题,目前仅油棕、海枣获得突破[5-6],椰子的组培技术有初步研究[7-8]。吴翼等[13]在研究椰子胚的离体培养过程中发现,不同灭菌方式对离体胚的灭菌效果不同,随着HgCl2灭菌时间延长,离体胚污染率降低,但褐化率升高,表现出消毒剂对离体胚损伤愈严重;当用75%酒精表面灭菌1 min,0.15% HgCl2对胚乳灭菌20 min,0.03% HgCl2对胚灭菌10 min时,消毒效果最佳,污染率仅8.0%,褐化率5.3%,成活率86.7%。槟榔种质资源离体保存技术,无菌种子的获得比无菌胚的相对简单,而且种仁不仅可以保护幼胚不受机械或环境损伤,还可以为幼胚提供母体营养。槟榔种子表面光滑,质地坚硬,消毒容易,但必须经过处理才能获得无菌种子。研究结果表明,采用0.1% HgCl2消毒槟榔种子2~15 min,随着消毒时间延长,污染率和萌芽率均逐步降低,消毒时间以10 min最佳,污染率仅10%,萌芽率达94.75%。消毒时间过长对槟榔种子会产生一定的毒害作用,这与对椰子胚的研究结果[13]基本一致。在生根培养研究方面,多数植物采用单一生长素即可实现,但多种生长素配合使用的效果较佳,吴翼等[13]采用IBA 2.0 mg/L、NAA 2.0 mg/L与6-BA 1.0 mg/L配合使用,椰子生根效果最好,初生根2~4条,次生根和三级根较多,为炼苗移栽提供了良好的物质基础。研究表明,当NAA浓度为1.00 mg/L时,生根率和生根条数最高,分别达95.33%和7.33条,离体保存苗长势健壮。比较发现,椰子和槟榔虽然都为棕榈科植物,但在生根发育阶段,不同种作物对激素需求种类并不一致,槟榔可以通过单一激素实现良好的根系分化,椰子需要通过多种激素组合才能达到最佳生根效果。
在槟榔胚离体培养发育过程中,胚吸器先膨大,随后分化出芽和根。研究发现,不同种类、不同配比的植物生长调节物质对植物组培快繁各个环节均有明显影响,在不定芽诱导、增殖及生根培养中,外源激素的合理配比尤为关键。过低和过高的质量浓度都会导致萌芽率和芽长势较差,适宜的6-BA与NAA组合才有助于萌芽、愈伤组织诱导与增殖。黄丽云等[14]研究表明,不同浓度6-BA与NAA配比对槟榔胚离体培养影响不一样,6-BA浓度为2 mg/L对胚芽、胚根生长具有明显的促进作用,NAA浓度为0.5 mg/L时胚根生长良好,幼苗长势整齐。研究结果表明,槟榔种子芽诱导最优激素组合为3.00 mg/L 6-BA+ 0.5 mg/L NAA,萌芽率高达95.67%,这与椰子继代培养研究中6-BA和NAA浓度均为1.0 mg/L略有差异,说明不同植物对激素浓度的响应不同[13]。
4 结论
经过HgCl2预处理后的成熟健康槟榔果实,去皮取种子,采用0.1% HgCl2消毒处理10 min的效果最佳,种子污染率仅10%,萌发率达94.75%;将槟榔种子接种至MS+ 3.00 mg/L 6-BA+0.5 mg/L NAA培养基中,萌芽率达95.67%,芽长势良好;将出芽的槟榔种子转接于1.0 mg/L NAA的MS培养基中进行生根培养,生根率和生根数分别达95.33%和7.33条。建立的槟榔种质资源离体繁殖技术操作性强、可行性高,可在生产上大力推广应用。

