圈养梅花鹿肠道菌群组成的性别差异
史倍宁,赵耀,林子涵,田佳欣,孙嘉,马雅雯,刘振生,2,滕丽微,2
(1.东北林业大学野生动物与自然保护地学院,哈尔滨,150040;2.国家林业和草原局野生动物保护生物学重点实验室,哈尔滨,150040)
肠道菌群广泛存在于动物肠道内,与宿主具有良好的共生关系[1],在动物营养吸收、组织发育和免疫功能等方面起着许多关键作用。动物能在充满挑战的自然环境下存活主要受其体内或体表微生物群落(尤其是肠道菌群)的影响[2]。肠道菌群失调会影响动物的胆汁酸、胆固醇代谢,与胆结石的形成密切相关[3],因此维持动物体内肠道菌群平衡至关重要。肠道菌群结构及多样性与多种因素有关,如环境[4]、季节[5]、食性[6]和性别[7−8]等。不同性别的同一物种由于分泌的性激素存在差异,会对肠道菌群的构成和丰度造成影响[9],如林麝(Moschus berezovskii)不同性别间肠道菌群结构存在差异,与不同生长阶段的免疫抵抗力变化有关[10];阿拉善马鹿(Cervus elaphus alashanicus)冬季肠道菌群组成受性别影响,与雌、雄阿拉善马鹿食性不同有关[11];不同性别大熊猫(Ailuropoda melanoleuca)肠道菌群多样性及其群落结构组成主要受饮食结构影响[12];短期高脂饮食对不同性别小鼠肠道菌群结构存在影响,可能与不同性激素与肠道菌群的相互作用有关[13]。因此,在相同圈养环境下,性别对梅花鹿肠道菌群结构及多样性的影响可能与多种因素有关。
梅花鹿(Cervus nippon)是东北亚季风区特产的一种珍贵药用动物,分布较广,我国历史上曾存在 6 个亚种[14−15],包括山西亚种(C.n.grassianus)、华北亚种(C.n.mandarinus)、台湾亚种(C.n.taiouanus)、东北亚种(C.n.hortulorum)、华东亚种(C.n.kopschi)和四川亚种(C.n.sichuanicus),但对于其中部分种群是否存在还有争议。目前,国内对梅花鹿的研究范围较广,包括食性[16]、行为[17]、栖息地选择[18]和遗传多样性[19]等,但关于性别对圈养梅花鹿肠道菌群影响的研究尚未见报道。本研究利用16S rRNA 高通量测序技术,探究不同性别间圈养梅花鹿肠道菌群的结构、多样性以及差异,旨在为圈养梅花鹿的营养代谢和免疫机制研究提供基础数据,提高其迁地保护的存活率。
1 材料与方法
1.1 样品采集
2020 年7 月,在银川市中山公园采集常规饲养、饲料日粮(玉米、苜蓿草等)组成相同和无抗生素等药物治疗的10 只(6、4♀)健康梅花鹿个体粪便(表1)。在采样前1 d晚上清理笼舍,于次日早晨投喂饲料前收集粒状、新鲜且相对完整的粪便。采集过程中为防止交叉污染,每采集1 个粪便样本换1 副PE手套。采样后立刻将粪便冷冻,或提前准备冰袋暂时保存,到实验室后再冷冻保存。
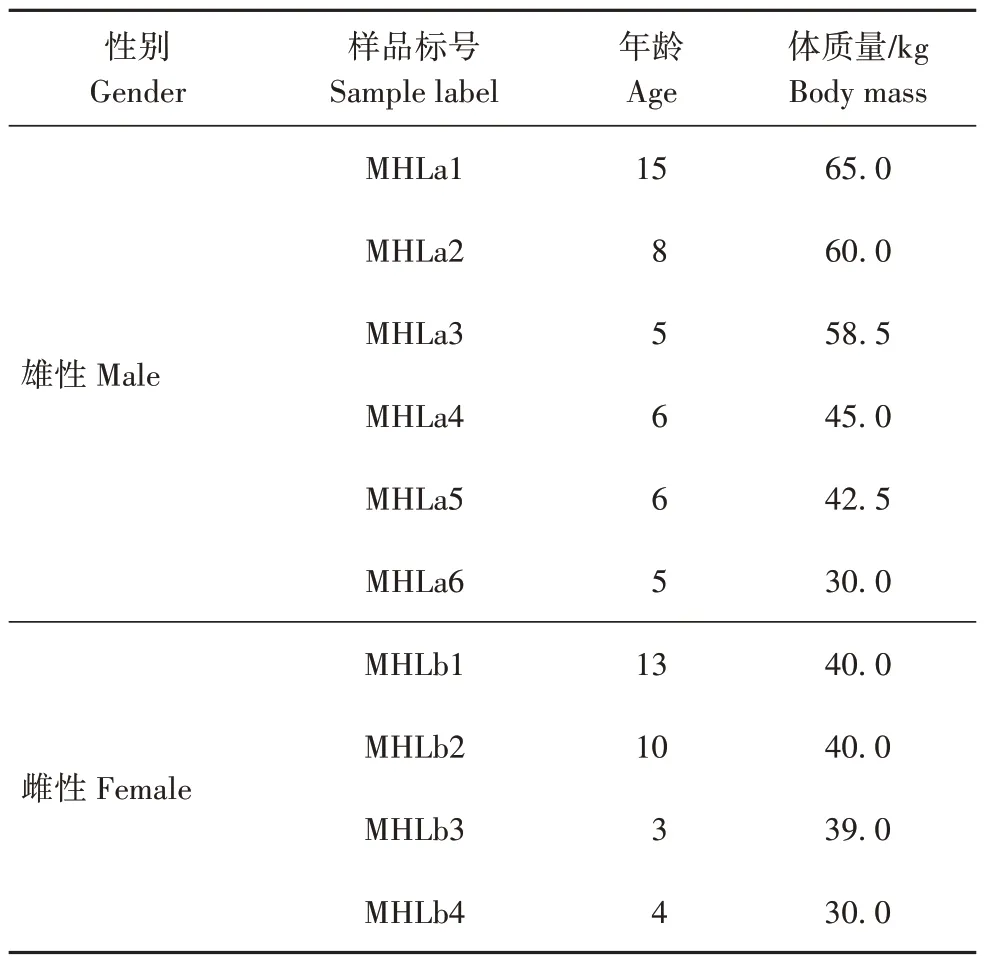
表1 梅花鹿粪便样品信息Tab.1 Information on fecal samples of sika deer
1.2 样品处理
按照E.Z.N.A Mag-Bind Soil DNA Kit 试剂盒(Omega,USA)说明书提取雄、雌样品的总DNA,然后用Qubit 3.0 DNA 检测试剂盒(Life,USA)和1%琼脂糖凝胶电泳检测基因组DNA 浓度和质量。依据16S rRNA V3—V4 区通用引物(341F:5′-ATGCGTAGCCGACCTGAGA-3′;805R:5′-CGTCAGACTTTCGTCCATTGC-3′)对样本进行PCR 扩增,具体反应体系和参数按照Du等[20]方法。PCR 扩增产物经1%琼脂糖凝胶电泳检测后,选用0.6 倍的磁珠对其纯化吸收。使用Qubit 3.0 DNA 检测试剂盒测定回收的DNA 浓度,将纯化的扩增产物按1∶1 等量混合。处理后的样品在Illumina MiSeq PE300 平台上测序。
1.3 高通量测序
通过碱基识别分析,将得到的原始图像数据文件转化为原始测序序列,以FASTQ 文件格式存 储,结果包括测序序列的序列信息以及对应的测序质量信息。使用Cutadapt(v 1.18)去除引物接头序列,再根据PE reads 之间的overlap 关系,使用PEAR(v 0.9.8)将成对的reads 拼接成一条序列。利用Usearch(v 11.0.667)软件,提取各样本优化序列 中的非重复序列(不含单序列),聚类分配成操作 分类单元(OTU)。使用RDP classifier(v 2.12)并比对RDP数据库(http://rdp.cme.msu.edu/misc/ resources.jsp),得到每个OTU 在不同分类水上的 物种信息。基于聚类结果,使用R(v3.6.0)中的VennDiagram(v1.6.20)包计算绘制物种分布Venn图,以此统计雄、雌样本中共有和独有的OTU 数目;同时,利用ggplot2 包绘制相对丰度柱状图,直 观掌握圈养梅花鹿肠道菌群构成及相对丰度含量。
1.4 数据处理与分析
采用Mothur(v 3.8.31)计算样本组内α多样性指数,包括Simpson、Chao1、Ace、Shannon 和Coverage指数,运用t检验检测2 组样品在α多样性上的差异性。利用Mothur做rarefaction 分析,通过R 软件绘制稀释性曲线,判断本次测序结果能否代表样品真实情况。使用R 软件中的vegan 包,在门、属水平上对雄、雌梅花鹿样品组间进行β多样性分析,基于Bray-Curtis 距离的主坐标分析(PCoA)以及Adonis 分析,检验不同性别梅花鹿肠道菌群组间的差异性。为了揭示受宿主性别影响较大的菌群,通过STAMP(v 2.1.3)确定不同性别梅花鹿肠道菌群间是否存在差异物种[21],利用LEfSe(v 1.1.0)获得雄、雌样品中起重要作用的菌群。
2 结果
2.1 样品测序
从10 只圈养健康梅花鹿粪便样本中共得到有效序列853 271 条,样本长度为352~475 bp,平均长度412 bp,以97% 相似水平聚类分析得到2421个OTUs,其中雄、雌性样品共有1983个OTUs,雄性和雌性分别独有298、140 个OTUs(图1),表明圈养梅花鹿肠道中共有菌群普遍分布,但各性别也具有独特的菌群。稀释性曲线(图2)和所有样品的Coverage 指数均大于99.20%,说明本次测序结果能有效反映雄、雌样品肠道菌群真实情况。

图1 雄、雌圈养梅花鹿OTUs韦恩图Fig.1 Venn diagram of OTUs of male and female captive sika deer
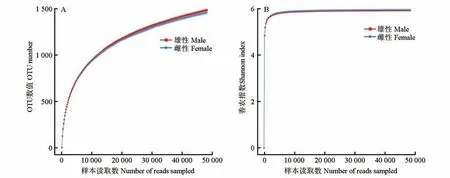
图2 雄、雌圈养梅花鹿OTU数值(A)和Shannon指数(B)的稀释性曲线Fig.2 Rarefaction curves of OTU number(A)and Shannon index(B)of male and female captive sika deer
2.2 肠道菌群构成及相对丰度含量
基于OTUs 分类结果,共注释到细菌27 门52纲79目154科282属。2组样品中相对丰度含量最高的3 个菌门均为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)(图3A),其中,厚壁菌门(61.69%,♀58.23%)和拟杆菌门(27.40%,♀31.19%)相对丰度含量较高,两者相对丰度含量之和超过85.00%,是10 只圈养梅花鹿样品中的优势菌门,疣微菌门为第3 丰度菌门,在雄、雌样品中分布比例相似(3.86%,♀3.75%)。雄性样品中相对丰度含量较多的广古菌门(Euryar⁃chaeota)在雌性样品中略少(1.01%,♀0.58%),在相对丰度含量≤0.01%的candidate_division_WPS-1、芽单胞菌门(Gemmatimonadetes)、脱铁杆菌门(De⁃ferribacteres)和恐球菌-栖热菌门(Deinococcus-Thermus)4种菌门中,仅candidate_division_WPS-1是雌性圈养梅花鹿肠道菌群的独有菌门,其余3种菌门为雄性独有菌门。
在属水平上,雄性圈养梅花鹿相对丰度最高的 5 个菌属依次是拟杆菌属(Bacteroides,4.60%)、梭菌属(Clostridium_IV,3.42%)、Akkermansia(2.78%)、瘤胃球菌属(Ruminococcus,1.78%)和普雷沃菌属(Pre⁃votella,1.70%);雌性圈养梅花鹿相对丰度含量最高的5 个菌属依次是拟杆菌属(6.13%)、梭菌属(3.25%)、Akkermansia(3.18%)、普雷沃菌属(2.18%)和瘤胃球菌属(1.92%)(图3B)。其他菌属在不同性别中的相对丰度含量也有所差异。

图3 圈养梅花鹿肠道菌群在门水平(A)和属水平(B)的相对丰度Fig.3 Relative abundance of intestinal microbiota of captive sika deer at the phylum(A)and genus(B)levels
2.3 肠道菌群多样性
通过α多样性分析表明,雄性圈养梅花鹿的Simpson、Chao1 和Ace 值均高于雌性,Shannon 值低于雌性,说明雄性圈养梅花鹿肠道菌群丰富度高于雌性,但菌群多样性低于雌性。通过分析雄、雌圈养梅花鹿组内多样性指数,结果表明2 组样品的Simp⁃son、Chao1、Ace 和Shannon值差异均不显著(p>0.05)(表2),说明雄、雌圈养梅花鹿样品组内不存在显著性差异。

表2 雄、雌圈养梅花鹿肠道菌群平均多样性指数Tab.2 Mean diversity index of intestinal microbiota of male and female captive sika deer
图4 显示,雄、雌样品间不具有明显的分离现象,所有样品间距离较近,表明不同性别的圈养梅花鹿肠道菌群组成相似度较高。Adonis 分析发现,不同性别的圈养梅花鹿肠道菌群组间无显著性差异(门水平:F=1.49,R2=0.16,p=0.21;属水平:F=0.51,R2=0.06,p=0.79)。

图4 雄、雌圈养梅花鹿在门水平(A)和属水平(B)的PCoA分析Fig.4 PCoA analysis of male and female captive sika deer at the phylum(A)and genus(B)levels
2.4 肠道菌群差异物种
STAMP 分析表明,雄、雌样品在门、属水平上存在显著差异物种(图5)。在门水平上,雄、雌样品的拟杆菌门(p=0.033)和芽单胞菌门(p=0.027)丰度比例差异显著;在属水平上,雄、雌样品的Acetanaero⁃bacterium(p=0.044)、unclassified_Erythrobacteraceae(p=0.028)、芽单胞菌属(Gemmatimonas;p=0.027)、Demequina(p=0.026)、类诺卡氏菌属(Nocardioides;p=0.020)和unclassified_Sinobacteraceae(p=0.016)丰度比例差异显著。根据LEfSe 分析(LDA 值>4)结果,雄、雌圈养梅花鹿组间显著差异的物种主要为拟杆菌门,在雌性圈养梅花鹿中对组间差异效果影响较大(图6)。

图5 雄、雌圈养梅花鹿在门水平(A)和属水平(B)的不同物种丰度比例差异Fig.5 Differences in the proportion of abundance of different species of male and female captive sika deer at the phylum(A)and genus(B)levels
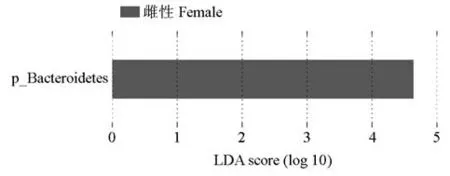
图6 圈养梅花鹿肠道菌群的LEfSe分析结果Fig.6 LEfSe analysis diagram of intestinal microbiota of captive sika deer
3 讨论
长期相同的高纤维饮食以及进化适应会导致圈养梅花鹿肠道菌群结构及多样性发生变化,但在众多影响因素中,性别因素总是被忽略,因此本研究以性别为分组因素,采集10 只圈养健康梅花鹿粪便,利用16S rRNA 高通量测序技术,探究不同性别圈养梅花鹿肠道菌群的结构及多样性。研究发现性别对圈养梅花鹿肠道菌群结构及多样性无显著影响,且
有多种因素导致该结果产生,同时揭示了圈养梅花鹿肠道中受性别因素影响较大的菌群。
本研究雄、雌样品肠道菌群共同拥有1 983 个OTUs,分别占二者OTUs 总数的86.94%和93.41%,说明雄、雌圈养梅花鹿体内均有较多的共有菌群。在相同饲料及圈养环境下,不同性别梅花鹿肠道菌群与宿主之间共同进化,增加了二者肠道内共有菌群的比例。从菌群构成来看,无论雄性、雌性,厚壁菌门和拟杆菌门的相对丰度含量总和在圈养梅花鹿肠道菌群中均超过85%,是圈养梅花鹿的优势菌门,与野生条件下梅花鹿肠道菌群的研究结果[22]一致,表明这2种菌门在梅花鹿生理功能上起着重要作用。厚壁菌门能分解食物中的纤维素并将其降解为挥发性脂肪酸,而拟杆菌门可以帮助宿主消化复杂的粗纤维,参与分解代谢有毒物质[23],因此梅花鹿通过体内肠道菌群能够消化吸收植物细胞壁类的成分并摄取机体所需的能量,梅花鹿肠道菌群的构成在一定程度上有利于分解代谢食物。在属水平上,雄、雌圈养梅花鹿肠道菌群相对丰度含量最高的2 个菌属均为拟杆菌属和梭菌属,而海南坡鹿(Cervus eldii hainanus)肠道菌群的核心菌属为普雷沃菌属[24],造成此差异的原因可能是物种、饮食和生活环境的不同。在梅花鹿体内,拟杆菌属作为一种重要的糖化菌,能产生大量的糖苷水解酶将三萜糖苷等转化为极性小、亲脂性高的小分子,从而有利于动物肠道对营养物质的吸收;同时定植于肠道的梭菌属细菌可通过刺激机体肠嗜铬细胞(enterochromaffin cell,ECs)分泌5-羟色胺(5-HT)来显著促进胃肠道蠕动[25]。2种菌属共同合作能够有效保障梅花鹿肠道吸收营养物质,促进顺利排泄。在门、属水平上,雄、雌圈养梅花鹿肠道菌群组成物种相似,但相对丰度含量存在差异,与雄、雌大林姬鼠(Apodemus peninsu⁃lae)肠道菌群的研究结果[26]一致。不同性别梅花鹿肠道菌群组成具有一定的保守性,但年龄会影响个体的菌群分布,肠道菌群结构会随着年龄增加而更为复杂,个体之间差异也更明显。
从菌群多样性来看,雄性圈养梅花鹿肠道菌群丰富度高于雌性,但菌群多样性低于雌性,这可能与雄、雌梅花鹿的性类固醇水平不同有关。性类固醇可通过调节肠屏障的完整性和通透性、性激素受体、β-葡萄糖醛酸酶、胆汁酸以及免疫系统等机制影响梅花鹿肠道菌群结构[27],使不同性别梅花鹿肠道菌群的丰富度及多样性存在差异。但本研究发现这种差异不具有显著性,与雄、雌塔尔羊(Hemitragus jem⁃lahicus)得出的研究结论[28]一致。由于食物、生活环境长期相同,雄、雌圈养梅花鹿为了尽可能获得更多的食物来满足营养需求,导致肠道菌群组内进化结果具有较高的一致性。β多样性分析表明,雄、雌圈养梅花鹿肠道菌群组间无显著性差异,与不同性别的猎豹(Acinonyx jubatus)[29]、狍(Capreolus pygar⁃gus)[30]和貉(Nyctereutes procyonoides)[31]的研究结果一致,表明性别对圈养梅花鹿组间肠道菌群结构及多样性影响并不显著,仍存在其他未知因素与之密切相关,如不同的肠段、生长阶段等。不同性别的野猪(Sus scrofa)肠道菌群多样性总体上无显著差异,但不同肠段中表现出一定的雄、雌差异[32]。克氏原螯虾(Procambarus clarkii)肠道菌群在群落多样性和物种丰度上均未体现出性别间差异,但在不同生长阶段中存在显著差异[33]。
在雌性梅花鹿中起重要作用的菌群为拟杆菌门,雌性拟杆菌门的相对丰度含量大于雄性。一方面,拟杆菌门能参与动物体内糖、胆汁酸和类固醇代谢,帮助宿主分解多糖提高营养利用率,为机体提供能量;另一方面,能将难消化的大分子碳水化合物转化为短链脂肪酸,减少促炎因子的生成,降低结肠炎症的发生[34]。因此,与雄性圈养梅花鹿相比,雌性圈养梅花鹿肠道中的营养、能量代谢率较高,环境适应能力较强,肠道疾病发病率较低,具有更好的肠道微生态系统。
本研究通过采集圈养条件下不同性别梅花鹿的粪便,探究性别因素对肠道菌群结构及多样性的影响,为后续梅花鹿肠道菌群研究提供合理的依据,但本研究仍存在一定局限性,在未来应集中研究野生条件下不同性别梅花鹿肠道菌群结构和多样性,以及圈养、野生条件下二者肠道菌群的差异,这对保护梅花鹿具有重要意义。

