TLR4和CXCR4在天疱疮患者中的表达
陈艳梅 王 川 刘亭亭 糜自豪 孙乐乐 赵 晴 王 娜 李丽宸 刘 红 张福仁
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,济南,250022
天疱疮(pemphigus)是由抗桥粒芯糖蛋白(desmogleins,Dsg)IgG抗体介导的自身免疫性疾病,主要类型有寻常型天疱疮(pemphigus vulgaris,PV)和落叶型天疱疮(pemphigus foliaceus,PF)。目前天疱疮的发病机制尚未被完全阐释清楚,但是产生自身致病性抗体的B淋巴细胞无疑在其中起到了关键作用,除此之外,B淋巴细胞还可导致促炎细胞因子的过度产生以及具有抗原递呈作用,从而将先天免疫与适应性免疫联系起来[1]。B淋巴细胞的激活与分化受到多种因素的调控,其中外源性和内源性的Toll样受体4(Toll-like receptor 4,TLR4)配体,如脂多糖和HMGB1,都可以通过TLR4/MD2信号转导激活B细胞[2,3];低氧条件下,趋化因子受体4型(C-X-C chemokine receptor type 4 ,CXCR4)通过核因子样蛋白2(NRF2)和低氧诱导因子(HIF)-1α协同促进B细胞活性[4],说明CXCR4和TLR4对B细胞的发育及激活具有重要作用。CXCR4在系统性红斑狼疮(systemic lupus erythematosus,SLE)B细胞上呈高表达[5],TLR4在天疱疮患者皮损部位表达增加[6],TLR4+CXCR4+浆细胞在SLE患者外周循环中增多并且推动系统性红斑狼疮性肾炎的发生[7]。由上可知,作为可能调控自身抗体产生的关键因素,TLR4和CXCR4在天疱疮病理机制的作用知之甚少,本研究旨在探索TLR4和CXCR4在天疱疮皮损及外周浆细胞中的表达,分析其在天疱疮发病中的潜在作用。
1 材料与方法
1.1 研究对象 收集2021年6~12月山东第一医科大学附属皮肤病医院皮肤科收治的未经免疫抑制剂、糖皮质激素等药物治疗的,经临床表现、组织病理学、免疫病理学、特异性抗体检测诊断的15例天疱疮患者作为病例组,其中男8例,女7例,平均年龄(43.6±13.7)岁,另选取13名排除自身免疫性疾病、恶性肿瘤、感染等疾病的正常人作为对照组,其中男9名,女 4名,平均年龄(45.1±8.5)岁。天疱疮患者和健康对照临床和人口学特征见表1。
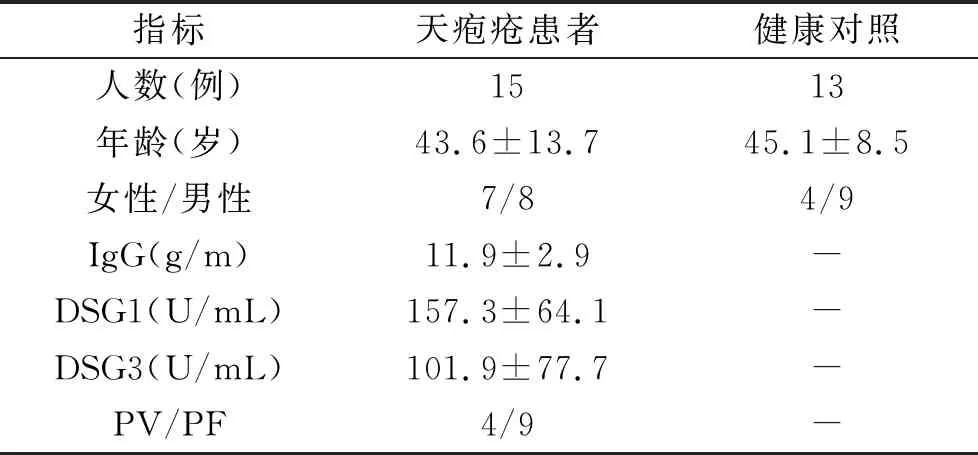
表1 天疱疮患者和健康对照临床和人口学特征
1.2 研究方法
1.2.1 流式细胞检测 收取的外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),用含10%胎牛血清(FBS)的完全RPMI 1640培养液重悬细胞至2×106/mL。取常用规格的流式管,每管加入1000 μL细胞悬液(2×106个细胞)。将之室温条件下300 g离心5 min,收集细胞沉淀弃上清。将细胞以20% FBS的PBS缓冲液重悬,按照抗体说明书的要求在细胞悬液中加入FITC-抗Lin(CD3/14/16/19/20)抗体、PerCP-抗CD27抗体、BV650-抗CD138抗体、APC-抗CD38抗体、BV421-抗CD184(CXCR4)抗体和PE-抗CD284(TLR4)抗体(抗体均购自于BD公司),室温条件下避光孵育15 min。然后按照上述条件进行离心,利用PBS缓冲液重悬细胞,离心收集细胞。细胞经洗涤后用500 μL PBS重悬,然后进行流式细胞仪(BD FACSAriaTMFusion)上机分析。
1.2.2 免疫组织化学染色 对10%福尔马林固定和石蜡包埋的活检标本进行免疫组织化学染色。对每个标本,切5微米厚的连续切片,在75℃孵育60 min。切片在二甲苯中脱蜡,通过100%、95%和75%的分级酒精水合,用蒸馏水洗涤,然后进行过氧化物酶阻断和蛋白质阻断,切片5% BSA封闭液处理60 min, 主要抗体为小鼠抗人TLR-4单克隆抗体(分类号ab22048,英国剑桥Abcam)和兔抗人CXCR-4单克隆抗体(Abcam;ab124824),将针对TLR4、CXCR4的抗体分别稀释至1∶200和1∶500。在4℃与一抗孵育一夜后,PBS洗涤后利用第二抗体增强剂和二抗孵育30 min。用二氨基联苯胺(DAB)辅助显影。最后,切片放置于苏木素中孵育,并通过乙醇和二甲苯脱水,封片后利用多光谱病理分析系统进行分析观察。
1.3 统计学方法 实验数据用SPSS Statistics软件进行分析,进行数据统计之前检验两组之间符合正态分布,两组之间差异性比较采用“两独立样本t检验”方法,相关性分析采用“斯皮尔曼相关分析”方法,P<0.05时即证明两组存在统计学差异。作图用Prism软件和Adobe illustrator软件进行。
2 结果
2.1 天疱疮患者皮损部位和健康对照TLR4、CXCR4表达水平分析 免疫组织化学染色结果显示,天疱疮患者皮损部位TLR4、CXCR4表达水平明显高于对照组皮肤组织(图1)。就表达部位而言,对照组TLR4主要表达于皮肤组织表皮基底层(图1a),而天疱疮患者皮损部位TLR4主要表达于表皮基底层和基底层上,甚至表皮浅层(图1a);对照组CXCR4主要表达于皮肤组织表皮基底层(图1b),而天疱疮患者皮损部位CXCR4主要表达于表皮基底层和基底层上(图1b)。
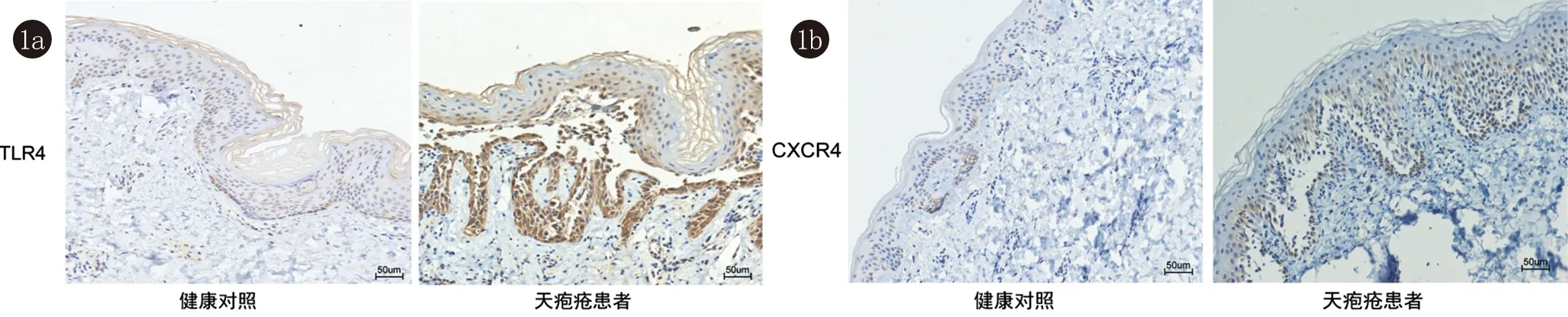
1a:天疱疮患者皮损部位TLR4表达水平明显高于对照组皮肤组织;1b:天疱疮患者皮损部位CXCR4表达水平明显高于对照组皮肤组织
2.2 天疱疮患者与健康对照外周循环中TLR4+CXCR4+浆细胞比例分析 我们先以Lin-CD27+进行圈门,然后收集CD38+CD138+浆细胞。分析显示,与健康人相比(1.38±0.89),天疱疮患者外周血PBMC中浆细胞(Lin-CD27+CD38+CD138+)的表达比例(3.26±1.90)增加,差异有统计学意义(P<0.05)(图2a、2b);然后我们在此基础上,进一步收集TLR4+CXCR4+双阳细胞,发现天疱疮患者浆细胞中TLR4+CXCR4+双阳细胞表达比例(14.23±8.69)与健康对照(6.74±2.95)相比增加,差异有统计学意义(P<0.05),见图2c、2d。
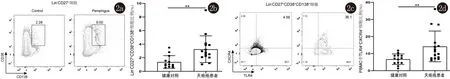
2a、2b:天疱疮患者外周血PBMC中浆细胞(Lin-CD27+CD38+CD138+)的表达比例增加,差异有统计学意义(P<0.05);2c、2d:天疱疮患者浆细胞中TLR4+CXCR4+双阳细胞表达比例增加,差异有统计学意义(P<0.05)
3 讨论
天疱疮是一种自身抗体导致的皮肤疾病,可在患者血清检测出Dsg1和Dsg3特异性自身抗体IgG,这些抗体由B淋巴细胞产生,是引起棘层细胞松解、皮肤、黏膜出现水疱的关键因素。B淋巴细胞的发育、分化与激活受多种因素的调控,例如B细胞激活因子(BAFF)、CD40-CD40L、B细胞表面受体信号等[8]。
TLRs是一类天然免疫受体,可直接识别结合病原相关分子模式,引起一系列信号转导,进而导致炎性介质的释放,并最终激活获得性免疫系统[9]。TLR4是人类发现的第一个TLR相关蛋白,几乎分布于所有的细胞系,主要表达在参与宿主防御功能的细胞上,如淋巴细胞。随着研究的不断深入,TLR4越来越多的生物学功能被发现,主要包括可诱导免疫炎性因子的合成和释放,引发炎症反应;促进免疫细胞膜表面表达相关免疫分子,加速免疫细胞的成熟和功能化,诱发特异性免疫;引发胞内杀菌机制并协助机体对病毒的清除;与其它TLRs分子协同作用,相互影响对病原相关分子模式的识别[10,11]。TLR4被证明是所有TLRs中最复杂的信号排列,激活MAL-MYD88通路来诱导NF-κB信号或者激活TRAM-TRIF通路来诱导IRF3信号[12]。一旦激活,TLR4可以上调炎性细胞因子和趋化因子,并参与一系列细胞内信号通路,以调节宿主炎症反应的性质、幅度或持续时间[13]。最近的研究表明,TLR4信号通路的过度激活与SLE和系统性红斑狼疮性肾炎的发生发展密切相关[14]。 伴侣分子(Gp96)转基因小鼠模型中TLR4信号的增加可以诱导狼疮样自身免疫性肾炎[15],说明TLR4信号的增加本身就是诱发自身免疫性疾病的充分和有效的触发因素。此外,TLR4基因缺陷的小鼠表现出边缘带B细胞和参与狼疮疾病发展的细胞因子均显著减少[16]。Sun等发现,天疱疮患者皮损部位TLR4表达显著增加[6]。
趋化因子是细胞因子超家族中一类具有趋向细胞定向移动的蛋白多肽,分为CXC、CX3C、CC、C等4类,作用于T细胞[17]和B细胞[18]。CXCR4是趋化因子CXCL12[chemokine (C-X-C motif)ligand 12,CXCL12]的受体,在体内包括T细胞和B细胞的多种细胞上广泛表达,属于G蛋白耦联受体超家族,是由352个氨基酸编码的高度保守的G蛋白偶联的7次跨膜蛋白受体,与HIV感染、癌症、造血干细胞的增殖、分化、归巢有关。CXCL12是CXCR4的唯一配体,CXCL12/CXCR4参与B细胞和骨髓细胞的生成[19],整合蛋白的激活与趋化作用[17],CXCL12/CXCR4通路能够促进树突细胞的成熟,并参与表皮树突细胞及朗格汉斯细胞向真皮迁移,从而启动相应的免疫应答[20-22],是一对与自身免疫反应和炎症反应有关的受体和配体。CXCR4在多种狼疮鼠模型中高表达,特别是在B细胞和浆细胞等细胞上的表达水平上调[23];CXCL12 在狼疮小鼠多种器官中的水平也升高[24];一些研究指出,CXCR4在几种自身免疫性疾病的炎症条件下,如多发性硬化症和类风湿性关节炎中发挥了白细胞趋化作用[25]。此外,在大疱性类天疱疮中,CXCL12与B细胞上CXCR4的结合通过上调转录因子c-Myc而导致B细胞分化和自身抗体的产生[1];CXCL12和CXCR4在大疱性类天疱疮皮损中呈阳性表达[26]。
Ma等进一步发现,SLE患者外周血中,TLR4+CXCR4+浆细胞比例显著升高。通过将系统性红斑狼疮小鼠体内TLR4+CXCR4+浆细胞转移至Rag2缺陷的小鼠中,促进了Rag2缺陷小鼠自身抗体的产生及肾小球性肾炎的发展,证实了TLR4+CXCR4+浆细胞在SLE发展中的关键作用[7]。本文的研究结果与上述研究相一致,我们发现不仅TLR4、CXCR4在天疱疮患者皮损部位表达水平显著增高,而且TLR4和CXCR4在天疱疮患者外周血单核细胞中数量显著增多。既往研究表明,TLR4-/-小鼠表现出Th1、IFNγ和Th17相关IL-17A和IL-6细胞因子产生的显著减少,抗dsDNA和抗RNP自身抗体水平均显著降低。TLR4-/-小鼠肾损伤减轻,肾小球免疫球蛋白和补体沉积减少[27];相反,TLR4过表达导致自身免疫性肾小球肾炎[15];同样地,在SLE中,CXCR4/CXCL12轴在致病PC迁移到炎症器官(如肾脏)中起着重要作用[23]。
众所周知,不同的自身免疫性疾病的病理机制存在较大区别。但天疱疮患者和类天疱疮患者皮损部位TLR4表达显著增加[7];表达增加后的TLR4可以上调炎症细胞因子和趋化因子[13]。在类天疱疮中,CXCL12可趋化表达CXCR4的T淋巴细胞,引起T淋巴细胞浸润,导致疱液形成[26],CXCL12/CXCR4轴通过上调转录因子c-Myc而导致B细胞分化和自身抗体的产生[1]。由此推之,TLR4和CXCR4可能在天疱疮中驱动B细胞的趋化和分化,从而促进自身抗体的产生,在天疱疮发病机制中起重要作用。

