改良体外膜氧合支持下行先天性气管狭窄矫治3 例
姚仕文,李 帅,丘新燕,许伟滨,孙善权
先天性气管狭窄(congenital tracheal stenosis,CTS)在临床上较为罕见,其表现为气管管腔结构狭窄阻塞。 单纯的先天性气管狭窄比较少见,占CTS发病率的10%~25%。 临床上常见的是合并有心血管畸形,约50%合并肺动脉吊带。 支气管镜和胸部CT 是诊断CTS 的主要手段;心肺转流(cardiopulmonary bypass, CPB)辅助下气管滑片成形手术是治疗气管狭窄的外科手术方式之一[1-2]。 体外膜氧合(extracorporeal membrane oxygenation,ECMO)作为可在一定时间内替代患者心肺功能的高级生命支持,常用于体外呼吸支持及心脏循环支持[3]。 现结合本科3 例CTS 患儿在改良ECMO 下气管滑片成形手术病例,将救治病例汇报如下。
1 资料与方法
1.1 病例介绍 患儿1,男,23 d,体重3.1 kg,因“呼吸困难2 d”由外院携带气管插管转入本院,入院后撤机困难,CT 提示气管及主支气管发育细小,考虑气道发育不良改变。 支气管镜提示声门下狭窄及主支气管狭窄。 术前诊断为CTS,卵圆孔未闭,新生儿呼吸窘迫综合征,新生儿肺炎,先天性甲状腺功能减退症,新生儿贫血,头皮血肿。 于2019 年12 月31 日在全麻改良ECMO 下行喉、气管成形术+气管外固定术。
患儿2,女,7 个月,体重7 kg,因“反复喘息半月余、痰鸣7 月余”入院,入院后CT 提示气管中下段狭窄,纤支镜提示气管狭窄(O 型软骨环),术前诊断CTS,双肺肺炎,T2 蝴蝶椎。 于2020 年1 月14 日在全麻改良ECMO 下行气管滑片成形+气管外固定术。
患儿3,男,1 岁5 月,体重7.6 kg,因“间断气促、喉鸣1 年余”入院,入院后CT 提示:无名动脉压迫综合征,气管中下段狭窄。 支气管镜提示气管狭窄(O 型软骨环)。 术前诊断为CTS,无名动脉压迫综合征,脑白质病,运动障碍,脐疝。 于2020 年3 月20 日在全麻改良ECMO 下行气管滑片成形+气管外固定术。
所有病例在入院后均行胸部CT+三维重建和气管镜检查以了解气管狭窄的长度及管腔内部的狭窄程度和气管软骨环的结构,同时了解气管是否有软化。 并根据气管狭窄的长度及管腔的内径进行分级。 见表1。

表1 患儿的气管情况及分级
1.2 治疗方法 采用离心泵泵头(Maquet RF-32)、膜式氧合器(泰尔茂CX*FX05RW)、婴儿型血管路套包(天津塑料研究所)、动脉插管(ZX 型)和静脉插管(直型,常州康心医疗)。 所有病例均经胸行升主动脉插管,经右心耳放置静脉插管。 半量肝素化(1.5 mg/kg)后,测活化凝血时间(activated clotting time, ACT)≥300 s,固定管路后启动离心泵达到1 500 rpm 以上松开管道钳开始转机。 温度维持在35℃,转中ACT 维持在180~200 s 充分游离暴露手术视野行气管滑片成形术,并予塑型聚左旋乳酸可吸收骨固定系统行气管外固定,术毕气管镜下观察气管通畅,无压迫变形,加压通气试验气管无漏气[4]。 彻底灌洗清理呼吸道后恢复通气,停止ECMO。 患儿的转流时间、呼吸机时间、住院时间见表2。
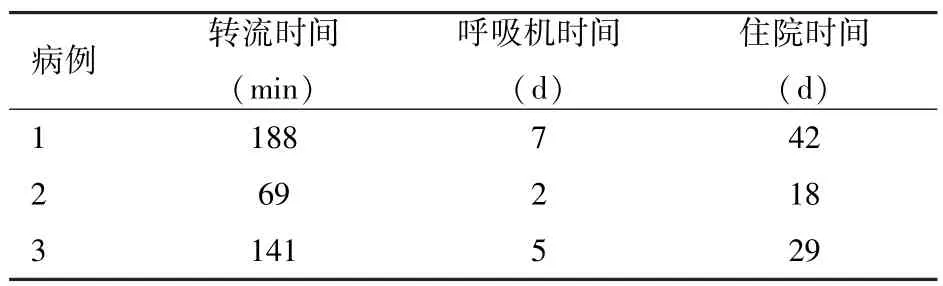
表2 患儿的转流时间、呼吸机时间和住院时间
2 结 果
3 例患儿手术均顺利完成,并安全撤离ECMO。气管镜显示气管管腔达到正常管径,术后进行呼吸机辅助通气、纤支镜灌洗治疗、抗感染及肺部体疗、雾化等对症治疗。 3 例患儿均恢复良好并顺利出院。随访病例1 患儿术后1 个月出现声门下隔膜,外院行声门上成形术,术后2 个月纤支镜提示:气管、隆突、左右主支气管肉芽增生;隆突、左右主支气管狭窄。 因治疗效果差,预后不良家属放弃再次手术治疗。 随访病例2 及病例3 患儿气管吻合口愈合良好,生长发育正常。
3 讨 论
CTS 是一种比较罕见的先天性疾病,常伴有反复呼吸道感染、呼吸窘迫、低氧血症和心功能不全,目前发病机制仍不清楚,常合并心血管或其他畸形。严重的CTS 外科手术是其首要的治疗方式,而术后最突出的并发症为肉芽组织增生及挛缩后再狭窄,治疗非常棘手。 为解决肉芽增生这一难题,Tsang 等在1989 年首次提出气管滑片成形手术[5]。 目前这种术式被认为是治疗气管狭窄的最佳治疗方案。 气管滑片成形术不需要其他耗材,有完整的软骨支撑,气管内壁有正常纤毛覆盖,从而减小了感染发生的风险,从根源上解决肉芽组织的形成。
近年来,气道狭窄手术也逐渐成为ECMO 的适应证[6]。 重度气管狭窄常表现为呼吸困难,由于气管管腔细小极易发生阻塞并造成窒息,常规的内科治疗和通气方法难以解决通气和氧合。 如何迅速开放气道和改善氧合往往成为治疗重度CTS 的关键。
目前,国内开展婴幼儿气管狭窄手术较少,气管手术为开放性污染手术,容易造成感染,而体外循环及血液回收极其容易造成二次血运感染。 为减少感染概率,本科在常规CPB 下行气管手术时,充分止血后,当切开气管时停止心内吸引和心外吸引,从而减少污染的血液回流至储血罐。 与CPB 相比,改良后的ECMO 能提供闭合循环管路,保证手术区域术野清晰的同时不使用血液回收,同时转流过程中无储血罐,避免血液长时间与空气接触,保证血液无菌,很大程度上避免感染发生。 另外,改良ECMO 避免开放型储血罐的使用,一定程度上减小了管路进气的危险性。 改良ECMO 提供稳定的血流动力学支持,与传统的CPB 对比只需微量肝素,可减少术中和术后出血的风险,同时减少潜在的肝功能和肾功能损害等并发症的风险[7]。 ECMO 使用离心泵头,血流平缓,减少血细胞的摩擦、管路挤压,与传统CPB 的滚压泵相比,能减少血液破坏。
ECMO 最初是为长期心肺支持设计,费用昂贵[8]。 改良后使用普通膜肺和管路可减低部分材料费用,仅需增加离心泵头的费用。
尽管改良ECMO 在此类手术中有这些优势,但依然有一定的局限性如:在开胸切开气管至吻合气管后的过程中,无法及时回收创口血液,只能另外使用血液收集装置等,在出血较多的情况下难以及时将血液回输,与CPB 相比具有一定局限性。

