体外循环术后患者来源的肠道菌群重建对肠黏膜损伤大鼠菌群特征和炎症反应的影响
伊小婷,范嘉宁,刁玉刚,孙莹杰
近些年来,不同疾病与肠道菌群之间的相关性得到了专家和学者们的广泛关注。 有研究表明,肠道菌群类别的改变能够影响结肠组织的发育,从而影响肠黏膜屏障的功能[1]。 肠黏膜屏障是机体阻挡非特异性感染的第一道防线,课题组前期的研究已证实心肺转流(cardiopulmonary bypass,CPB)可通过炎症反应、缺血再灌注损伤、氧化应激反应、细胞凋亡损伤等多种方式损伤肠黏膜屏障[2-3],引发肠损伤。 因此,CPB 所致肠损伤的机制是否与肠道菌群的紊乱相关尚有待研究,本实验拟对此进行评价。
1 材料与方法
1.1 材料 选择无特定病原体成年雄性标准差大鼠共30 只,体重为400~450 g。 按照随机数字表法将大鼠随机分为3 组:伪无菌大鼠组(S 组)、伪无菌大鼠+接种健康人源粪菌滤液组(N 组)和伪无菌大鼠+接种行CPB 下心脏瓣膜术后患者粪菌滤液组(C 组),每组分别为10 只。 第1 天至第14 天给予S 组、N 组和C 组大鼠由甲硝唑(250 mg/kg)、氨苄西林(250 mg/kg)、硫酸新霉素(250 mg/kg)混合配制而成的抗生素鸡尾酒胃管灌胃处理,每天2 次,每次2 ml;第15 天至第28 天N 组、C 组分别接受来自健康人源和行CPB 下心脏瓣膜术后患者源的粪菌移植,每天1 次。
1.2 制作粪菌悬液 将-80℃保存的粪便取出称重,按1 ∶10 的比例加入无菌生理盐水(1 g 粪便加入10 ml 生理盐水),置于50 ml 的小烧杯内,密封,放置于磁力搅拌器上搅拌15 min,离心管收集混悬液,标记滤液体积,将混悬液4℃下离心10 min,上清液即为粪菌悬液。
1.3 粪菌移植 粪菌移植之前禁食6 h,大鼠取俯卧位,搔刮法尽量排空直肠内留存粪便,在内径2 mm 塑料软管表面涂抹无菌生理盐水润滑后轻柔置入结肠,至软管顶端距离肛门约8 mm,缓慢注入粪菌液500 μl,轻柔拔出软管后用无菌纱布或棉签压住肛门几秒钟,执鼠尾使大鼠保持头低脚高姿态约1 min 后放回笼中,1 次/d,连续14 d。
1.4 检测指标 建模成功后,粪菌移植14 d 后,收集各组大鼠粪便,每只大鼠取3 粒粪便贮存于-80℃冰箱供宏基因组学测序;脊椎脱臼法处死大鼠,无菌取静脉血、离心,血清供酶联免疫吸附(Elisa)检测;取结肠组织置于4%多聚甲醛溶液贮存,以备光学显微镜下观察;另取部分结肠组织-80℃保存,蛋白免疫印迹(Westernblot)法检测紧密连接蛋白(zonula occludin-1,ZO-1)、闭合蛋白(occludin)的表达水平。
宏基因组学测序是对微生物群体进行高通量测序,分析特定环境中微生物群体基因组成及功能、微生物群体的多样性与丰度,进而分析微生物与环境、微生物与宿主之间的关系,发现具有特定功能的基因。 具体方法如下:①DNA 提取:(a)粪便样本加入裂解液,混匀;(b)离心取上清,加酚∶氯仿∶异戊醇(25 ∶24 ∶1),混匀,离心;(c)取上清,加氯仿∶异戊醇(24 ∶1),混匀,离心;(d)取上清,加入异丙醇,摇晃,沉淀;(e)离心后用75%乙醇洗涤2 次,吹干;(f)加入蒸馏水溶解DNA 样品;(g)加入RNaseA加速溶剂消化RNA,37℃下放置。 ②DNA 检测:琼脂糖凝胶电泳分析DNA 的纯度和完整性。 ③文库构建及质检。 ④上机测序。 ⑤下机质控。 ⑥信息分析:(a)数据质控;(b)去除宿主;(c)物种注释;(d)常用功能数据库注释;(e)丰度聚类分析;(f)抗性基因注释;(g)高级功能注释。 ⑦测序数据处理:(a)去除接头序列;(b)扫描序列;(c)去除最终长度小于50 bp 的序列。
1.5 HE 染色 取结肠组织置于4%多聚甲醛中固定,盐酸缓冲液冲洗,酒精脱水过夜,蜡块包埋后切片,HE 染色、反兰,中性树胶封片,置于光学显微镜下观察结肠组织病理学的改变。
1.6 Elisa 检测 ①标准品的稀释;②加样;③温育;④配液;⑤洗涤;⑥加酶;⑦温育;⑧洗涤;⑨显色;⑩终止;○1 测定。
1.7 Westernblot 法检测 将结肠组织称重、研磨、匀浆、离心,取上清液;煮沸;配置浓缩胶、分离胶,加入样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳;舍去胶放入缓冲液,摇匀;利用滤纸、聚偏二氟乙烯蛋白印迹膜,制作夹膜,转膜1 h;洗膜;洗膜后加入ZO-1 兔抗鼠多克隆抗体,occludin 兔抗鼠多克隆抗体,摇床孵育1 h;洗膜后加入羊抗兔免疫球蛋白IgG 多克隆抗体,放入摇床1 h;漂洗,通过电化学发光系统显影,进而分析免疫印迹灰度值,以磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)作为内参,以目的蛋白条带灰度值与GAPDH 条带灰度值的比值反映目的蛋白的表达水平。
1.8 统计方法 采用SPSS 25.0 统计软件处理,正态分布计量资料以均数±标准差(±s)表示,两亚组设计的实验结果分析采用独立样本t检验,多组设计的实验结果分析采用单因素方差分析,最小显著差别法进行两两比较,肠道菌群宏基因测序结果采用Student's t 检验测量两组间的差异,利用乘积矩系数进行相关分析,P<0.05 为差异有统计学意义。
2 结 果
2.1 大鼠肠道菌群宏基因组学测序结果 各组大鼠肠道菌群的聚类分析:S 组、C 组和N 组各自聚集,分区良好,提示各组大鼠种植的肠道菌群组成存在明显差异。 见图1、2。

图1 各组大鼠肠道菌群的主坐标分析
2.2 各组大鼠肠道菌群的组成及差异显著性分析S 组、C 组和N 组肠道菌群组成在属水平上的相对丰度如图3 所示,克雷伯菌属(Klebsiella)、阿克曼菌属(Akkermansia)、普雷沃菌属(Prevotella)和乳杆菌属(Lactobacillus)的表达在三组中均有明显差异。 与S 组比较,C 组和N 组克雷伯菌属的相对丰度明显减低(P<0.05),而C 组和N 组间无明显差异(P>0.05);与S 组比较,C 组阿克曼菌属、普雷沃菌属的相对丰度明显增加(P<0.05),而N 组和S 组间无明显差异(P>0.05);与S 组比较,N 组乳杆菌属的相对丰度明显增加(P<0.05),而C 组和S组间无明显差异(P>0.05)。 见图3。
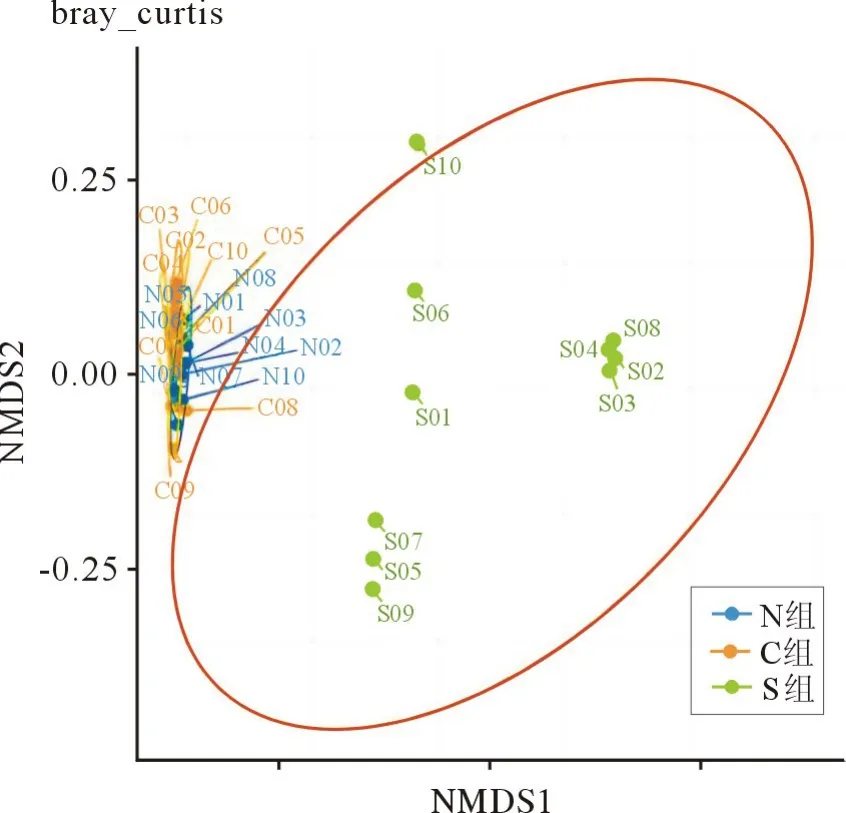
图2 各组大鼠肠道菌群的非度量多维尺度分析
S 组、C 组和N 组肠道菌群组成在种水平上的相对丰度如图4 所示,肺炎克雷伯杆菌(Klebsiella_pneumoniae)、嗜黏蛋白-艾克曼菌(Akkermansia_muciniphila)和地中海-玛斯里菌(Mediterranea_massiliensis)的表达在三组中均有明显差异。 与S组比较,C 组和N 组肺炎克雷伯杆菌的相对丰度明显减低(P<0.05),而C 组和N 组间无明显差异(P>0.05);与S 组比较,C 组嗜黏蛋白-艾克曼菌的相对丰度明显增加(P<0.05),而N 组和S 组间无明显差异(P>0.05);与S 组比较,N 组地中海-玛斯里菌的相对丰度明显增加(P<0.05),而C 组和S组间无明显差异(P>0.05)。 见图4。
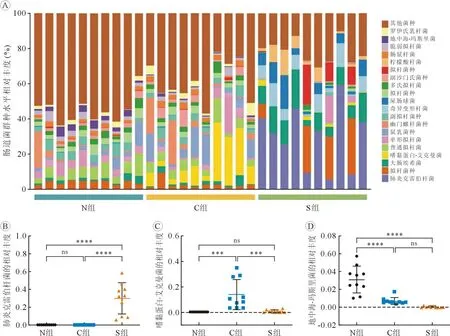
图4 各组大鼠肠道菌群在种水平上的变化分布图
2.3 各组大鼠结肠病理学变化 S 组出现不同程度的损伤表现,绒毛缩短、肠黏膜水肿,细胞大量缺失并呈空泡样变性;C 组肠黏膜层受损变短,核固缩、核深染增多;N 组黏膜层增厚,细胞形态规整,可见大量正常细胞,见图5。
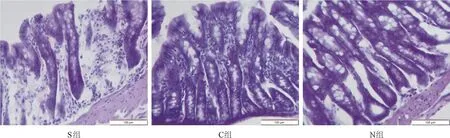
图5 各组大鼠结肠病理学变化(HE×200)
2.4 各组炎性介质浓度比较 与S 组比较,C 组和N 组大鼠血清IL-1β、IL-6 和TNF-α 的浓度均减低(P<0.05);与C 组比较,N 组大鼠术后7 d 血清IL-1β、IL-6 和TNF-α 的浓度明显减低(P<0.05),见图6。
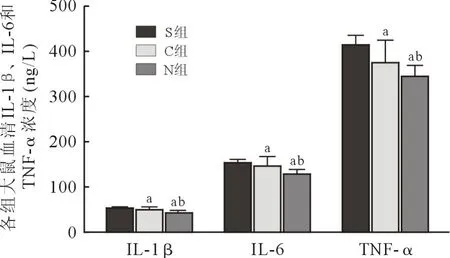
图6 各组炎性因子浓度的比较
2.5 各组免疫蛋白表达 与S 组比较,C 组和N组大鼠肠组织ZO-1、occludin 表达水平上调(P<0.05);与C 组比较,N 组大鼠肠组织ZO-1、occludin表达水平均上调(P<0.05),见图7。
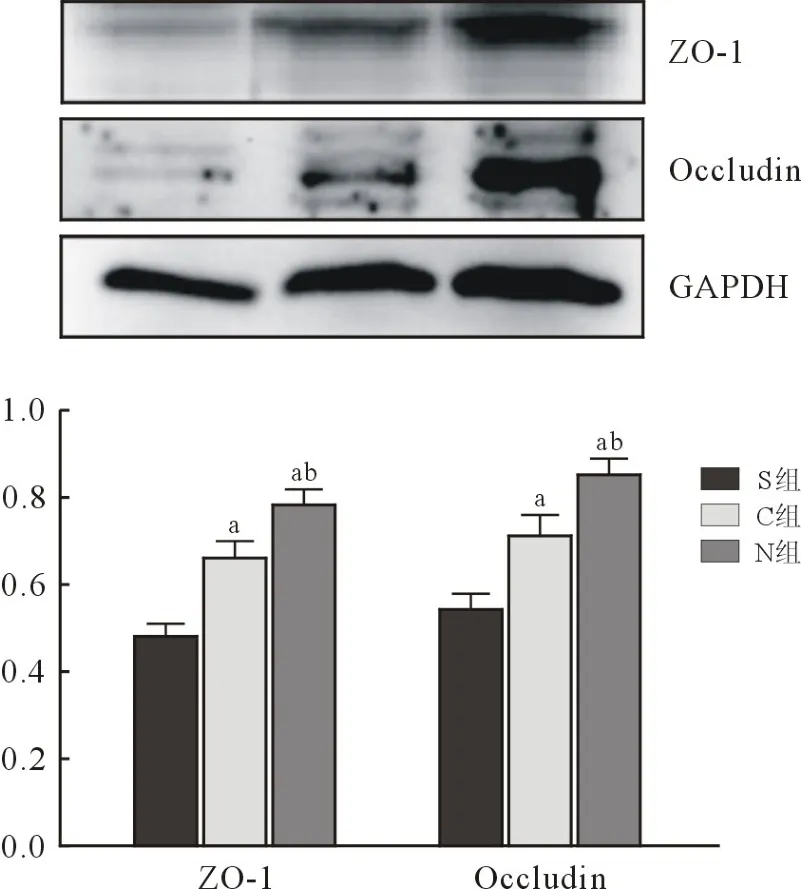
图7 各组大鼠ZO-1、occludin 蛋白的表达
2.6 大鼠差异性肠道菌群与炎症反应严重程度的相关性分析 炎症反应的严重程度与血清炎性因子IL-1β、IL-6 和TNF-α 的水平成正相关,故将三组大鼠的肠道菌群表达丰度测得的IL-1β、IL-6 和TNF-α 的水平进行相关性分析,研究结果提示普雷沃菌属、副沙门氏菌属、肠杆菌属、阿克曼菌属、肠球菌属和拟杆菌属与炎症反应的严重程度成正相关(r=0.21,P<0.05),而狄氏副拟杆菌属、乳杆菌属与炎症反应的严重程度成负相关(r =-0.58,P<0.05)。
3 讨 论
鉴于人类在体实验的局限性,限制了相关的检测和机制研究,因此可将人类菌群通过粪菌移植(fecal microbiota transplants,FMT)的方法移植到动物模型上。 FMT 是指将功能菌群移植到受体的消化道中,通过重建受体的肠道菌群达到研究或治疗的目的[4],目前已成为研究肠道菌群与宿主关系的重要手段。 其优势在于人类的肠道菌群可通过该技术定植在无菌/伪无菌大鼠的消化道中,使实验动物的肠道菌群与人类更相近,实验结果与人类更具相关性。
课题组前期实验研究发现,CPB 后的大鼠肠黏膜层缩短变薄,绒毛的上皮细胞有不同程度的变形、核固缩、核坏死,固有层存在炎性细胞浸润以及充血水肿,证实CPB 可损伤大鼠的肠黏膜屏障[5]。 肠屏障损伤后可致大量毒性产物及促炎细胞因子的释放,进而诱发全身炎症反应综合征以及多器官功能障碍综合征,同时全身炎症反应也是CPB 促发肠损伤的相关机制之一。
已有研究表明,肠道菌群的改变与炎症反应息息相关,特定的肠道细菌及其代谢产物可发挥促炎或抑制炎症反应的作用,进而引发肠屏障功能的改变[6]。 此外,肠屏障功能的稳定性还有赖于肠上皮细胞间的特定连接方式,即ZO-1 和occludin 蛋白的表达。 它们是肠上皮细胞之间相互连接的骨架结构,构成了肠黏膜组织的第一道防线,可防止大分子物质在细胞间隙之间任意进出,维持肠黏膜上皮的稳定性,保护肠屏障功能的完整性。 本研究发现,当肠道菌群作为干预因素时,伪无菌组大鼠血清的IL-1β、IL-6 和TNF-α 表达水平最高,炎性反应最明显,肠组织ZO-1、occludin 的表达水平最低;与伪无菌大鼠比较,接受CPB 术后患者菌群移植的大鼠血清炎性因子表达有所减低,ZO-1、occludin 蛋白的表达水平均增加;而接受健康人菌群移植的大鼠血清炎性因子表达水平最低,ZO-1、occludin 蛋白的表达水平最高。 各组大鼠肠道菌群的组成及差异显著性分析,炎症反应的严重程度可能与普雷沃菌属、阿克曼菌属的相对丰度增加,肺炎克雷伯菌的相对丰度减低有关。 现有研究表明,普雷沃菌属具有较强的炎性特性,能刺激肠上皮细胞产生IL-8、IL-6 等炎性因子,从而介导黏膜炎症反应的发生,提示某些普雷沃菌株可能为临床上重要的致病菌,可通过促进慢性炎症参与人类的相关疾病[7]。 而阿克曼菌属一般被认为是益生菌,可以降解肠黏膜的黏蛋白,降低肥胖、Ⅱ型糖尿病的发病率。 然而,最新研究发现在高糖饮食的小鼠体内阿克曼菌属的相对丰度过高,结肠组织黏膜层变薄,肠屏障功能受损,导致结肠炎的诱发和恶化[8]。 而本研究中,普雷沃菌属和阿克曼菌属均为炎症水平升高组中的特征性肠道菌群,提示肠道菌群确实可参与炎症反应的发生和发展,进而导致肠黏膜屏障损伤,且不同的特征性肠道菌群可发挥不同的促炎作用。
综上所述,CPB 后肠道菌群的改变所引起的炎症级联反应是导致肠屏障功能损害的机制之一。 这可能是因为普雷沃菌属和阿克曼菌属的相对丰度增加,促进了有毒产物和炎性细胞因子的产生,损伤了肠屏障,进而引发肠损伤。

