pH响应型双氯芬酸钠介孔二氧化硅纳米给药体系的制备及评价
巫业振,季麒麟,季飞龙,叶熊龙,袁 帅,王 秀
(蚌埠医学院药学院,安徽 蚌埠 233030)
双氯芬酸钠(diclofenac sodium,DS)是一种苯乙酸衍生物,非甾体抗炎止痛剂,应用于类风湿性关节炎、退行性关节疾病、强直性脊柱炎和相关疾病,以及用于治疗小手术、创伤和痛经引起的疼痛[1]。证据表明口服双氯芬酸钠会增加严重的胃肠和心血管风险。因此,考虑到类风湿关节炎是老年人群最常见的关节疾病,对于老年人以及患有胃肠道、心血管和肾脏合并症的人群,外用双氯芬酸钠可能比口服双氯芬酸钠对RA的治疗效果更好[2]。
近几十年来,关节内给药系统受到越来越多的关注。人们尝试使用纯药物制剂,通过药物在炎症部位最大限度的暴露,从而更好得发挥药物在注射部位的局部抗炎作用。然而由于药物从关节中被迅速清除,关节内注射未能产生显著效果。纳米载体可延长药物半衰期,提高有效药物浓度时间,提高药效,降低用药频率,提高患者顺应性,降低毒副作用[3-5]。介孔二氧化硅纳米颗粒(mesoporous silica nanoparticles,MSN)是一种形态优越、骨架稳定、强度出色的介孔材料,在纳米载药系统中发挥着重大作用[6-8]。聚多巴胺(polydopamine,PDA)以其能强力附着于任何类型的底物的特点,广泛应用于材料的表层涂布中[9],且研究证明PDA具有pH响应性,可在酸性条件下解离,可以作为纳米载体pH响应性门控,应用于药物在pH为酸性的炎症环境下集中释放。
在本研究中我们尝试用MSN负载DS,并用PDA包覆MSN作为介孔的封端,制备出纳米载药粒子MSN-DS@PDA。通过透射电子显微镜(TEM)、X-射线衍射(XRD)、N2吸附-脱附、FT-IR光谱、差热-热重分析仪(TG-DTA)对纳米粒子进行表征分析,并探究纳米粒子在体外不同pH环境下的释药情况。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 双氯芬酸钠、十六烷基三甲基氯化铵、正硅酸乙酯、三乙醇胺、无水乙醇、浓盐酸、盐酸多巴胺、Tris-HCl缓冲液,以上试剂均购自上海麦克林。
1.1.2 仪器 ZNCL-GS智能磁力搅拌器(上海予申仪器有限公司);5424R离心机(艾本德生命科学公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);UV-3600紫外分光光谱仪(岛津公司);JEM-2100F透射电子显微镜(日本电子公司);STA 449F3同步热分析仪(德国耐驰仪器制造有限公司);JB-BK200B比表面积和孔径分析仪(精微高博公司);IS50 红外分光光谱仪(赛默飞世尔科技公司)。
1.2 MSN-DS@PDA的制备
1.2.1 MSN的制备 按照文献[10]的方法合成了二氧化硅纳米颗粒。将CTAC(0.5 g)、TEA(0.06 g)和去离子水(20 mL)混合,95 ℃油浴,搅拌1 h。TEOS(1.5 mL)逐滴加入上述混合物中,滴加完毕后继续搅拌1 h后,冷却至室温,离心收集,沉淀用乙醇离心洗涤3次。为了完全去除致孔模板(CTAC),将醇洗后的沉淀在酸性乙醇溶液中60 ℃冷凝回流4 h,离心收集,乙醇洗涤两次。同样的提取工艺重复两次。离心后的沉淀冷冻干燥24 h,最终得到白色粉末MSN。
1.2.2 DS的负载及载药量的测定 采用浸渍离心法[11],取30 mg MSN 3份,加入10 mL含不同浓度DS的水溶液中,使载体与药物的质量比分别为4∶1、6∶1、8∶1,水浴超声至MSN完全分散,室温下搅拌24 h后,离心收集上清液,沉淀去离子水洗涤两次,洗涤液与上清液合并用于载药量和包封率的测定。沉淀冷冻干燥后备用,记为MSN-DS。
DS标准曲线的建立:精密称定DS对照品,制备浓度为160 μg/mL的储备液,从中吸取0.063 mL、0.125 mL、0.25 mL、0.5 mL、1 mL于10 mL 容量瓶中,用去离子水稀释并定容至刻度,配制成1.008 μg/mL、2.000 μg/mL、4.000 μg/mL、8.000 μg/mL、16.000 μg/mL一系列浓度对照液。以去离子水为参比在 276 nm 波长下测定吸光度 A,以浓度C为横坐标,吸光度A为纵坐标,建立标准曲线。试验结果表明DS 在1~16 μg/mL范围线性关系良好,回归方程为A=0.0244C+0.0188(R2=0.9997)。
负载率的计算:取合并液适量,0.45 μm微孔滤膜过滤,用去离子水稀释至适宜浓度,在276 nm波长处,紫外分光光度法测定其吸光度,代入标准曲线方程计算DS浓度,求出合并液中DS的含量记为W1, MSN-DS称重记为W2,初始DS投入量记为W3。载药量(EE)及包封率(LE)分别按公式(1)、(2)计算。
1.2.3 PDA的包覆 将100 mg MSN-DS、50 mg盐酸多巴胺加入50 mL Tris-HCl缓冲液中(pH 8.5,0.01 M),室温下接触空气旋转孵育4 h后,将样品放入离心机在12 000 g的条件下离心10 min,分离离心后的沉淀用去离子水洗涤两次,最终产物冷冻干燥24 h,记为MSN-DS@PDA。
1.3 MSN-DS@PDA的表征分析
1.3.1 MSN-DS@PDA的TEM分析及粒径测定 为了观察到MSN和MSN-DS@PDA 的微观形貌及孔道形态,进行了透射电子显微镜分析。加速电压为 220 V,把样品粉末通过超声波振荡分散在乙醇中,再将其滴在铜网上,待干燥成膜后,对电镜照片进行观察分析。将MSN和MSN-DS@PDA分散于水中,配制成1 mg/mL的悬液,超声至纳米颗粒完全分散,马尔文粒径电位仪测定粒径。
1.3.2 MSN-DS@PDA的比表面积及孔径分析 称取样品适量,采用比表面积和孔隙度分析仪对包覆PDA前后的MSN在测试温度为77 K条件下进行N2吸附-脱附实验,绘制吸附脱附等温曲线,并通过孔径分布(Barrett-Joyner-Halenda,BJH)法计算孔径和孔容,多分子层吸附理论方程 (Brunauer-Emmett-Teller,BET)计算比表面积。通过对比包覆PDA前后等温线、孔径分布、孔容大小以及比表面积的变化更加直观的分析PDA的包覆情况。
1.3.3 MSN-DS@PDA的傅里叶变换红外光谱(Fourier transform infrared spectrum,FT-IR)光谱分析 在配置的红外灯干燥箱内取约200 mg干燥的溴化钾将其用玛瑙乳钵研磨成粉末,再加入干燥的样品大约2 mg进行研磨,保证溴化钾和样品粉末混合均匀,然后将混合后的样品装入压片模具中将其制成一个透明的薄片,而后插入样品池进行分析。测试条件为分辨率2/cm,扫描次数为16次,波长范围为4 000~400/cm。
1.3.4 MSN@PDA的热稳定性分析 采用差热-热重分析仪对MSN及MSN@PDA的热稳定性进行分析,使用气氛为N2,温度范围为室温-800 ℃,升温速率为10 ℃/min,流量为30 mL/min。
1.3.5 MSN-DS@PDA的小角度X射线衍射分析 使用小角度X射线衍射(X-ray diffraction,XRD)分析之前制备的MSN。将MSN充分研磨成粉末状,使用仪器进行测量。XRD预设参数如下:Cu Kaλ=0.154 08 nm,管压40 kV,管流40 mA,狭缝系统为DS 0.1°、SS 0.1°、RS 0.15 mm,连续扫描方式,步长0.02°,扫描速率为0.5°/min,扫描范围0.5°~10°。
1.4 MSN-DS@PDA在不同pH值缓冲液中的释药性考察分别取一定量的三组样品,每组平行三份,每份约8 mg,精密称定。在2 mL PBS中超声至均匀分散后,转移至透析袋(截断分子量3 500)。透析袋浸泡在18 mL的PBS(pH为5.0、6.0、7.4)中,调整转速为200 RPM。于0.5 h、1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h、36 h、48 h 取待测样品 1 mL,同时迅速补加同等体积溶出介质,待测样品经0.45 μm微孔滤膜过滤后,紫外分光光度法测定DS含量,并计算出累积释放度。
1.5 统计学方法所有实验数据用SPSS 23.0软件包处理,定量资料数据以“均数±标准差” 表示。
2 结果
2.1 MSN-DS@PDA的表征分析结果
2.1.1 MSN-DS@PDA的TEM实验结果 MSN和MSN-DS@PDA的透射电子显微镜的照片如图1所示。从图1中可以看出 MSN 清晰的介孔结构且分散性良好,PDA包覆后可以看到MSN的表面覆盖了一层薄膜,介孔结构被掩盖,表明PDA的成功包覆。MSN的粒径为(60.46±3.10)nm,MSN@PDA粒径为(70.23±5.12) nm,粒径分布较为均一。DLS所测MSN的粒径为(114.21±6.78)nm,MSN@PDA粒径为(124.3±8.12) nm,这是因为DLS测的是粒子的水合粒径,比实际偏大。

图1 MSN和MSN-DS@PDA的TEM照片及DLS分析结果
2.1.2 MSN-DS@PDA的比表面积及孔径分析结果 MSN和MSN-DS@PDA的N2吸附-脱附等温曲线见图2。从图2可以看出包覆PDA前的MSN在相对压力较小的情况下,进行吸附量上升较为缓慢的单分子层吸附,单分子层的吸附量达到饱和后,随着相对压力的增加,吸附量进行多层吸附,且由于毛细管冷凝的原因,压力增加时吸附量上升很陡,此类吸附等温线为Ⅳ型等温曲线[12],属于典型的介孔吸附等温曲线。此外,由于发生毛细管凝聚,导致滞后现象的产生,即脱附等温线与吸附等温线不重合,脱附等温线滞后于吸附等温线,当相对压力降至 0.8 P/P0以下时,两条曲线再次重合,形成滞后环[13]。在包覆PDA后脱附滞后现象明显减弱,其在相同压力下,对氮气的吸附量明显减少,这是由于MSN的孔隙被覆盖,比表面积减少而造成的,证明PDA的成功包覆。

图2 包覆PDA前后MSN的N2吸附-脱附等温线图
通过BET法和BJH法对包覆PDA前后MSN的平均比表面积、孔容和孔径进行计算,分析结果如表1所示,包覆PDA后的MSN比表面积和孔容均呈现明显的下降趋势,比表面积降低为原来的27.38%,孔容下降到了原来的 22.17%,孔径从原来的2.992 nm下降到2.250 nm。以上证明了PDA成功包覆到MSN上。

表1 包覆PDA前后 MSN 的 N2 吸附-脱附分析
2.1.3 MSN@PDA的傅立叶变换红外光谱(FT-IR)光谱分析结果 如图3所示,MSN和MSN@PDA在1 046.7/cm和959.4/cm处都有吸收峰,这是由Si-O-Si伸缩振动引起的,证明了SiO2网络结构的形成。MSN的FT-IR光谱在3 300/cm附近有一个宽的吸收带,对应于硅醇基[14]。涂覆PDA后,出现了几个新的吸收信号,在1 400/cm处苯骨架振动吸收带的存在为PDA在MSN上的聚合提供了证据,在3 450/cm处的宽吸收是由于PDA的氨基掩盖了硅醇基的峰所致[15]。

图3 包覆PDA前后MSN的 FT-IR 光谱
2.1.4 MSN@PDA的热稳定性分析 MSN和MSN@PDA的差热-热重曲线如图 4所示,MSN的失重率为18.27%,在温度为100 ℃时,有约10%失重,对应MSN中的水分子,其余失重约8%,对应MSN中的一些残留表面活性剂[16];MSN@PDA的失重率为23.02%,由此得出PDA的包覆率约为4.75%。
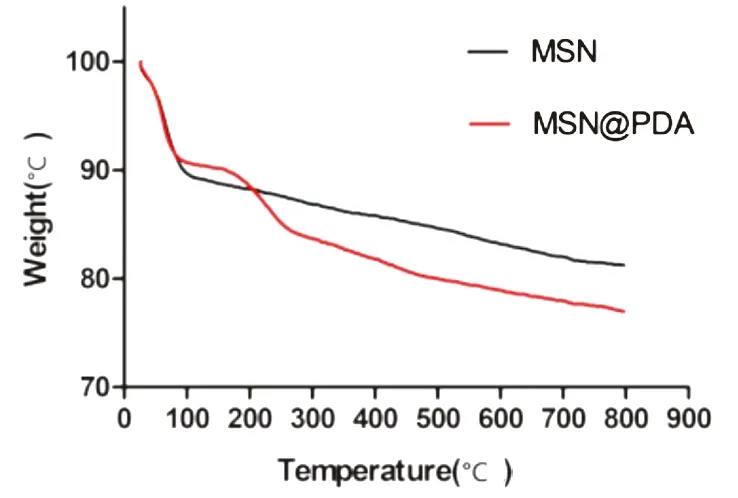
图4 包覆PDA前后MSN的热重曲线
2.1.5 MSN的X射线小角粉末衍射(XRD)分析 MSN的XRD结果如图5所示。强烈的衍射峰伴随着两个微弱的衍射峰,与空间群为p6 mm的100、110和200的六角形对称反射相关联,这表明它是一个类似有序的六角形介观结构[10]。

图5 MSN的X射线小角粉末衍射图
2.2 MSN-DS负载率的测定DS在水溶液中标准曲线结果,在1~16 μg/mL 范围线性关系良好,回归方程为 A=0.024 4 C+0.018 8(R2=0.999 7)。载体与药物的质量比为4∶1、6∶1、8∶1的载药量和包封率如表2所示,其中载体药物的质量比为6∶1时载药量和包封率最佳,载药量为(6.46±0.13)%,包封率为(45.68±0.72)%。

表2 不同质量比MSN-DS的载药量及包封率
2.3 MSN-DS@PDA在体外不同pH值缓冲液中释放结果DS在不同pH下的累计释放曲线如图6所示,MSN-DS@PDA在pH=7.4的PBS溶液中释药缓慢,2 d内的释放率仅为(23.05±1.96)%,随着pH的降低,DS的释放度增加,在pH 5.0的PBS溶液中2 d内的释放率为(50.28±2.55)%。MSN-DS@PDA在pH=5.0的PBS溶液中的释放率更高,有利于药物在微环境酸性的炎症部位集中释放,延长DS的作用时间和作用效果,减少给药次数,提高疗效,利于纳米载药颗粒的关节内注射。

图6 MSN-DS@PDA不同pH的PBS 中的释放曲线
3 讨论
MSN是一种优秀的载体,具有良好的生物相容性,其孔道结构可以高效负载药物,并能使药物在指定部位缓慢释放,延长药物的作用时间,降低药物的毒性,临床治疗中能有效降低给药次数及对患者身体的损伤。其可修饰的表面,也为其在制剂领域提供了更多的可能。PDA作为一种包衣材料,可以在一定条件下附着在任意固体材料的表面,更多的是用于肿瘤的光热治疗,而在本实验中我们选取的是它在酸性条件下可以解离的性质,作为pH响应的门控,达到靶向释放药物的目的。
本课题通过将DS加载到MSN中并对MSN进行PDA包覆,筛选出了能高效负载DS的方法,对PDA包覆前后的MSN进行表征测试,通过TEM观察到MSN的粒径大小均一,表面能看到清晰的孔隙结构,粒径在60.46 nm左右,PDA包覆后可以看到MSN表面有一层清晰的薄层,MSN的表面孔隙被覆盖,粒径在70.23 nm左右。并通过X-射线衍射,证明了MSN的六角形介孔结构,N2吸附-脱附,展示了MSN包覆PDA前后的吸脱附曲线及表面积和孔容变化。差热-热重分析显示PDA的包覆量为4.75%,FT-IR检测MSN及MSN@PDA在1 046.7,959.4/cm处有吸收峰,证明了SiO2交联网状结构的存在,MSN@PDA在1 400 cm处苯骨架振动吸收带的存在和3 450/cm处的宽峰证明了PDA的包覆,以上一系列表征实验验证了MSN@PDA的成功制备,通过筛选载体和药物的投药比,确定了MSN与DS质量比为6∶1时的载药效率最高,通过MSN-DS@PDA在体外不同pH磷酸缓冲液中释放研究,证明了PDA可以在酸性pH条件下解离,载体中的DS得以释放,实现载药颗粒在微环境为酸性的炎症部位集中释放,利用MSN的孔道结构实现DS的保护,提高DS在体内的稳定性,并通过MSN的缓释效应延长DS的作用时间,减少给药次数,提高生物利用度,为关节腔内注射治疗关节炎提供新的方案,这种载体的构建也为其他微环境为酸性的疾病提供新的治疗选择。

