姜黄素通过Nrf2/HO-1通路抑制高糖诱导的Neuro-2a细胞铁死亡的作用
王艳, 孙照阳, 任欣会, 赵志刚
糖尿病神经病变(diabetic neuropathy, DN)是一种糖尿病的慢性微血管并发症,表现为肢体感觉异常、四肢远端麻木甚至疼痛等症状,分为糖尿病中枢神经系统病变和糖尿病周围神经病变等[1-2]。DN影响全球50%~60%的糖尿病患者[3],如得不到有效控制,可导致糖尿病足发生,影响患者的生活质量和身心健康。目前唯一能预防和缓解DN的措施是控制血糖[4]。神经细胞损伤是DN的重要发病机制之一。铁死亡(ferroptosis)是一种新发现的、由铁依赖性脂质过氧化累积引起的调节性细胞死亡,在遗传、生化和形态上不同于细胞凋亡、细胞坏死性凋亡和细胞焦亡,其发生与核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2, Nrf2)/血红素加氧酶1(heme oxygenase-1, HO-1)通路密切相关[5]。铁死亡在糖尿病和糖尿病并发症的发生、发展中发挥重要的调控作用[6-7]。从姜黄科姜黄属植物(CurcumalongaL.)的根状茎中分离得到的姜黄素(curcumin, Cur)可通过控制炎症、氧化应激损伤和神经细胞凋亡等途径抑制DN的进展[8-9]。本研究拟从铁死亡的角度,观察Cur对高糖诱导的Neuro-2a(N2a)小鼠脑神经瘤细胞铁死亡的抑制作用和其与Nrf2/HO-1通路的关系,探讨Cur抑制DN的可能作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞和细胞培养 N2a细胞购自国家模式与特色实验细胞资源库。细胞复苏后置于含有10%胎牛血清和1%双抗(青霉素100 U/mL,链霉素100 μg/mL)的MEM培养基(添加NaHCO31.5 g/L,丙酮酸钠 0.11 g/L)及体积分数为0.05的CO2培养箱中37 ℃培养。
1.1.2 主要试剂 Cur(C110685)和Nrf2抑制剂(ML385,M304758)(上海阿拉丁生化科技股份有限公司);铁死亡抑制剂(ferrostatin-1,Fer-1,HY-100579,美国MedChemExpress公司);CCK-8检测试剂盒(L20356)、蛋白裂解液(P2213B)、PBS(W002358)和Western-blot试剂盒(W25681)(武汉灵思生物技术有限公司);TRIzol(15596026,美国Invitrogen公司);All-in-OneTMFirst-Strand cDNA Synthesis Kit(QP076,广州易锦生物技术有限公司);qPCR SYBR Green Master Mix(GK20308,上海捷瑞生物工程有限公司);乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒(A020-2-2)、还原型谷胱甘肽(glutathione, GSH)测定试剂盒(A006-1-1)、丙二醛(malondialdehyde, MDA)测定试剂盒(A003-1-2)和总超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(A001-3-2)等生化检测试剂盒(南京建成生物工程研究所有限公司);细胞核蛋白与细胞浆蛋白抽提试剂盒(P0027,上海碧云天生物技术有限公司);铁离子浓度检测试剂盒(ab83366)、兔抗谷胱甘肽过氧化酶4(glutathione peroxidase 4, GPX4)抗体(ab125066)、兔抗铁蛋白重链多肽1(ferritin heavy chain 1, FTH-1)抗体(ab65080)、兔抗转铁蛋白受体1(transferrin receptor 1,TFR-1)抗体(ab269513)(英国Abcam公司);兔抗溶质载体家族7成员11(solute carrier family 7 member 11, SLC7A11)抗体(26864-1-AP)、兔Nrf2抗体(80593-1-RR)、兔HO-1抗体(10701-1-AP)、兔抗核纤层蛋白B1(nuclear lamina protein B1,Lamin B1)抗体(12987-1-AP)和兔抗GAPDH抗体(60004-1-Ig)(武汉Proteintech公司)。qRT-PCR引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 引物序列
1.1.3 主要仪器 CO2培养箱(CelCulture,新加坡Esco公司);荧光定量PCR仪(CFX96,美国BIO-RAD公司);全波长酶标仪(Multiskan SkyHigh,美国Thermo Fisher公司);迷你型垂直电泳仪(SE250/SE260,瑞典Cytiva公司)。
1.2 方法
1.2.1 高糖诱导的N2a细胞损伤模型构建 参考文献[3,10],将N2a细胞分为:正常对照组(Control组,含5.5 mmol/L 葡萄糖的培养基培养)、OS组(含5.5 mmol/L 葡萄糖+24.5 mmol/L甘露醇的培养基培养)和高糖组(HG组)。其中,HG组的葡萄糖终浓度分别设置为12.5、25.0、30.0和50.0 mmol/L。连续培养24 h后,收集细胞,采用CCK-8法检测细胞活力,筛选出最佳干预浓度。
1.2.2 Cur和Fer-1浓度筛选 N2a细胞按照4×104个/ 孔的细胞量接种于6孔板,培养24 h后,以Cur(终浓度分别为0、2.0、5.0、10.0、20.0和50.0 μmol/L)或Fer-1(终浓度分别为0、0.5、1.0、1.5、2.0和2.5 μmol/L)处理N2a细胞6 h后,构建高糖诱导的N2a细胞损伤模型,采用CCK-8法检测细胞的活力变化,筛选出Cur和Fer-1的最佳作用浓度。
1.2.3 细胞分组和干预 N2a细胞按照4×104个/孔的细胞量接种于6孔板,培养24 h后,将细胞随机分为:Control组、OS组、HG组、Fer-1组、Cur组、ML385组和Cur+ML385组。其中,Control组细胞以含5.5 mmol/L葡萄糖的正常培养基培养24 h;OS组细胞以含5.5 mmol/L葡萄糖和24.5 mmol/L 甘露醇培养基培养24 h;HG组以含30.0 mmol/L葡萄糖的培养基培养24 h;Fer-1组、Cur组和ML385组分别以1.0 μmol/L的Fer-1、5.0 μmol/L 的Cur和10.0 μmol/L的ML385处理6 h后,再以30.0 mmol/L葡萄糖的培养基培养24 h;Cur+ML385组以5.0 μmol/L的Cur和10.0 μmol/L的ML385处理6 h后,再以30.0 mmol/L 葡萄糖的培养基培养24 h。
1.2.4 CCK-8法检测细胞活力 N2a细胞按照1.2.3的步骤干预完成后,按照CCK-8检测试剂盒操作说明,每孔加入10 μL CCK-8溶液,将细胞置于 37 ℃、体积分数为0.05的CO2细胞培养箱内继续培养0.5 h,用酶标仪在波长为450 nm处检测各组细胞的光密度(optical density, OD)值。
1.2.5 5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine, EdU)检测细胞增殖 N2a细胞按照1.2.3的步骤干预完成后,每孔细胞中加入总浓度为20 μmol/L的EdU工作液,置于37 ℃、体积分数为0.05的CO2培养箱中继续培养4 h后,吸去培养基,37 ℃预热PBS漂洗3次,每次5 min,4%多聚甲醛室温固定20 min,荧光显微镜拍照分析。
1.2.6 LDH、GSH、MDA和SOD检测 N2a细胞按照1.2.3的步骤干预完成后,收集各组细胞培养基,按照LDH检测试剂盒步骤,检测LDH活性变化。同时收集各组细胞,超声破碎,4 ℃、10 000 r/min(离心半径10 cm)离心20 min,吸取细胞上清液,BCA蛋白定量试剂盒定量,按照GSH、MDA和SOD检测试剂盒步骤检测GSH、MDA和SOD的活性变化。
1.2.7 铁离子含量测定 N2a细胞按照1.2.3的步骤干预完成后,收集细胞,超声破碎,3 000 r/min(离心半径 20.4 cm)离心20 min,收集各组上清液。按照铁离子检测试剂盒步骤检测各组细胞中铁离子的含量变化。
1.2.8 qRT-PCR检测铁死亡相关基因表达 N2a细胞按照1.2.3的步骤干预完成后,弃去培养基,4 ℃预冷PBS漂洗细胞后,加入1 mL TRIzol裂解细胞提取各组细胞RNA,All-in-OneTMFirst-Strand cDNA Synthesis Kit逆转录成cDNA后以qPCR SYBR Green Master Mix进行qRT-PCR检测。反应程序:95 ℃ 3 min→95 ℃ 15 s→54 ℃ 20 s→72 ℃ 15 s;38个循环;65 ℃ 15 s→95 ℃ 30 s。以GAPDH为内参,2-ΔΔCT计算各个基因相对表达量,其中:
ΔCT=CT目的基因-CT内参基因
ΔΔCT=ΔCT实验组-ΔCT对照组
1.2.9 Western-blot检测 各组干预结束后,弃去培养基,4 ℃预冷PBS漂洗细胞后,加入2 mL强度RIPA裂解后,4 ℃、10 000 r/min(离心半径10 cm)离心20 min,吸取细胞上清即为每组细胞样本全蛋白。细胞核蛋白按照细胞核蛋白提取试剂盒步骤进行。获得蛋白后,使用BCA蛋白定量试剂盒定量,每孔按照25 μg蛋白上样,SDS-PAGE电泳,PVDF转膜,分别以兔抗GPX4抗体(1∶1 200)、兔抗FTH-1抗体(1∶800)、兔抗TFR-1抗体(1∶500)、兔抗SLC7A11抗体(1∶800)、兔抗Nrf2抗体(1∶1 000)、兔抗HO-1抗体(1∶1 000)、兔抗GAPDH抗体(1∶10 000),4 ℃冰箱孵育12 h,PBS清洗3~5次,每次5 min,加入HRP酶标兔抗抗体。加入ECL发光液后置于全自动化学发光分析仪中扫描,通过Image J2X软件分析相应的灰度值。
2 结 果
2.1 Cur对N2a细胞活力的影响 与Control组比较,不同浓度的高糖均可显著抑制N2a细胞活力(F=85.99,P<0.01)。30.0 mmol/L高糖刺激后,N2a细胞活力降低约50%,结合实验结果并参考文献[3,10],最终筛选出以30.0 mmol/L浓度的葡萄糖构建高糖损伤模型(图1A)。
与未加Fer-1比较,不同浓度的Fer-1均可显著促进N2a细胞活力(F=33.38,P<0.01),1.0 μmoL/L的Fer-1促进N2a细胞活力的效果最佳(t=11.23,P<0.01),故后续实验以1.0 μmoL/L的Fer-1干预(图1B)。
与未加Cur处理组比较,不同浓度的Cur均可显著促进N2a细胞活力(F=27.78,P<0.01),而5.0 μmoL/L 的Cur促进N2a细胞活力的效果最佳(t=8.75,P<0.01),后续实验以5.0 μmoL/L的Cur干预(图1C)。
与Control组比较,HG组的N2a细胞活力显著降低(t=10.28,P<0.01);与HG组比较,Cur可显著促进N2a细胞活力(t=5.34,P<0.01),Fer-1亦可显著促进N2a细胞活力(t=8.43,P<0.01);与ML385组比较,Cur可显著抑制ML385对N2a细胞活力的作用(t=3.70,P=0.02,图1D)。

OD:光密度;HG:高糖;Fer-1:铁死亡抑制剂;Cur:姜黄素;ML385:Nrf2抑制剂;N2a:Neuro-2a。a组:Control组,5.5 mmol/L 葡萄糖的培养基培养;b组:OS组,5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇的培养基培养;c组:HG组,30.0 mmol/L 葡萄糖的培养基培养;d组:Fer-1组,1.0 μmol/L Fer-1+HG;e组:Cur组,5.0 μmol/L Cur+HG;f组:ML385组,10.0 μmol/L ML385+HG;g组:Cur+ML385组,5.0 μmol/L Cur+10.0 μmol/L ML385+HG。A~C:CCK-8法检测不同浓度的高糖、Fer-1和Cur对N2a细胞活力的影响;D:CCK-8法检测Cur对N2a细胞活力的影响。2 组比较,△:P<0.05;△△:P<0.01;ns:P>0.05。
EdU检测分析发现,HG组N2a细胞增殖能力显著降低;与HG组比较,Cur可显著促进N2a细胞增殖,Fer-1亦可显著促进N2a细胞增殖;与ML385组比较,Cur可显著抑制ML385对N2a细胞增殖的作用(图2)。
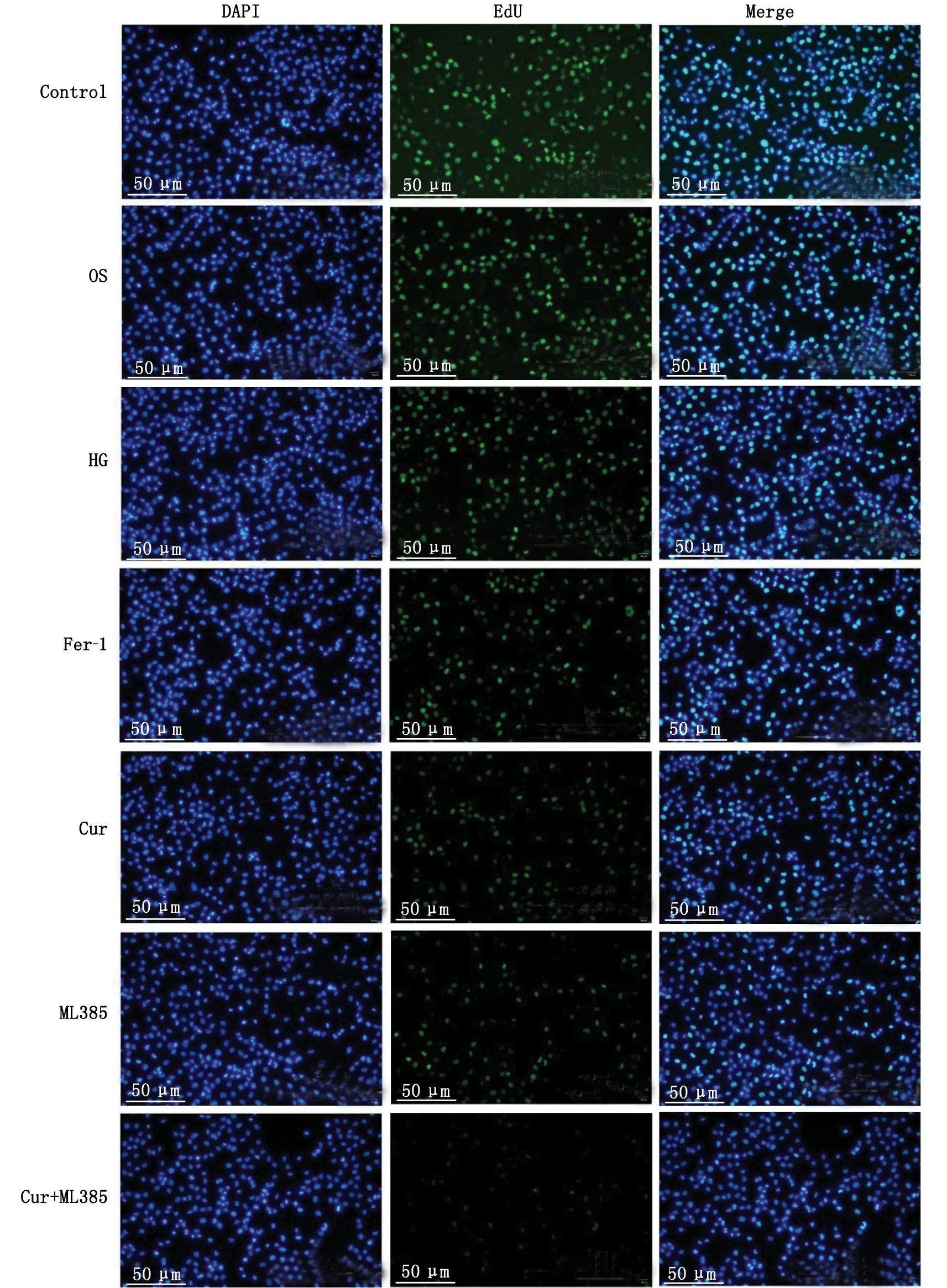
HG:高糖;Fer-1:铁死亡抑制剂;Cur:姜黄素;ML385:Nrf2抑制剂;EdU:5-乙炔基-2’脱氧尿嘧啶核苷;N2a:Neuro-2a。Control组:5.5 mmol/L葡萄糖的培养基培养;OS组:5.5 mmol/L 葡萄糖+24.5 mmol/L甘露醇的培养基培养;HG组:30.0 mmol/L葡萄糖的培养基培养;Fer-1组:1.0 μmol/L Fer-1+HG;Cur组:5.0 μmol/L Cur+HG;ML385组:10.0 μmol/L ML385+HG;Cur+ML385组:5.0 μmol/L Cur+10.0 μmol/L ML385+HG。
2.2 Cur对N2a细胞LDH、GSH、MDA和SOD的影响 与Control组比较,HG组N2a细胞中LDH活性(t=23.30,P<0.01)和MDA含量(t=28.12,P<0.01)均显著增加,SOD的活性(t=13.54,P<0.01)和GSH含量(t=8.76,P<0.01)均显著降低。与HG组比较,Fer-1可显著抑制N2a细胞中LDH活性(t=6.84,P<0.01)、降低MDA含量(t=34.87,P<0.01),上调SOD活性(t=6.27,P<0.01)和GSH含量(t=13.58,P<0.01);与HG组比较,Cur可显著抑制N2a细胞中LDH活性(t=7.26,P<0.01)、降低MDA含量(t=34.56,P<0.01),上调SOD活性(t=6.21,P<0.01)和GSH含量(t=13.12,P<0.01);与ML385组比较,Cur可显著抑制ML385所导致的N2a细胞中LDH活性(t=16.23,P<0.01)和增加MDA含量(t=14.27,P<0.01),上调SOD活性(t=11.23,P=0.00)和GSH含量(t=8.12,P<0.01,表2)。

表2 N2a细胞中LDH、GSH、MDA和SOD含量比较
2.3 Cur对N2a细胞铁离子含量的影响 与Control组比较,HG组N2a细胞中铁离子的含量显著升高(t=24.50,P<0.01);与HG组比较,Fer-1可显著降低N2a细胞中铁离子含量(t=26.67,P<0.01);与HG组比较,Cur可显著抑制N2a细胞中铁离子含量(t=22.24,P<0.01);与ML385组比较,Cur可显著抑制ML385所导致的N2a细胞中铁离子含量升高(t=14.47,P<0.01,表3)。

表3 各组N2a细胞中铁离子质量比的比较
2.4 Cur对N2a细胞铁死亡相关基因表达的影响 与Control组比较,HG组N2a细胞中GPX4(t=17.10,P<0.01)、FTH-1(t=10.28,P<0.01)和SLC7A11(t=14.04,P<0.01)mRNA表达水平显著降低,TFR-1 mRNA 表达显著升高(t=20.58,P<0.01);与HG组比较,Fer-1可显著促进N2a细胞中GPX4(t=18.28,P<0.01)、FTH-1(t=8.43,P<0.01)和SLC7A11(t=23.92,P<0.01)mRNA表达水平,抑制TFR-1 mRNA表达(t=21.29,P<0.01);与HG组比较,Cur可显著促进N2a细胞中GPX4(t=13.30,P<0.01)、FTH-1(t=5.34,P<0.01)和SLC7A11(t=18.40,P<0.01)mRNA表达水平,抑制TFR-1 mRNA表达(t=16.07,P<0.01);与ML385组比较,Cur可显著促进N2a细胞中GPX4(t=3.70,P=0.02)、FTH-1(t=3.74,P=0.02)和SLC7A11(t=6.12,P=0.03)mRNA表达水平,抑制TFR-1 mRNA表达(t=5.03,P=0.04,图3A)。
与Conrol组比较,HG组N2a细胞中GPX4(t=15.53,P<0.01)、FTH-1(t=14.28,P<0.01)和SLC7A11(t=18.42,P<0.01)蛋白表达水平显著降低,TFR-1蛋白表达显著升高(t=18.68,P<0.01);与HG组比较,Cur可显著促进N2a细胞中GPX4(t=9.34,P<0.01)、FTH-1(t=14.25,P<0.01)和SLC7A11(t=12.48,P<0.01)表达水平,抑制TFR-1表达(t=10.77,P<0.01);与ML385组比较,Cur可显著促进N2a细胞中GPX4(t=4.21,P=0.01)、FTH-1(t=5.59,P<0.01)和SLC7A11(t=4.18,P=0.01)表达水平,抑制TFR-1表达(t=4.33,P=0.01,图3B)。

N2a:Neuro-2a;GPX4:谷胱甘肽过氧化物酶4;SLC7A11:溶质载体家族7成员11;FTH-1:铁蛋白重链多肽1;TFR-1:转铁蛋白受体1;GAPDH:甘油醛-3-磷酸脱氢酶;HG:高糖;Fer-1:铁死亡抑制剂;Cur:姜黄素;ML385:Nrf2抑制剂。a组:Control组,5.5 mmol/L葡萄糖的培养基培养;b组:OS组,5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇的培养基培养;c组:HG组,30.0 mmol/L葡萄糖的培养基培养;d组:Fer-1组,1.0 μmol/L Fer-1+HG;e组:Cur组,5.0 μmol/L Cur+HG;f组:ML385组,10.0 μmol/L ML385+HG;g组:Cur+ML385组,5.0 μmol/L Cur+10.0 μmol/L ML385+HG。A:qRT-PCR检测分析Cur干预后,N2a细胞中GPX4、FTH-1、TFR-1和SLC7A11 mRNA表达;B:Western-blot检测分析Cur干预后,N2a细胞中GPX4、FTH-1、TFR-1和SLC7A11 等蛋白表达。2组比较,△:P<0.05;△△:P<0.01;ns:P>0.05。
2.5 Cur对Nrf2/HO-1通路表达的影响 与Control组比较,HG组N2a细胞中Nrf2(t=26.28,P<0.01)和HO-1(t=21.13,P<0.01)表达水平显著降低;与HG组比较,Fer-1可显著促进N2a细胞中Nrf2(t=18.35,P<0.01)和HO-1(t=15.76,P<0.01)表达水平;与HG组比较,Cur可显著促进N2a细胞中Nrf2(t=15.19,P<0.01)和HO-1(t=12.14,P<0.01)表达;与ML385组比较,Cur可显著促进N2a细胞中Nrf2(t=5.37,P<0.01)和HO-1(t=3.89,P=0.01)表达(图4)。

N2a:Neuro-2a;Nrf2:核转录因子红系2相关因子2;Lamin B1:核纤层蛋白B1;HO-1:血红素加氧酶1;GAPDH:甘油醛-3-磷酸脱氢酶;HG:高糖;Fer-1:铁死亡抑制剂;Cur:姜黄素;ML385:Nrf2抑制剂。a组:Control组,5.5 mmol/L葡萄糖的培养基培养;b组:OS组,5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇的培养基培养;c组:HG组,30.0 mmol/L 葡萄糖的培养基培养;d组:Fer-1组,1.0 μmol/L Fer-1+HG;e组:Cur组,5.0 μmol/L Cur+HG;f组:ML385组,10.0 μmol/L ML385+HG;g组:Cur+ML385组,5.0 μmol/L Cur+10.0 μmol/L ML385+HG。A:Western-blot检测电泳条带;B:Nrf2相对表达量;C:HO-1相对表达量。2 组比较,△:P<0.05;△△:P<0.01;ns:P>0.05。
3 讨 论
DN是糖尿病最常见的慢性微血管并发症之一,严重影响患者的生活质量和身心健康。预计到2035年,糖尿病将影响全球约5.92亿人,DN在1型或2型糖尿病患者中均可能发生,而以2型糖尿病患者为主[11-12]。氧化应激、线粒体功能障碍、细胞凋亡和炎症是DN发生、发展的重要途径[13]。控制血糖是目前唯一能预防和延缓DN发生和进展的有效措施[4],但对于大多数糖尿病患者来说,维持血糖正常是很困难的。Cur可通过控制炎症、氧化应激损伤和神经细胞凋亡等途径抑制DN的进展[8-9,14]。本研究发现,Cur可显著抑制高糖所导致的N2a细胞氧化损伤,促进细胞活力。
铁死亡是一种新发现的由铁依赖性脂质过氧化累计所引起的调节性细胞死亡[5]。铁死亡的特征性变化包括氧化还原活性铁的积累、抗氧化能力的降低和含磷脂的多不饱和脂肪酸的过氧化等[15]。在高糖处理下,N2a细胞中铁离子浓度、LDA活性和MDA含量显著升高,GSH和SOD含量显著降低。而Cur处理后,Cur可显著抑制N2a细胞中铁离子浓度、LDA活性和MDA含量,促进GSH和SOD表达水平,说明Cur可能通过调控铁死亡抑制高糖对N2a细胞损伤。GPX4和SLC7A11被认为是铁死亡的重要生物标志物,GPX4和SLC7A11的表达缺乏可能会导致大量ROS产生和GSH功能障碍[16-17]。TFR-1和FTH-1是参与铁代谢稳态的关键基因,与铁死亡的发生密切相关[18-19]。在高糖处理下,N2a细胞中GPX4、SLC7A11和FTH-1的mRNA和蛋白的表达均被下调,而TFR-1 mRNA和蛋白表达水平显著升高。而Cur处理后,Cur可显著促进N2a细胞中GPX4、SLC7A11和FTH-1的mRNA 和蛋白的表达,抑制TFR-1 mRNA和蛋白表达水平。上述结果表明,Cur抑制高糖诱导的N2a细胞损伤与抗氧化系统(GPX4和SLC7A1)和铁代谢调节系统(FTH-1和TFR-1)密切相关。
作为转录因子,Nrf2在抗氧化中起关键作用,也被认为是铁死亡的重要调节因子,是铁储存和运输相关的重要基因[20-21]。研究发现,Nrf2/HO-1信号通路可作为一种内源性抗氧化剂,通过拮抗多个器官中的氧化应激损伤[22]。激活Nrf2/HO-1信号通路可增强多种抗氧化剂的表达,保护心肌细胞免受氧自由基造成的损伤[23]。Nrf2通路的激活可抑制肝细胞癌细胞发生铁死亡[24]。激活Nrf2/HO-1通路,可有效控制DN的发生和进展[25]。在高糖处理下,N2a细胞中Nrf2和HO-1蛋白的表达均被下调;而Cur处理后,Cur可显著促进N2a细胞中Nrf2和HO-1蛋白的表达;Nrf2特异性抑制剂ML385可部分抑制Cur对N2a细胞中Nrf2和HO-1蛋白表达的影响,表明Cur抑制高糖所致N2a细胞铁死亡可能与Nrf2/HO-1通路相关。
综上所述,Cur可通过激活Nrf2/HO-1通路,抑制高糖所致N2a细胞铁死亡,促进N2a细胞活力。但本研究仅局限于细胞水平,后续还需以动物模型深入研究Cur抑制DN发生、进展与铁死亡的关系,以及其影响Nrf2/HO-1通路的具体机制。

