腹泻型肠易激综合征大鼠炎症因子与肠道微生物的相关性研究
张儒奇,朱炳旭,孙金鹏,王 荣,孙 闵
(1.济宁医学院中西医结合学院,山东 济宁 272067;2.济宁医学院基础医学院,山东 济宁 272067)
张儒奇,朱炳旭,孙金鹏,等.腹泻型肠易激综合征大鼠炎症因子与肠道微生物的相关性研究[J].畜牧与饲料科学,2023,44(2):17-25.
肠易激综合征(irritable bowel syndrome,IBS)是一种病因复杂、发病机理尚未明确的功能性肠道疾病,主要表现为慢性腹痛或不适以及排便习惯异常等,其中腹泻型肠易激综合征 (diarrheapredominant irritable bowel syndrome,IBS-D)临床最为常见。进一步探索IBS-D 发病机制对于临床防治具有重要意义。已有报道显示IBS-D 患者中TNF-α、IL-6 等促炎细胞因子显著增高,而IL-10等抗炎细胞因子显著降低[1]。肠道炎症因子是IBS-D 重要致病因素之一,炎症因子的失衡可破坏肠道免疫系统,下调紧密连接蛋白表达,影响肠道黏膜屏障功能与通透性,造成胃肠功能紊乱[2-3]。肠-脑轴与下丘脑-垂体-肾上腺皮质轴的失调,是肠道炎症因子诱导内脏高敏性,参与IBS-D 发生与病情反复的主要作用途径。研究表明,肠道菌群亦能通过肠-脑轴双向影响肠道炎症反应与免疫调节。肠道微生态紊乱一方面会刺激机体NF-κB等信号通路转导,促进炎症反应[4],另一方面则通过调控模式识别受体(PRRs)产生,抑制免疫表达,从而加剧IBS-D[5]。济宁医学院中西医结合治疗脾胃病创新团队前期研究发现,IBS-D 大鼠存在肠道菌群紊乱的同时伴有不同程度的炎症反应[6],肠道微生物与机体免疫之间具有一定相互作用。因此,该试验通过“乙酸结肠灌注联合束缚刺激法”构建IBS-D 大鼠模型,探讨IBS-D 大鼠血清炎症因子与肠道菌群的变化以及相关性,旨在为腹泻类相关疾病临床检测炎症因子以指导益生菌或抗生素的选用提供有益参考。
1 材料与方法
1.1 实验动物
实验程序均在济宁医学院动物伦理委员会批准与监督下完成,伦理批号为JNMC-2022-DW-084。选取SPF 级雄性SD 大鼠12 只,体重230~250 g,购自济南朋悦实验动物繁育有限公司,实验动物许可证号:SCXK(鲁)20190003,动物质量合格证号:No.370726200100661354。
1.2 主要仪器与试剂
BSA124S-CW 电子天平购自德国Sartorivs 公司,IL-10、IL-6、TNF-α 酶联免疫吸附法(ELISA)试剂盒购自杭州联科生物技术有限公司,批号分别为A31001245、A30601231、A38210145。
1.3 IBS-D 模型大鼠建立
12 只大鼠分笼饲养于济宁医学院动物实验中心,温度(21±2)℃,相对湿度(50±10)%,12 h/12 h明暗周期交替。适应性饲养5 d 后,按照随机数字表法分为正常组(CON)与模型组(MOD),每组6只。模型组依照“乙酸结肠灌注联合束缚刺激法”[7]进行造模。正常组、模型组均给予蒸馏水10 mL/(kg·BW)灌胃,干预1 次/d,连续8 d 模型稳定后进行样本采集。
1.4 样本采集
大鼠末次干预后禁食不禁水12 h,无菌条件下留取结肠中粪便样品于无酶EP 管中,-80 ℃冰箱保存。腹主动脉取血5 mL 到促凝管,之后4 000 r/min 离心10 min 分离血清,吸取上层血清分装至标记好的1.5 mL EP 管中,将血清标本放入-80 ℃冰箱保存以备指标检测用。
1.5 肠道菌群检测
通过深圳微生态科技有限公司完成肠道菌群16S rDNA V3~V4 区高通量测序,采用CTAB 法对样本的基因组DNA 进行提取,选用引物序列341F (5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACHVGGGTATCTAAT-3′)进行PCR扩增,混样与纯化,应用Qubit 进行文库定量及检测,应用NovaSeq 6000 PE250 平台进行上机测序。并选择美吉生物云平台(http://cloud.majorbio.com)进行菌群多样性分析、优势物种组成与差异分析、单因素网络分析、指示物种分析以及Spearman 相关性分析。
1.6 血清炎症因子检测
采用双抗体夹心酶联免疫吸附法检测,操作步骤严格按照IL-10、IL-6、TNF-α 酶联免疫吸附法(ELISA)试剂盒说明书要求,检测血清中IL-10、IL-6、TNF-α 含量。
1.7 统计学方法
采用SPSS 20.0 统计学软件进行数据分析。当数据符合正态分布并满足方差齐性时,采用t 检验进行两组间比较。当数据不符合正态分布或方差不齐时,采用非参数检验进行两组间比较。相关性采用Spearman 相关性分析。P<0.05 为差异有统计学意义。
2 结果与分析
2.1 肠道菌群物种多样性分析
物种累计曲线结果显示,伴随样本量的增加曲线整体走势趋于平缓,提示两组样本量充足,测序数据基本覆盖样本中所有物种。Ace、Chao、Shannon、Coverage、Sobs、Simpson 指数可用于反映肠道菌群α 多样性,结果显示MOD 组Ace、Chao、Shannon、Coverage、Sobs 指数均低于CON 组,差异均有统计学意义(P<0.05 或P<0.01 或P<0.001),提示IBS-D 大鼠肠道菌群丰富度与多样性明显降低。样本层级聚类分析可用于反映肠道菌群β 多样性,结果显示MOD 组样本间菌群结构相似,聚类在上方;CON 组中一个样本与其他样本差异度略高,其余聚类在下方。总体上MOD 组与CON 组基本分开,各自聚类为一簇,提示IBS-D 大鼠肠道菌群结构发生改变,具体结果见图1。
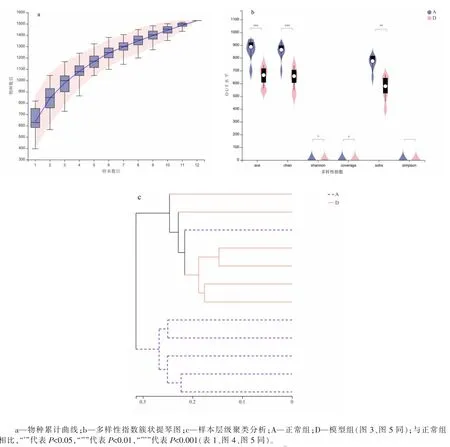
图1 肠道菌群物种多样性分析(n=6,x±s)
2.2 肠道菌群组成分析
优势菌群的相对丰度与肠道微生态功能变化密切相关。肠道菌群相对丰度表分析结果显示,在门水平上,两组大鼠肠道优势菌群主要归属于拟杆菌门(Bacteroidota)与厚壁菌门(Firmicutes)。但两组菌群相对丰度变化不同,结果显示,与CON组相比,MOD 组Bacteroidota 相对丰度升高,Firmicutes、脱硫菌门(Desulfobacterota)、变形菌门(Proteobacteria)相对丰度降低,差异有统计学意义(P<0.05 或P<0.01)。在属水平上,两组大鼠肠道优势菌群主要归属于普雷沃菌属(Prevotella)与乳酸杆菌属(Lactobacillus),组间差异结果显示,与CON组相比,MOD 组拟普雷沃菌属 (Alloprevotella)相对 丰 度 升 高,Lachnospiraceae_NK4A136_group、unclassified_f_Lachnospiraceae 相对丰度降低,差异有统计学意义(P<0.05),具体结果见表1。
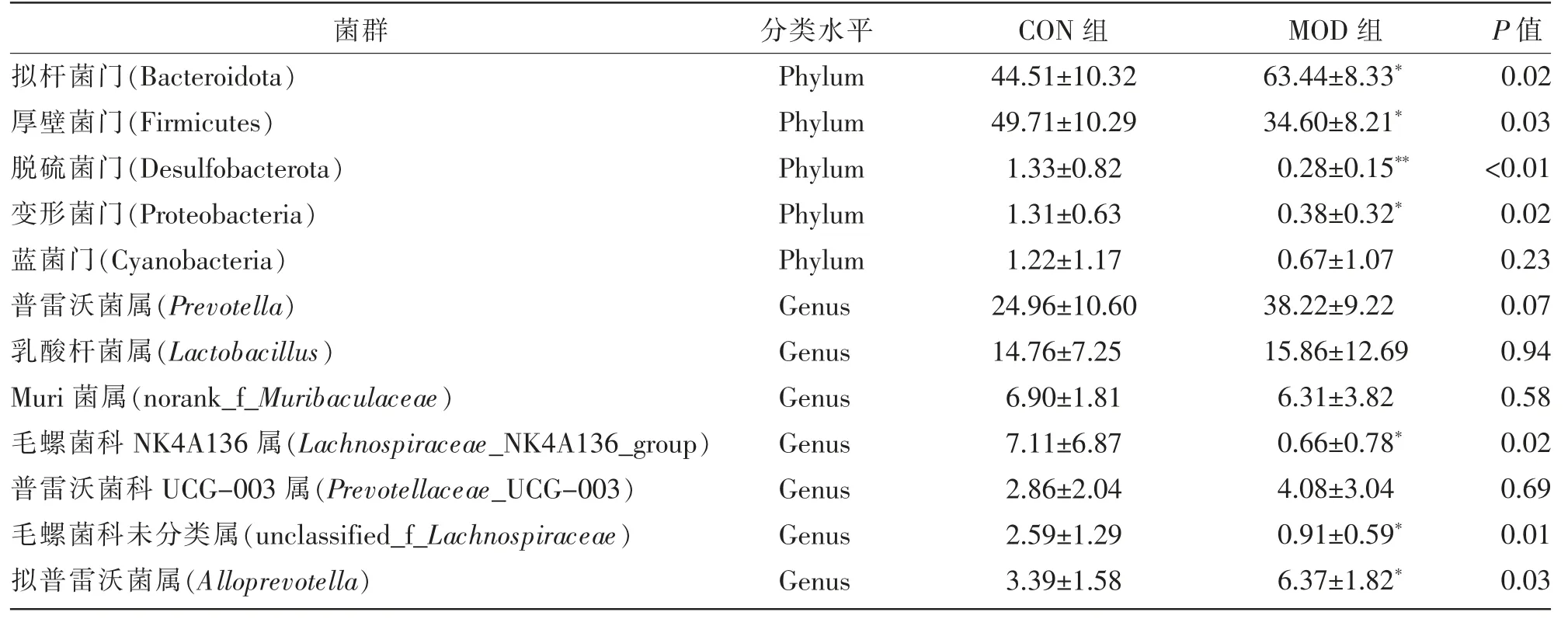
表1 门、属水平下肠道菌群相对丰度表(n=6,x±s)
2.3 肠道菌群单因素网络分析
单因素网络分析可用于分析菌群之间相关性,网络图中的节点为species-node 节点,通过计算网络的节点度分布、节点联通性(Degree)等属性,获得各组菌群间相关性,并全面反映数据信息。选择分类水平总丰度前30、相关系数绝对值>0.5(P<0.05)的物种,构建属水平单因素相关性网络。节点大小表示物种丰度;连线颜色表示正负相关性,红色表示正相关,绿色表示负相关;线的粗细、数量表示物种之间的相关性。前部分研究中,在属水平上进行差异菌群组成分析发现,MOD 组中Alloprevotella 相对丰度较CON 组明显上升,Lachnospiraceae_NK4A136_group 等菌属相对丰度明显降低,因此进行重点研究。单因素网络结果显示,MOD 组中Alloprevotella 与罗氏菌属(Roseburia)、罗 姆 布 茨 菌 属 (Romboutsia)、Lachnospiraceae_NK4A136_group 呈 负 相 关;Lachnospiraceae_NK4A136_group 与Romboutsia、UCG-003、Oscillibacter、Roseburia 具 有 较 强 正 相 关 性,具体结果见图2。
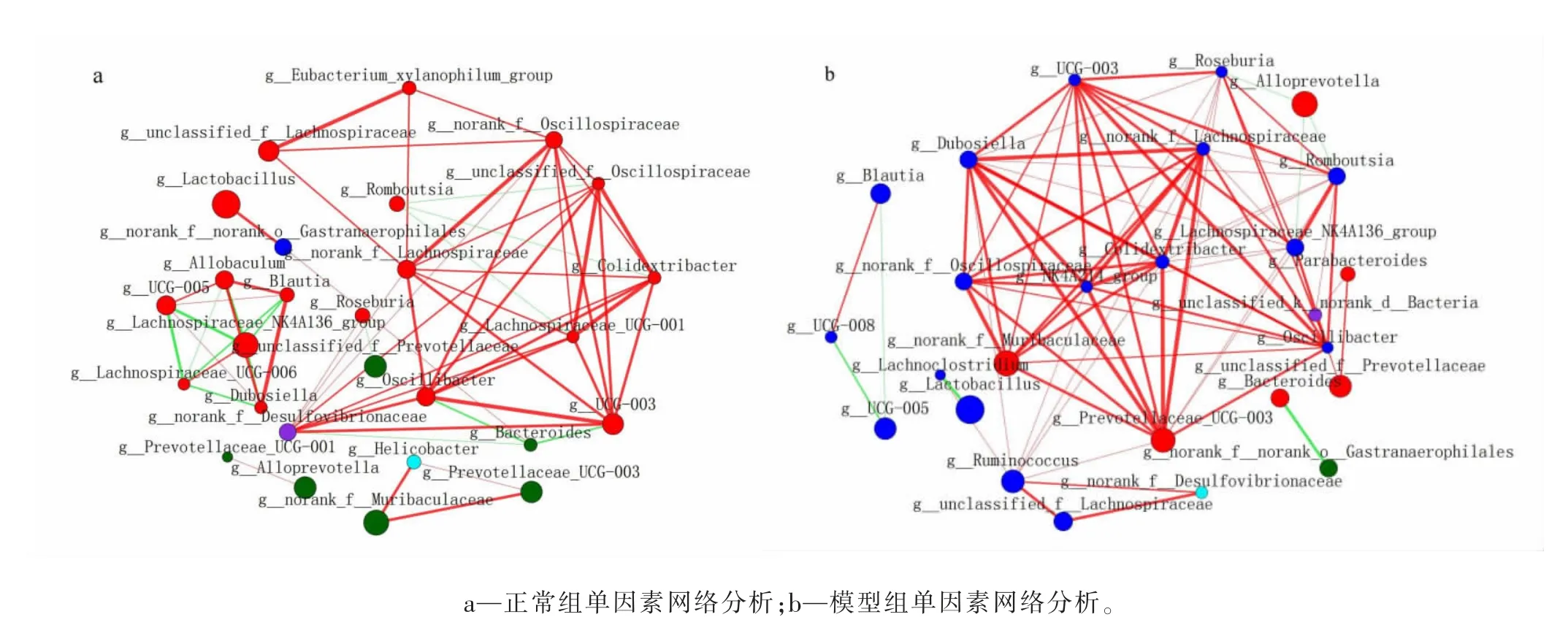
图2 属水平下肠道菌群单因素网络分析
2.4 肠道菌群指示物种分析
指示物种分析可用于处理存在显著正效应的微生物,同时兼顾存在组间差异的高丰度与低丰度菌群,区分正常大鼠与IBS-D 大鼠菌群差异性,进而为研究菌群效应及互作机制提供一定指导。选取属水平上存在明显差异 (P<0.05)的指示物种,依据指示能力与相对丰度绘图,结果显示CON组中指示物种主要包括盐弧菌属(Salinivibrio)、四联菌属(Tetragenococcus)等,MOD 组中指示物种主 要 包 括 Candidatus_Stoquefichus、Candidatus_Arthromitus 等,具体结果见图3。
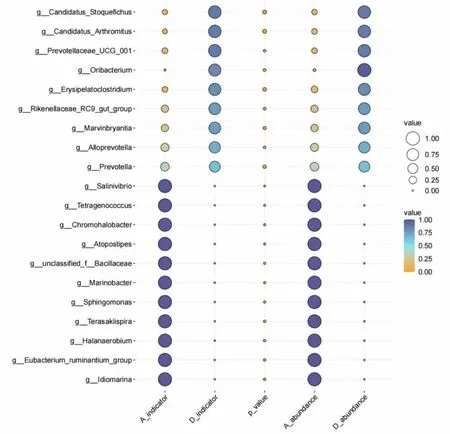
图3 属水平下指示物种分析
2.5 血清炎症因子差异性分析
两组血清炎症因子分析结果显示,与CON 组相比,MOD 组在IL-6、TNF-α 水平提高(P<0.01),在IL-10 水平降低(P<0.01),具体结果见图4。
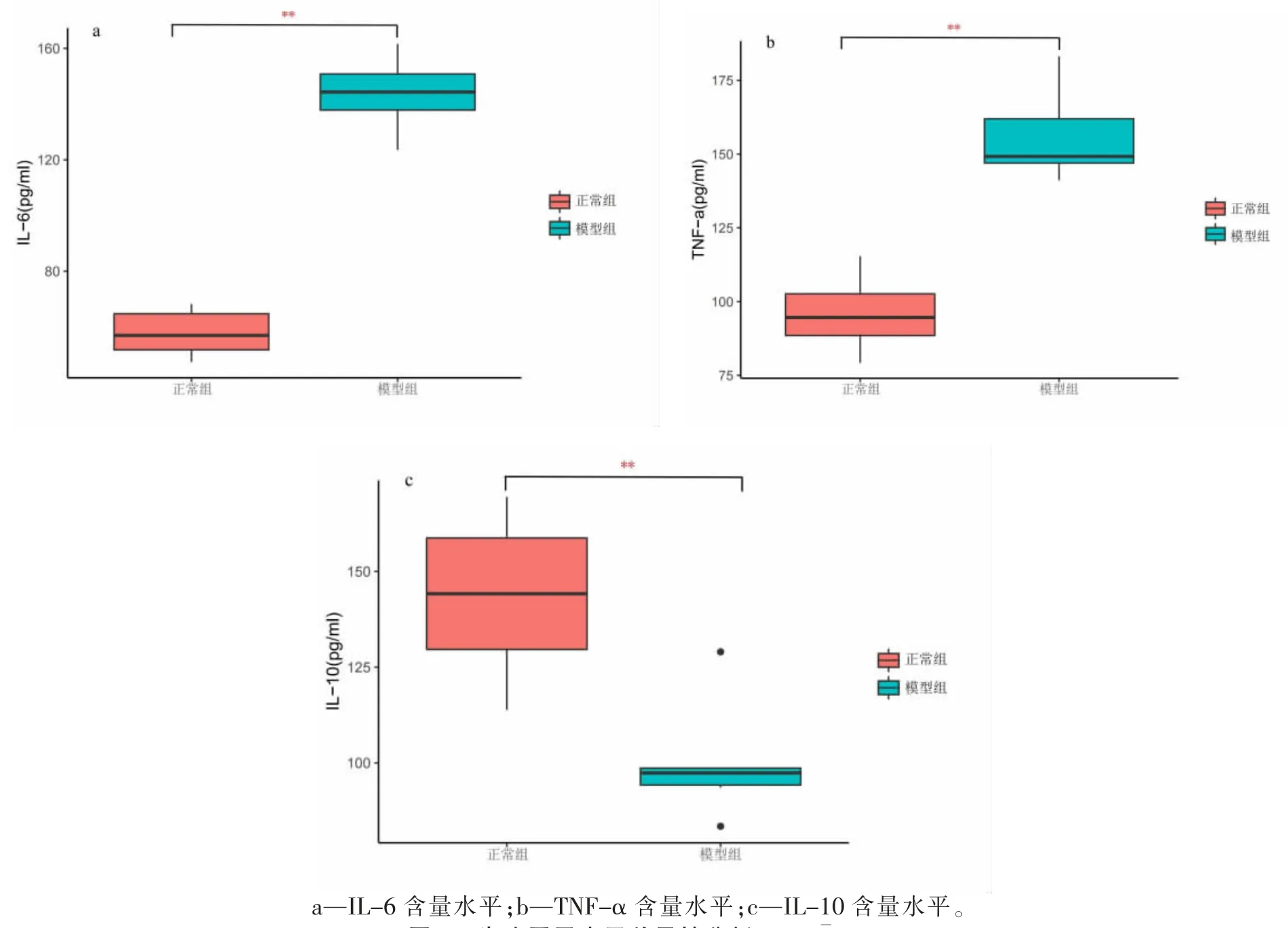
图4 炎症因子水平差异性分析(n=6,x±s)
2.6 肠道菌群与血清炎症因子相关性分析
采用RDA 分析属水平上两组肠道菌群与炎症因子(IL-10、IL-6 及TNF-α)的相关性,同时利用相关性Heatmap 图直观展示。选择RDA 呈图(Axis-lengths<3.5),红色箭头表示炎症因子,炎症因子箭头方向显示IL-6、TNF-α 对模型组影响程度最大,而IL-10 对正常组影响最大。肠道菌群投影与炎症因子箭头关联显示,模型组与IL-6、TNF-α 方向一致,呈正相关,与IL-10 方向相反,呈负相关;正常组与IL-6、TNF-α 方向相反,呈负相关,与IL-10 方向一致,呈正相关,具体结果见图5。相关性Heatmap 图结果显示在门水平上,梭杆菌门(Fusobacteriota)、黏菌门(Myxococcota)、变形菌门(Proteobacteria)、Halanaerobiaeota 与IL-10呈正相关,Bacteroidota 与IL-10 呈负相关;Bacteroidota 与IL-6 呈正相关,Campilobacterota、Halanaerobiaeota 与IL-6 呈负相关;Desulfobacterota、Campilobacterota、Halanaerobiaeota 与TNF-α 呈负相 关。在 属 水 平 上,Alloprevotella、Prevotellaceae_UCG-001、Prevotella 与IL-10 呈负相关,而Alloprevotella、Prevotellaceae_UCG-001 与IL-6、TNF-α 呈正相关;Lachnospiraceae_NK4A136_group、UCG-003、Oscillibacter 与IL-10 呈正相关,与IL-6、TNF-α 呈负相关,上述结果差异均有统计学意义(P<0.05 或P<0.01 或P<0.001),具体结果见图6。
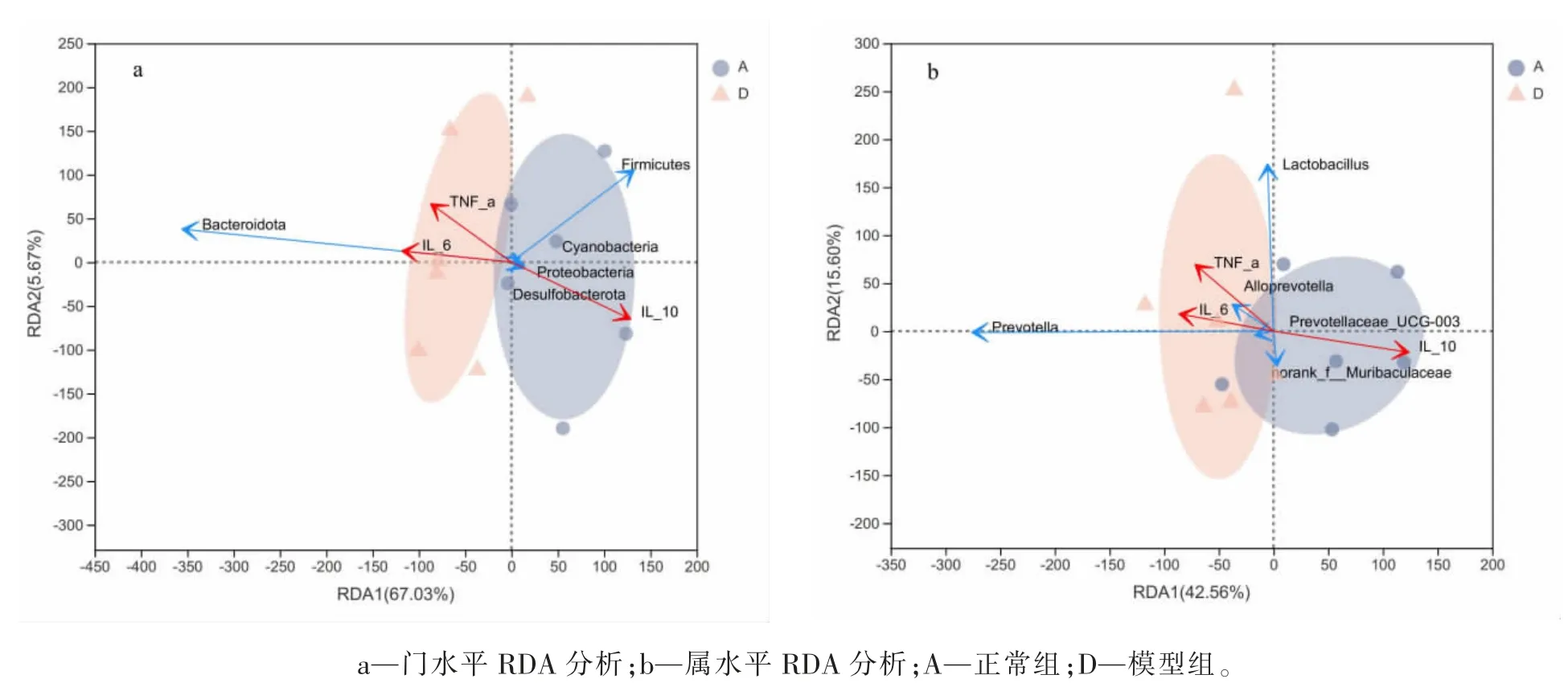
图5 肠道菌群与炎症因子RDA 分析
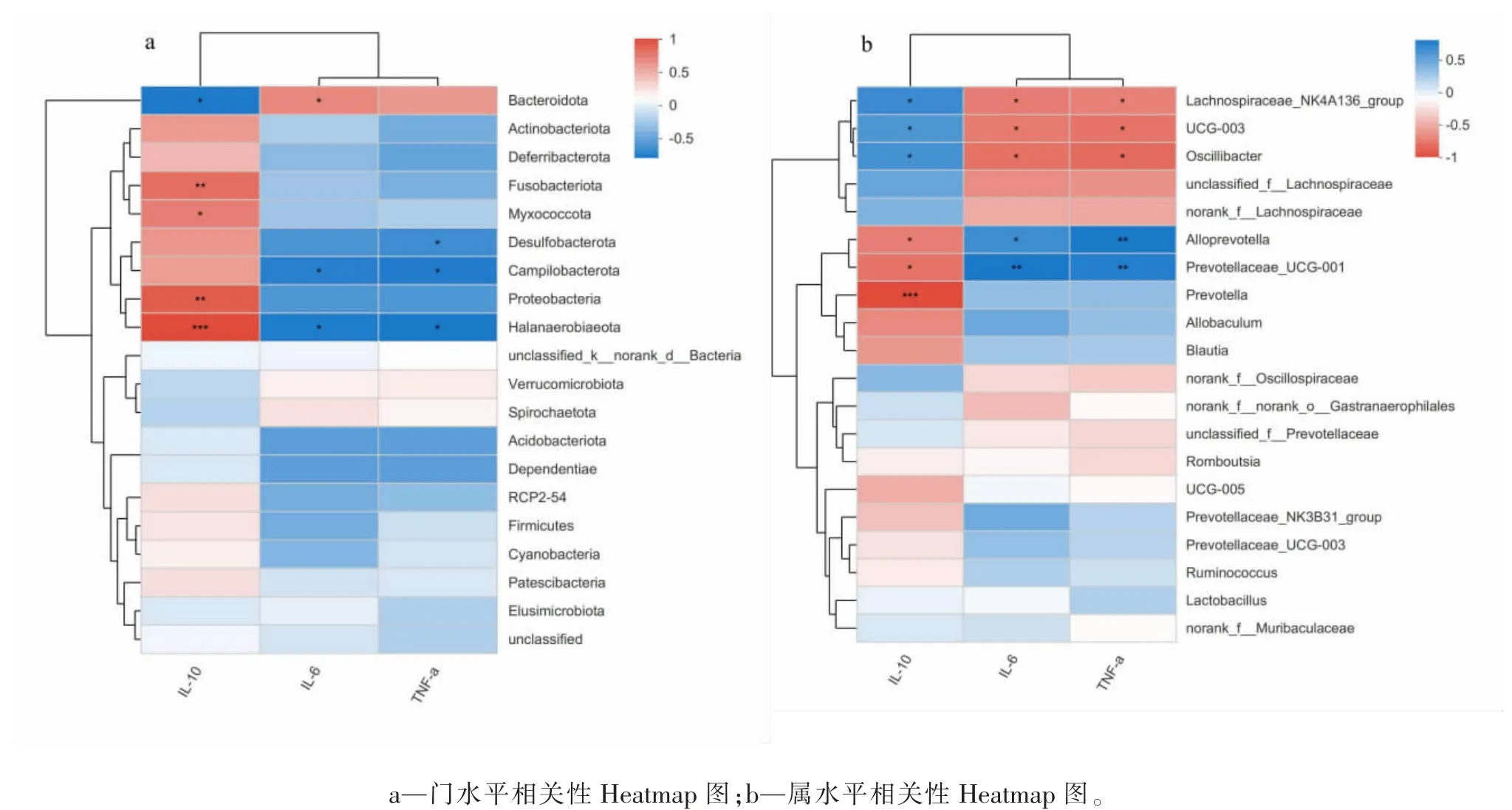
图6 肠道菌群与炎症因子相关性Heatmap 图
3 讨论
IBS-D 属于中医学“泄泻”“腹痛”等范畴,病位在大肠,多责之于肝脾。脾主运化水谷津液,脾虚无以运化,则生湿生痰,而湿证的病因病机与炎症关系密切。现代研究发现,痰湿的物质基础包括了炎症反应中的多种免疫产物,痰湿体质更是处于慢性低度炎症的潜在状态[8],因此IBS-D 存在的炎症反应与肠道菌群紊乱有关,而肠道菌群与炎症在IBS-D 发生时亦可同时出现。既往研究中,有临床报道发现IBS-D 患者双歧杆菌、乳杆菌等菌群相对丰度降低,同时伴随血清IL-6、IL-8 和TNF-α 水平升高[9];也有动物实验表明,IBS-D 大鼠促炎因子IL-8、MyD88 及TNF-α 均高于正常大鼠,而抗炎因子IL-10 与肠道益生菌群均低于正常大鼠[10];更有研究直接指出肠道菌群与炎性因子之间可能存在相互作用关系[11]。这些证据均表明了IBS-D 肠道菌群与炎性因子具有相关性,而明确两者的具体关系对于治疗IBS-D 具有重要意义。
该试验通过“乙酸结肠灌注联合束缚刺激法”构建IBS-D 大鼠模型,并采用16S rDNA 高通量测序技术与ELISA 法血清检测,发现模型组大鼠肠道菌群的组成结构与血清炎症因子发生改变,并在此基础上进一步分析菌群与血清炎症因子的具体关联性。肠道优势菌群组成分析显示,在门水平上,主要优势菌为Bacteroidota 与Firmicutes,与正常大鼠相比,模型组大鼠Bacteroidota 相对丰度升高,Firmicutes 相对丰度降低。研究发现,Bacteroidota 可致使肠道炎症,其所属部分脆弱拟杆菌可产生β-内酰胺酶与内毒素脂多糖等致炎物质,同时该菌门与Firmicutes 比例失衡下,会导致过度免疫损伤[12]。在属水平上,模型组大鼠中Prevotella为优势菌属,其相对丰度的增加,可抑制抗炎因子表达,提高炎症易感性[13]。同时组间差异结果显示,与正常大鼠相比,模型组大鼠Alloprevotella 相对丰度升高,而Lachnospiraceae_NK4A136_group、unclassified_f_Lachnospiraceae 相对丰度降低。对模型组大鼠主要差异菌属进行单因素网络分析发现,相对丰度提高的Alloprevotella 与Roseburia、Romboutsia、Lachnospiraceae_NK4A136_group 呈负相关。Roseburia 是促进肠道运动、维持免疫稳态并具有抗炎活性的一类肠道共生菌[14];Romboutsia同样属于肠道正常菌群,该菌属相对丰度的降低,可使肠道菌群与黏膜屏障之间的功能交互作用减弱,从而诱发低度炎症反应[15]。而相对丰度降低的Lachnospiraceae_NK4A136_group 与 Romboutsia、UCG -003、Oscillibacter、Roseburia 呈 正 相 关。Lachnospiraceae_NK4A136_group 隶 属 于 Firmicutes,其相对丰度与丁酸等短链脂肪酸 (shortchain fatty acids,SCFAs)含量成正比,同时该菌属能 够 和 上 述Romboutsia、UCG-003、Oscillibacter、Roseburia 等益生菌相互协同发挥作用,共同参与维持肠道正常生理功能。指示物种分析发现,模型组 大 鼠 中 Candidatus_Stoquefichus、Candidatus_Arthromitus 等菌属指示能力较强。Candidatus_Stoquefichus 相对丰度升高,与既往研究结果一致[16];Candidatus_Arthromitus 为肠道黏膜共生菌,具有促进免疫、清除肠道病原体作用[17],然而目前关于两者相关报道较少,能否作为IBS-D 大鼠与正常大鼠的鉴别物种,需要临床进一步研究。
相关性分析结果显示,模型组与IL-6、TNF-α含量水平呈正相关,与IL-10 呈负相关;正常组与IL-6、TNF-α 含量水平呈负相关,与IL-10 呈正相关。具体分析菌群与炎症因子之间相关性发现,在门水平上,模型组大鼠主要优势菌Bacteroidota 与抗炎因子IL-10 呈负相关,与促炎因子IL-6 呈正相关。而另一个菌群Halanaerobiaeota 与IL-10 呈正相关,与IL-6、TNF-α 呈负相关,这也提示了Halanaerobiaeota 可能是IBS-D 炎症反应的保护菌群。在属水平上,模型组大鼠主要差异菌属Alloprevotella 与IL-10 呈负相关,而与IL-6、TNF-α呈正相关,与已有临床报道一致[18]。研究发现脾虚泄泻大鼠的Alloprevotella 相对丰度提高,其能够通过破坏肠道黏膜屏障,引发腹痛、腹泻等症状[19]。相关性分析还发现,Bacteroidota 的2 个菌属Prevotellaceae_UCG-001、Prevotella 与IL-10 呈 负 相关,与IL-6、TNF-α 呈正相关,而Firmicutes 的3个 菌 属Lachnospiraceae_NK4A136_group、UCG-003、Oscillibacter 与IL-10 呈 正 相 关,与IL-6、TNF-α 呈负相关。这也提示模型组大鼠的炎症反应主要与Firmicutes 和Bacteroidota 相对丰度的动态变化有关,并且在属水平上表现为Firmicutes 部分菌属相对丰度降低、Bacteroidota 部分菌属相对丰度升高,这种相互作用另加上其他菌门下菌属的参与,共同导致IBS-D 炎症反应的发生发展。需要指出的是,参与IBS-D 发病的肠道菌群结构组成复杂,单一菌群对于疾病的作用有限,而多菌群的相互影响以及炎症反应等综合作用可能才是导致疾病进展的原因[20]。该试验也存在着样本量较少、免疫指标检测有限等局限性,有待继续开展试验研究,并进一步探索和分析IBS-D 发生发展中具有重要影响的菌群与免疫产物。
4 结论
与健康大鼠相比,IBS-D 大鼠肠道菌群组成结构、血清炎症因子均发生变化,且部分菌门、菌属与IL-10、IL-6、TNF-α 存在相关性,这可能为腹泻类相关疾病临床检测炎症因子以指导益生菌或抗生素的选用提供有益参考。

