长链非编码RNA对耐药非小细胞肺癌细胞生物学特性的影响
贾 瑞,王 超,李 健
(秦皇岛市第一医院胸外科,河北 秦皇岛 066000)
肺癌是临床上常见的恶性肿瘤之一,国家癌症中心的统计数据显示,2016年肺癌在我国男性中的发病率、病死率均居恶性肿瘤首位,在女性中的发病率居恶性肿瘤第2位,但病死率仍居首位[1]。目前,肺癌的发病机制尚未完全阐明,其发病可能与吸烟、职业暴露、电离辐射、肺部病史等有关。肺癌中80%以上为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。近年来,随着分子靶向治疗、免疫治疗的不断发展,肺癌的治疗效果已经取得较大的进步,但NSCLC患者病死率仍居高不下,主要是因为多数患者确诊时已发展至中晚期,再加上化学治疗药物使用时间的延长、药物剂量的加大,导致耐药性增加,影响患者预后[3-4]。长链非编码RNA(long non-coding RNA,LncRNA)是指长度>200个核苷酸,缺少长的进化保守开放阅读框,且无编码蛋白质功能的基因转录产物。有研究表明,LncRNA在调节细胞生长和新陈代谢中发挥重要作用,其转录失调可直接影响肿瘤细胞的增殖、迁移、侵袭、凋亡及其对药物的敏感性[5]。因此,本研究以对化学治疗药物顺铂耐药的Ⅲb~Ⅳ期的NSCLC患者为研究对象,探讨癌组织中转录失调的LncRNA对顺铂耐药NSCLC细胞生物学特性的影响及其作用机制,现将结果报道如下。
1 材料与方法
1.1 组织标本来源选择2019年4月至2021年2月秦皇岛市第一医院收治NSCLC患者61例为研究对象。病例纳入标准:(1)符合NSCLC诊断标准[6],经组织病理检查确诊;(2)患者对化学治疗药物产生耐药性;(3)肿瘤分期为Ⅲb~Ⅳ期[7];(4)能配合完成标本采集,且患者近期未使用其他方法治疗。排除标准:(1)存在其他部位恶性肿瘤者或存在精神异常者;(2)凝血功能异常,或伴有自身免疫系统疾病者;(3)病情恶化或研究期间死亡者。61例患者中男36例,女25例;年龄45~74(58.49±5.61)岁;体质量指数19~31(23.37±3.41)kg·m-2;肿瘤分期:Ⅲb期40例,Ⅳ期21例;病理学分型:鳞状细胞癌34例,腺癌27例;伴有淋巴结转移17例,无淋巴结转移44例。本研究获秦皇岛市第一医院伦理委员会审核批准(编号:2020F029)。
1.2 细胞、主要药物及试剂人NSCLC顺铂耐药细胞株A549/DDP购自中国科学院上海细胞库;TRIzol试剂、反转录试剂盒、SYBR Green master mix购自大连TaKaRa公司,LncRNA HOXA11反义RNA HOXA11-AS过表达质粒、pcDNA3.1载体购自北京华大基因公司,噻唑蓝 (methyl thiazolyl tetrzaolium,MTT)试剂盒购自美国Thermo Fisher公司,磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)抗体购自美国Cell Signaling Technology公司,β-actin抗体购自美国Proteintech公司。
1.3 细胞培养将A549/DDP细胞置于含体积分数10%胎牛血清(fetal bovine serum,FBS)的达尔伯克改良伊格尔培养基(Dulbeco′s modified Eagle′s medium,DMEM)中进行培养,每100 mL培养液中加入青霉素(100 kU·L-1)和链霉素(100 mg·L-1)各1 mL。取对数生长期细胞备用。
1.4 差异表达的LncRNA的筛选及验证采用经皮肺穿刺方法获取NSCLC患者的肺癌组织及癌旁组织(距离病灶>3 cm),生理盐水冲洗2~3次,放入RNA保存液内,置于4 ℃冰箱中24 h,然后转移至-80 ℃冰箱中。分别提取肺癌组织和癌旁组织的总RNA,并进行纯化和质量监测,去除核糖体RNA并构建文库,应用Illumina Hiseq 4000完成测序;对原始测序数据进行质量控制后,完成RNA表达定量分析[8-9]。然后采用Cufflinks进行LncRNA表达定量分析,筛选出差异表达的LncRNA。取筛选出的差异表达LncRNA常规进行基因本体(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析[10],然后采用定量聚合酶链式反应验证差异表达的LncRNA的表达量。
1.5 细胞生物学特性测定
1.5.1 细胞转染将筛选出的差异表达LncRNA HOXA11-AS克隆于pcDNA3.1载体上进行质粒构建[11],采用无内毒素试剂盒提取质粒,转染A549/DDP细胞,建立稳定转染HOXA11-AS(HOXA11-AS转染组)或空载体的细胞系(对照组)。
1.5.2 MTT法检测2组细胞增殖能力取HOXA11-AS转染组和对照组细胞接种于96孔板,每孔铺2 000个细胞,每孔液体总量200 μL,铺板完成后在含体积分数5%CO2、37 ℃培养箱中培养,细胞贴壁后每孔加入 20 μL MTT溶液,在含体积分数5%CO2、37 ℃培养箱中孵育3~4 h后,小心吸去上清,加入150 μL二甲基亚砜溶液。在多功能摇床上摇晃10 min,使用酶标仪检测各孔570 nm波长处的吸光度值,连续检测 5 d[12]。实验重复3次,取平均值。吸光度值越大,代表细胞增殖能力越大。
1.5.3 划痕愈合实验检测2组细胞迁移能力HOXA11-AS转染组和对照组各取1×105个细胞,接种于6孔板,每组设3个复孔,置入含体积分数5%CO2、37 ℃培养箱中,待细胞长满后,用200 μL的移液器吸头尖端垂直划线,然后用磷酸缓冲盐溶液洗去细胞碎片,加入无血清的DMEM,再次置入培养箱内;分别于0、24 h用倒置显微镜对各孔的划线位置进行拍照[13],用Image J软件对空白区域的面积进行测定,并计算出细胞迁移率。细胞迁移率=(0 h 的空白面积-24 h的空白面积)/0 h的空白面积×100%。细胞迁移率越高表示细胞迁移能力越强。实验重复3次,取平均值。
1.5.4 Transwell法检测2组细胞侵袭能力取HOXA11-AS转染组和对照组细胞用无血清培养基重悬细胞并计数,调整细胞密度为5×108L-1后备用。预先在Transwell小室下部加入含体积分数10% FBS的DMEM 600 μL,在Transwell小室上部分别加入2组细胞悬液200 μL;待细胞下沉至小室底膜后,再将整体小室放入培养箱中培养 12 h。 然后取出培养基,加入40 g·L-1多聚甲醛固定10 min,磷酸缓冲盐溶液冲洗,体积分数0.1%的结晶紫染色20 min,倒置显微镜下随机观察5个视野的细胞并拍照,计算HOXA11-AS转染组和对照组穿过基底膜的细胞数量[13]。穿过基底膜的细胞数越多表示细胞侵袭能力越强。实验重复3次,取平均值。
1.5.5 Western blot法检测2组细胞中PI3K、AKT信号通路相关蛋白的表达参照文献[14]中的方法测定HOXA11-AS转染组和对照组细胞中PI3K、AKT蛋白的表达。取HOXA11-AS转染组和对照组细胞,分别加入细胞裂解液,4 ℃、12 000 r·min-1离心 20 min后取上清液,进行电泳分离蛋白,将蛋白转移至硝酸纤维素膜上,含50 g·L-1脱脂乳粉的等渗缓冲盐溶液室温封闭1 h,依次加入一抗和二抗,常规完成硝酸纤维素膜洗涤,增强化学发光法显色,胶片扫描后使用Bandscan 5.0软件完成蛋白条带灰度测定。 以目的蛋白的灰度值与内参蛋白(β-actin)的灰度值的比值代表目的蛋白的相对表达量。实验重复3次,取平均值。

2 结果
2.1 肺癌组织和癌旁组织中差异表达的LncRNA共筛选出转录失调的LncRNA 311个,其中表达上调的LncRNA有125个,表达下调的LncRNA有186个。GO分析和KEGG分析结果发现,转录失调的LncRNA主要与细胞黏附、胶原蛋白黏附、细胞分化、细胞外基质组织形成等功能有关。转录组测序结果显示,与mRNA共表达最多的前10个LncRNA分别为RP11-845C23.3、RP1-170O19.14、RP11-276F13.1、AC084809.2、PINK1-AS、RP11-688G15.3、CTD-2561B21.7、HOXA11-AS、RP11-597M12.1、RP5-1024G6.2(图1)。其中HOXA11-AS在肺癌组织中的表达量显著高于癌旁组织,差异有统计学意义(P<0.05);其他9个LncRNA在肺癌组织和癌旁组织中的表达量比较差异无统计学意义(P>0.05)。 因此,选择HOXA11-AS转染A549/DDP细胞进行后续研究。
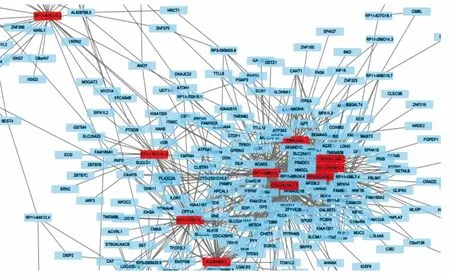
图1 LncRNA与mRNA的共表达网络图Fig.1 Co-expression network diagram of LncRNA and mRNA
2.2 2组细胞增殖能力比较结果见表1。培养1 d 时,2组细胞的增殖能力比较差异无统计学意义(P>0.05);培养2、3、4、5 d时,HOXA11-AS转染组细胞的增殖能力显著高于对照组,差异有统计学意义(P<0.05)。
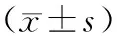
表1 对照组和HOXA11-AS转染组细胞增殖能力比较Tab.1 Comparison of cell proliferation activity between the control group and the HOXA11-AS transfection group
2.3 2组细胞迁移和侵袭能力比较结果见图2、图3和表2。培养0 h 时,2组细胞的迁移率比较差异无统计学意义(P>0.05);培养24 h 时,HOXA11-AS转染组细胞迁移率显著高于对照组,差异有统计学意义(P<0.05)。HOXA11-AS转染组穿过基底膜的细胞数显著多于对照组,差异有统计学意义(P<0.05)。
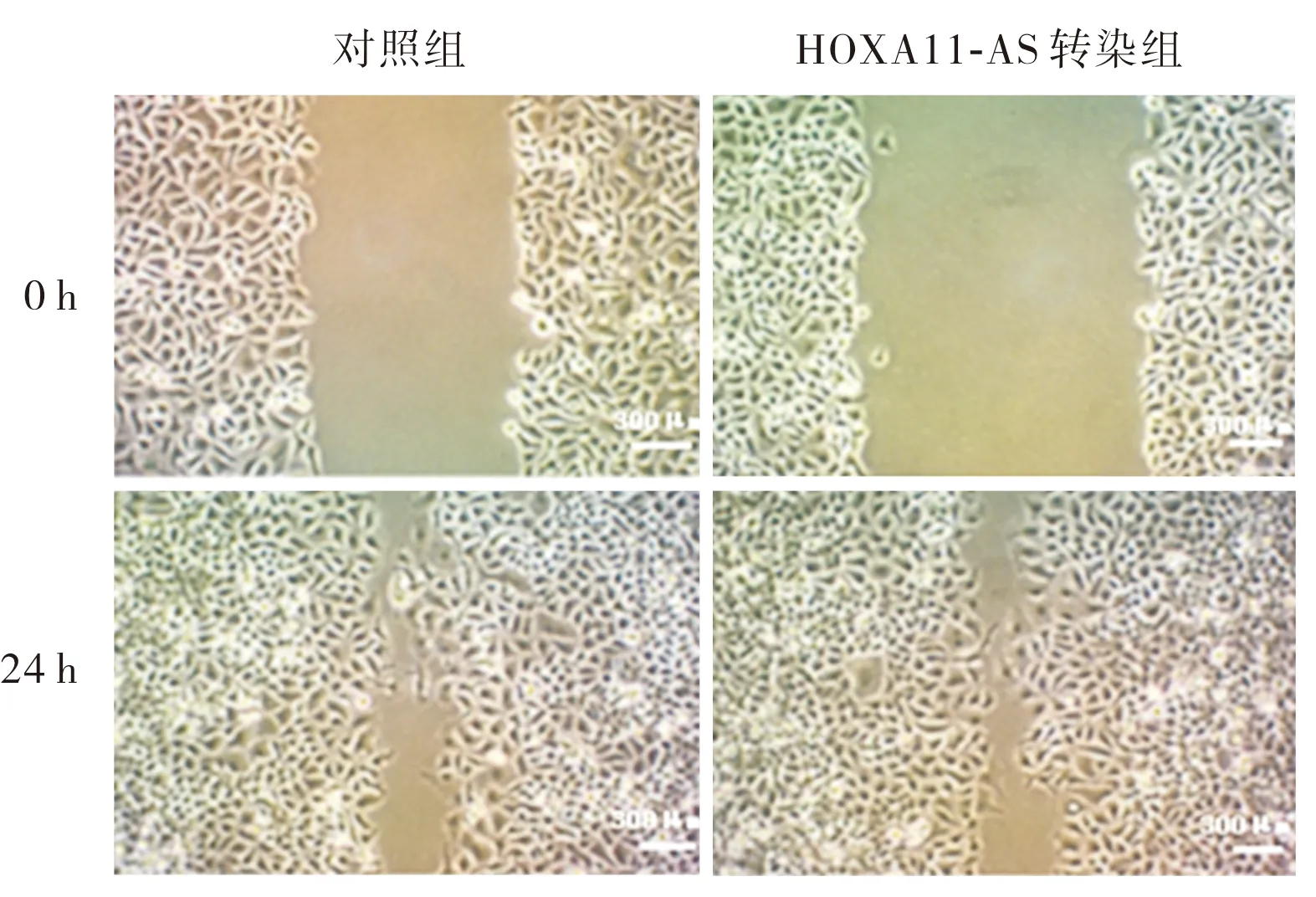
图2 对照组和HOXA11-AS转染组细胞迁移能力 (×33)Fig.2 Migration ability of cells in the control group and the HOXA11-AS transfection group(×33)

图3 对照组和HOXA11-AS转染组细胞侵袭能力 (结晶紫染色,×200)Fig.3 Invasion ability of cells in the control group and the HOXA11-AS transfection group(crystal violet staining,×200)
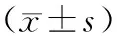
表2 对照组与HOXA11-AS转染组细胞迁移和侵袭能力比较Tab.2 Comparison of migration ability and invasion ability of cells between the control group and the HOXA11-AS transfection group
2.4 2组细胞中PI3K、AKT蛋白相对表达量比较结果见图4和表3。HOXA11-AS转染组细胞中PI3K、AKT蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05)。

图4 对照组和HOXA11-AS转染组细胞中PI3K、AKT蛋白的表达(Western blot)Fig.4 Expression of PI3K,AKT protein in the control group and the HOXA11-AS transfection group(Western blot)
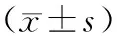
表3 对照组和HOXA11-AS转染组细胞中PI3K、AKT蛋白相对表达量比较Tab.3 Comparison of the relative expression of PI3K,AKT protein between the control group and the HOXA11-AS transfection group
3 讨论
在哺乳动物的基因组中,约有20 000个蛋白质编码基因分散在重复和非转录的序列内,仅部分重要的或与进化相关的基因被转录,而其他大量的非编码RNA被视为转录过程中的“转录噪声”。既往研究表明,LncRNA在具有基因调节功能的非编码RNA中占较高的比例[15]。研究表明,LncRNA存在于细胞质或细胞核内,能直接参与胚胎的发育、物质代谢、物种的进化,亦可参与肿瘤的发生与发展,诸多恶性肿瘤存在LncRNA的异常表达。RNA-seq作为测定全转录组表达的一种新技术,能进一步筛选出差异表达的LncRNA,从而为多种疾病的临床诊疗提供参考依据。本研究中,肺癌组织和癌旁组织中共筛选出311个差异表达LncRNA,其中125个LncRNA的表达上调,186个LncRNA的表达下调。共表达最多的前10个LncRNA中HOXA11-AS在肺癌组织中的表达量显著高于癌旁组织,其余9个在2种组织中的表达量比较差异无统计学意义,因此,选择HOXA11-AS转染的A549/DDP细胞进行后续研究。本研究结果显示,HOXA11-AS转染组细胞在培养2、3、4、5 d时的增殖能力均显著高于对照组;HOXA11-AS转染组细胞的迁移和侵袭能力显著高于对照组; HOXA11-AS转染组细胞中PI3K、AKT蛋白的相对表达量显著高于对照组;说明LncRNA中的HOXA11-AS能有效促进耐药肺癌细胞的增殖、迁移和侵袭,其机制可能与HOXA11-AS激活PI3K/AKT信号通路有关,PI3K/AKT信号通路能通过调控基因表达调节细胞的存活、分化、生长和凋亡等,从而推测LncRNA中HOXA11-AS可能与肺癌耐药的发生、发展存在一定的关系。
HOXA11-AS是同源盒家族基因中的一员,位于染色体7q15.2上。HOXA11-AS能够促进多种肿瘤的增殖和转移,并且与多种肿瘤的侵袭能力相关,在NSCLC中同样有促癌作用[16]。有研究发现,在NSCLC组织中HOXA11-AS的表达显著上调,是正常肺组织中的2.38倍,并且与NSCLC患者的预后相关[17]。关于HOXA11-AS作用机制的研究,目前尚处于早期阶段,其参与肿瘤化学治疗耐药的机制尚不十分明确。WEI等[18]研究显示,HOXA11-AS可促进神经胶质瘤细胞对活性氧的敏感性。LI等[19]研究发现, HOXA11-AS上调后可通过miR-98/PBX3 轴增强鼻咽癌对顺铂的耐药性,为顺铂耐药的鼻咽癌患者提供了潜在的治疗靶点。CHEN等[20]研究发现,敲低HOXA11-AS后可增加卵巢癌细胞中自噬相关蛋白的表达,提高癌细胞对顺铂的敏感性,减少卵巢癌细胞增殖,促进其凋亡。ZHANG等[21]研究表明,肺癌A549细胞中HOXA11-AS敲低后可增加癌细胞对顺铂的敏感性并抑制AKT/β-连环蛋白信号传导,而过表达A549/DDP细胞中的HOXA11-AS后可使癌细胞对顺铂产生抵抗并激活AKT/β-连环蛋白信号传导。
综上所述,转录失调的LncRNA可能参与了NSCLC的发生与发展,其中HOXA11-AS可能激活了PI3K/AKT信号通路,从而影响细胞的增殖、迁移及侵袭能力,本研究结果为NSCLC患者继发耐药的治疗提供了新的思路。

