干酪乳杆菌-山药复合发酵剂对溃疡性结肠炎小鼠肠道菌群的调节及其抗炎作用
朱 瑜,郑 志,2,3,朱绍辉,3,候 栋,3,陈 璇,權英珠,朴丙熙,姜林娟
(1.新乡医学院公共卫生学院/新乡市医药微生物应用技术重点实验室,河南 新乡 453003;2.韩陵医药研究院有限公司,江苏 南京 211100;3.新乡医学院第一附属医院新乡市肥胖及2型糖尿病诊疗研究与医学转化重点实验室,河南 卫辉 453100;4.梨花女子大学药学院,韩国 首尔 04393;5.莱帕坚公司,韩国 首尔 04393)
溃疡性结肠炎(ulcerative colitis,UC)是一种常见的慢性复发性疾病,主要症状为腹泻、腹痛、黏液脓血便,且多伴有营养不良,其机制与炎症活动、肠内营养流失、营养吸收障碍、代谢紊乱等有关[1-2]。到目前为止,还没有根除UC的治疗方案。最新研究证实,针对UC患者应先考虑改善肠道菌群平衡、营养不良,才能缓解结肠炎症状,从而改善治疗结局[3]。山药是具有营养价值的药食同源食材,含多糖、薯蓣皂苷元等营养成分,具有补脾养胃、增强免疫力等功能;中药学认为,UC治疗可选用性质较为温和的山药。但山药的开发和利用存在局限性,目前如何提高山药利用价值仍是主要挑战[4]。本课题组前期研究证实,益生菌体外接种复合发酵方案可抑制肠道内的致病菌,提高肠道免疫力,对多种慢性疾病有改善作用[5-8]。干酪乳杆菌(Lactobacilluscasei)不仅具有降低胆固醇和血压、增强人体免疫及预防癌症等功效,还能促进营养物质的吸收,可用于预防或治疗肠道微生物群紊乱相关疾病[9]。基于此,本研究应用干酪乳杆菌SJP6841L2菌(KCCM10729P)制作干酪乳杆菌与山药复合发酵剂,探讨其对2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzene-sulfonic acid,TNBS)诱导的UC小鼠肠道菌群平衡的影响及抗炎作用,为提高山药利用价值及制定防治慢性UC患者的营养膳食策略奠定基础和理论依据。
1 材料与方法
1.1 实验动物和细菌60只无特定病原体级5周龄雄性BALB/C小鼠购自北京维通利华实验动物技术有限公司,体质量(19.8±1.6)g。饲养环境为温度(22±2) ℃、湿度(55±8)%,正常饮食,光/暗周期12 h/12 h。所有动物实验操作符合新乡医学院伦理委员会要求。干酪乳杆菌SJP6841L2(KCCM10729P)由韩国莱帕坚公司赠送。
1.2 主要试剂和仪器山药产于河南焦作,普通灭菌饲料、垫料购自北京维通利华实验动物技术有限公司,TNBS购自西格玛奥德里奇(上海)有限公司,API 50 CHL Medium菌株快速鉴定试剂盒购自法国梅里埃公司,益生菌选择性培养基、菌株选择性培养基亚硫酸铋琼脂和乳酸杆菌选择性培养基购自青岛海博生物公司,乙酸、丙酸、丁酸标准品购自德国Sigma公司,密封蛋白1(claudin 1)、闭锁小带蛋白-1(zonula occludens-1,ZO-1)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗和二抗购自美国圣克鲁斯生物技术公司,血红素加氧酶-1(heme oxygenase-1,HO-1)、核因子-κB (nuclear factor kappa B,NF-κB)、白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自美国Biolegend公司;HH.CP-T01A型CO2细胞培养箱购自杭州川一实验仪器有限公司,SX-300型高温高压灭菌锅购自日本Tomy公司,CX21型光学生物显微镜购自日本奥林巴斯公司,HZQ-F160A型恒温震荡培养箱购自上海一恒科学仪器有限公司,754型紫外可见分光光度计购自上海菁华科技仪器有限公司,FD-1型压盖冷冻干燥机购自北京博医康实验仪器有限公司,UV-2100型紫外分光光度计购自郑州南北仪器设备有限公司,5804R型高速冷冻离心机购自德国Eppendorf公司,HR-2型手持式组织匀浆机购自上海泸析实业有限公司,VITEK2全自动细菌鉴定仪购自法国梅里埃公司,7890型气相色谱仪、DB-FFAP毛细管柱购自美国安捷伦公司。
1.3 实验方法
1.3.1 干酪乳杆菌-山药复合发酵剂和无发酵山药剂制作将干酪乳杆菌放入乳酸细菌培养基,37 ℃下培养48 h后进行活化备用。山药粉末制备:在300 g 山药中加入1.5 L蒸馏水,95 ℃下灭菌1 h,冷冻、干燥后获得山药粉末,保存于-20 ℃冰箱备用。干酪乳杆菌-山药复合发酵粉末制备:将山药粉末放入干酪乳杆菌混合液中,调整菌数为8×109CFU·L-1,37 ℃ 发酵 3 d,每天检测pH值和酸碱度;发酵结束后,经过滤、冷冻、干燥后获得干酪乳杆菌-山药复合发酵粉末,保存于-20 ℃冰箱备用。
1.3.2 动物分组及模型制备将60只小鼠随机分为空白对照组、UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组、高剂量复合发酵剂组,每组10只。小鼠适应性饲养1周后开始制备UC模型。取250 mL TNBS(100 mg·kg-1)溶解到体积分数50%乙醇中制备TNBS溶液。UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组、高剂量复合发酵剂组小鼠腹腔注射戊巴比妥钠进行麻醉,用2 mm硅胶导管插入小鼠肛门内8 cm 处注入TNBS溶液,并提起小鼠尾巴,持续倒置2 min,第2天,小鼠出现粪便潜血、腹泻、体质量下降判定为造模成功[5]。空白对照组小鼠经肛门注射体积分数50%乙醇。造模成功后,空白对照组、UC模型组小鼠每天经口灌胃生理盐水(10 mL·kg-1),山药对照组小鼠每天经口给予200 mg·kg-1无发酵山药剂灌胃,低剂量复合发酵剂组、中剂量复合发酵剂组、高剂量复合发酵剂组每天经口分别给予50、100、200 mg·kg-1干酪乳杆菌-山药复合发酵剂灌胃,持续10 d。
1.3.3 观察并记录小鼠一般肠炎情况每天同一时间监测小鼠体质量,观察小鼠黏液脓血便、腹泻等情况。
1.3.4 组织取材各组小鼠于实验第11天用乙醚麻醉,开腹,心脏取血,取结肠组织。观察结肠组织水肿、出血、损伤程度,记录结肠长度和重量;取距离肛门1 cm肠组织,用磷酸盐缓冲液(pH 7.4)洗3次,-70 ℃保存;剩余结肠组织于40 g·L-1多聚甲醛溶液中固定3 d,备用。
1.3.5 苏木精-伊红(hematoxylin-eosin,HE)染色观察各组小鼠结肠组织病理学变化取固定后的结肠组织,乙醇脱水,再次经乙醇、二甲苯脱水,石蜡包埋,5 μm 切片,行HE染色,在光学显微镜下观察结肠组织的病理学变化。
1.3.6 紫外分光光度法检测各组小鼠结肠组织中髓过氧化酶(myeloperoxidase,MPO)活性取-70 ℃冰箱保存的结肠组织,加入含体积分数0.5%十六烷基三甲基溴化铵的磷酸盐缓冲液50 mL,用手持式组织匀浆机每30 s匀浆1次,重复3次。匀浆后的结肠组织于-70 ℃条件下冷冻3 h,37 ℃下解冻,重复3次。组织匀浆液12 000×g离心15 min,取100 μL上清液,加入2.4 mL 60 mmol·L-1磷酸盐缓冲液(pH 6.0),25 ℃下反应10 min,加入500 μL叠氮化钠(1.0 g·L-1)终止反应,应用紫外分光光度计在460 nm处测定吸光度值计为OD1,1 min后再次测定计为OD2,持续5 min,计算MPO平均值[MPO平均=(ODn+1- ODn)× 稀释倍数/结肠组织质量]。
1.3.7 ELISA法检测各组小鼠结肠组织中IL-8、TNF-α、HO-1和NF-κB的表达水平取1 mg结肠组织匀浆,生理盐水稀释10倍,应用IL-8、TNF-α、HO-1、NF-κB ELISA试剂盒检测HO-1、NF-κB、IL-8、TNF-α表达水平,严格按照试剂盒说明书步骤进行操作。
1.3.8 Western blot检测各组小鼠结肠组织中claudin 1和ZO-1蛋白表达取匀浆后的结肠组织2 mg,用蛋白定量试剂计算蛋白浓度;取50 μg蛋白,经质量分数10%聚丙烯酰胺凝胶电泳后,蛋白转印到聚偏二氟乙烯膜,加claudin 1、ZO-1、GADPH一抗(滴度11 000),室温下过夜,三氨基甲烷缓冲液洗涤 3次,加辣根过氧化物酶标记羊抗鼠IgG 2 h,再用三氨基甲烷缓冲液洗涤3次,滴加增强电化学发光液,在曝光仪上显影,以GADPH为内参,使用Image J软件对蛋白条带灰度值进行定量分析。以目的蛋白灰度值与内参蛋白灰度值比值表示目的蛋白相对表达量。
1.3.9 细菌生理生化鉴定法检测各组小鼠结肠肠道中双歧杆菌、乳酸杆菌、拟杆菌和肠杆菌数量取小鼠结肠内容物约0.5 g,用无菌生理盐水稀释至10、100、1 000倍,取100 μL原液和各稀释液,使用菌株快速鉴定试剂盒对菌株进行分离、筛选后,用全自动细菌鉴定仪鉴定菌株,测定方法参照检测试剂盒说明书。鉴定后的双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌分别接种于选择性培养基平板上,厌氧菌在厌氧恒温培养箱、好氧菌在具有供养装置的恒温培养箱中培养24 h,用显微镜观察生成菌落数,计算各组菌株数和双歧杆菌/肠杆菌(B/E)值。
1.3.10 气相色谱法检测各组小鼠结肠肠道中乙酸、丙酸和丁酸水平取1 g小鼠结肠内容物,加入1 mL 体积分数 10%的硫酸溶液进行酸化,再加入5 mL 丙酮,震荡,12 000×g离心5 min,取上清液,应用气相色谱法检测肠道中乙酸、丙酸、丁酸水平,分析条件如下:载气为流速0.75 mL·min-1的氦气,进样器温度为220 ℃,离子源和界面温度为250 ℃。加热箱初始温度为90 ℃(2 min),温度以每分钟5 ℃升至 80 ℃,然后以每分钟10 ℃升至200 ℃,最后以每分钟20 ℃升至250 ℃。以乙酸、丙酸、丁酸标准品绘制标准曲线,以标准曲线的浓度和峰面积计算样品中乙酸、丙酸、丁酸水平,结果以μmol·g-1表示。
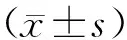
2 结果
2.1 干酪乳杆菌-山药复合发酵剂发酵前后菌数和pH值比较干酪乳杆菌-山药复合发酵剂溶解液初始、发酵第4 天pH值分别为5.9±0.1、3.7±0.1,初始pH值显著高于发酵第4 天,差异有统计学意义(t=66.000,P=0.000);干酪乳杆菌-山药复合发酵剂初始、发酵第4 天总菌数分别为(1.4±0.2)、(8.2±0.2) logCFU·mL-1,发酵第4 天总菌数较初始总菌数增长了(17.8±0.7)倍,差异有统计学意义(t=102.000,P=0.000)。
2.2 6组小鼠一般症状及结肠组织病理变化UC模型组小鼠结肠出现多发小溃疡、水肿、肠壁粘连及出血。山药对照组和低剂量复合发酵剂组小鼠结肠出现部分水肿,中剂量复合发酵剂组小鼠结肠出现轻微水肿,高剂量复合发酵剂组和空白对照组小鼠结肠无水肿、溃疡、血便、腹泻等肠炎症状。UC模型组小鼠第2天出现腹泻、血便、食欲下降等症状,毛发凌乱、呆滞、反应迟钝等反应。山药对照组和中剂量复合发酵剂组小鼠的症状在第3天出现好转;8 d后,小鼠体质量无明显变化,毛发光泽度、大便情况、活跃度、饮食、精神状态良好,与空白对照组小鼠比较无明显差别。
2.3 6组小鼠结肠组织的长度、厚度、重量比较结果见表1。UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组小鼠结肠的长度显著短于空白对照组和高剂量复合发酵剂组,结肠厚度显著厚于空白对照组和高剂量复合发酵剂组,结肠重量显著大于空白对照组和高剂量复合发酵剂组,差异有统计学意义(P<0.05)。空白对照组与高剂量复合发酵剂组小鼠结肠的长度、厚度、重量比较差异无统计学意义(P>0.05)。山药对照组和中剂量复合发酵剂组小鼠结肠的长度显著长于UC模型组和低剂量复合发酵剂组,结肠厚度、重量显著小于UC模型组和低剂量复合发酵剂组,差异有统计学意义(P<0.05)。山药对照组与中剂量复合发酵剂组小鼠结肠的长度、厚度、重量比较差异无统计学意义(P>0.05);UC模型组与低剂量复合发酵剂组小鼠结肠的长度、厚度、重量比较差异无统计学意义(P>0.05)。
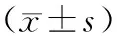
表1 6组小鼠结肠的长度、厚度和重量比较Tab.1 Comparison of length,thickness and weight of colon of mice among the six groups
2.4 6组小鼠结肠组织病理变化结果见图1。空白对照组和高剂量复合发酵剂组小鼠结肠黏膜上皮组织完整清晰,隐窝、杯状细胞无损伤,无炎症细胞浸润,无溃疡面。UC模型组小鼠结肠的隐窝、杯状细胞丢失,大量炎症细胞浸润,黏膜上皮组织完全损伤。山药对照组和低剂量复合发酵剂组小鼠结肠组织中仍有大量炎症细胞浸润和轻微溃疡面,部分隐窝、杯状细胞出现损伤,部分黏膜上皮组织损伤。低剂量复合发酵剂组小鼠结肠组织中有少量炎症细胞浸润,隐窝、杯状细胞清晰,黏膜及结肠组织结构完整。

A:空白对照组(×40);B:UC模型组(×10);C:山药对照组(×10);D:低剂量复合发酵剂组(×10);E:中剂量复合发酵剂组(×10);F:高剂量复合发酵剂组(×20)。图 1 6组小鼠结肠组织病理学(HE染色)Fig.1 Histopathology of colon tissues of mice in the six groups(HE staining)
2.5 6组小鼠结肠组织中IL-8、TNF-α、NF-κB、HO-1水平及MPO活性比较结果见表2。UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α、NF-κB、HO-1 水平及MPO活性显著高于空白对照组和高剂量复合发酵剂组,差异有统计学意义(P<0.05)。空白对照组与高剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α、NF-κB、HO-1水平及MPO活性比较差异无统计学意义(P>0.05)。山药对照组和中剂量复合发酵剂组小鼠结肠组织中TNF-α、NF-κB、HO-1水平及MPO活性显著低于UC模型组和低剂量复合发酵剂组,差异有统计学意义(P<0.05)。山药对照组与中剂量复合发酵剂组及UC模型组与低剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α、NF-κB、HO-1水平及MPO活性比较差异无统计学意义(P>0.05)。
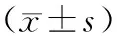
表2 6组小鼠结肠组织中IL-8、TNF-α、NF-κB、HO-1水平和MPO活性比较Tab.2 Comparison of the levels of IL-8,TNF-α,NF-κB,HO-1 and activity of MPO in colon tissues of mice among the six groups
2.6 6组小鼠结肠组织中claudin 1和ZO-1蛋白表达水平比较结果见图2和表3。UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量显著低于空白对照组和高剂量复合发酵剂组,差异有统计学意义(P<0.05)。空白对照组与高剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量比较差异无统计学意义(P>0.05)。山药对照组和中剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量显著高于UC模型组和低剂量复合发酵剂组,差异有统计学意义(P<0.05)。山药对照组与中剂量复合发酵剂组及UC模型组与低剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量比较差异无统计学意义(P>0.05)。
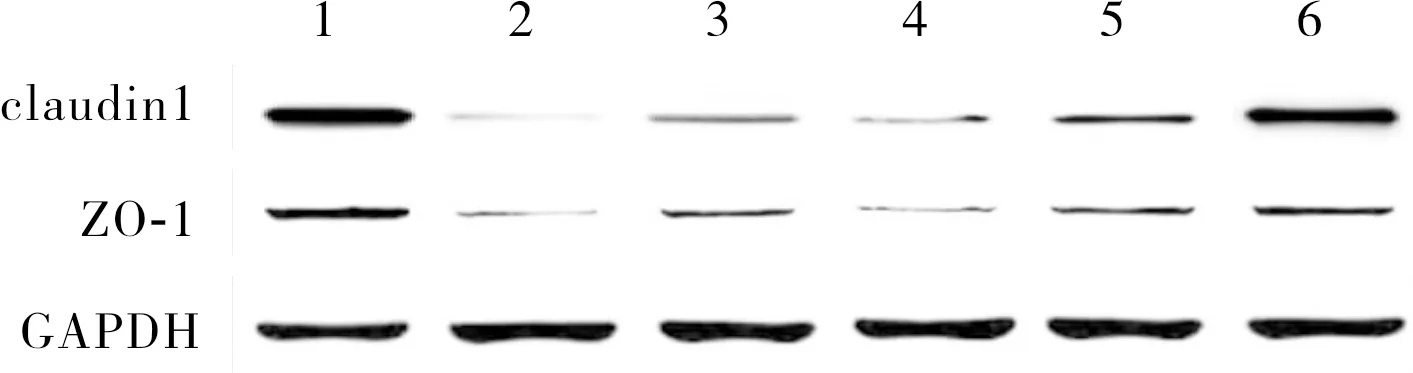
1:空白对照组;2:UC模型组;3:山药对照组;4:低剂量复合发酵剂组;5:中剂量复合发酵剂组;6:高剂量复合发酵剂组。图 2 6组小鼠结肠组织中claudin 1和ZO-1蛋白表达Fig.2 Expressions of claudin 1 and ZO-1 protein in colon tissues of mice among the six groups
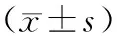
表3 6组小鼠结肠组织中claudin 1和ZO-1蛋白相对表达量比较Tab.3 Comparison of the relative expression of claudin 1 and ZO-1 protein in colon tissues of mice among the six group
2.7 6组小鼠结肠肠道中双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌数及B/E值比较结果见表4。UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组小鼠结肠肠道中双歧杆菌、乳酸杆菌数及B/E值显著低于空白对照组和高剂量复合发酵剂组,拟杆菌、肠杆菌数显著高于空白对照组和高剂量复合发酵剂组,差异有统计学意义(P<0.05)。空白对照组与高剂量复合发酵剂组小鼠结肠肠道中双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌数及B/E值比较差异无统计学意义(P>0.05)。山药对照组和中剂量复合发酵剂组小鼠结肠肠道中乳酸杆菌数及B/E值显著高于UC模型组和低剂量复合发酵剂组,拟杆菌、肠杆菌数显著低于空白对照组和高剂量复合发酵剂组,差异有统计学意义(P<0.05)。山药对照组与中剂量复合发酵剂组及UC模型组与低剂量复合发酵剂组小鼠结肠肠道中双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌数及B/E值比较差异均无统计学意义(P>0.05)。
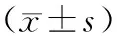
表4 6组小鼠结肠肠道中双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌数及B/E值比较Tab.4 Comparison of the number of bifidobacterium,lactobacilli,bacteroides,enterobacteria and B/E value in intestinal tract of colon of mice among the six groups
2.8 6组小鼠结肠肠道中乙酸、丙酸及丁酸水平比较结果见表5。UC模型组、山药对照组、低剂量复合发酵剂组和中剂量复合发酵剂组小鼠肠道中乙酸、丙酸、丁酸水平显著低于空白对照组和高剂量复合发酵剂组,差异有统计学意义(P<0.05)。空白对照组与高剂量复合发酵剂组小鼠肠道中乙酸、丙酸、丁酸水平比较差异无统计学意义(P>0.05)。山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组小鼠肠道中乙酸水平显著高于UC模型组,差异有统计学意义(P<0.05)。山药对照组和中剂量复合发酵剂组小鼠肠道中丙酸水平显著高于UC模型组,差异有统计学意义(P<0.05)。中剂量复合发酵剂组小鼠肠道中丁酸水平显著高于UC模型组,差异有统计学意义(P<0.05)。山药对照组和中剂量复合发酵剂组小鼠肠道中乙酸、丙酸水平显著高于低剂量复合发酵剂组,差异有统计学意义(P<0.05)。山药对照组与中剂量复合发酵剂组小鼠肠道中乙酸、丙酸水平比较差异无统计学意义(P>0.05)。中剂量复合发酵剂组小鼠肠道中丁酸水平显著高于山药对照组和低剂量复合发酵剂组,差异有统计学意义(P<0.05)。
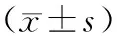
表5 6组小鼠结肠肠道中乙酸、丙酸及丁酸水平比较Tab.5 Comparison of the levels of acetic acid,propionic acid and butyric acid in intestinal tract of colon of mice among the six groups
3 讨论
有研究发现,干酪乳杆菌可有效预防或治疗肠道微生物群紊乱相关疾病,在食品发酵工程及生物医药领域受到广泛关注[9]。益生菌以山药低聚糖作为碳源,分泌酸性化合物、细菌素、苯乳酸等多种抑菌活性物质,并促进益生菌进一步增殖。本研究首次利用干酪乳杆菌(SJP6841L2)制作干酪乳杆菌与山药发酵混合剂,结果发现,干酪乳杆菌与山药发酵后,总菌数较初始总菌数增长(17.8±0.7)倍,且微环境偏于酸性(pH 3.7),说明山药的营养物质和酸性条件能够促进干酪乳杆菌生长和增殖。有研究报道,干酪乳杆菌可产生有机酸物质,降低周围环境的pH值,形成酸性微环境[10],这与本研究结果一致。
山药含有丰富的多糖、皂苷类、氨基酸、维生素、脂肪酸等营养成分,具有抗炎、调节免疫、降血糖、抗肿瘤、抗氧化、抑菌等多种生物学功能。而UC患者的肠道黏膜机械屏障受损、通透性增高、细胞微环境遭到破坏、黏膜缺血和缺氧,导致营养成分吸收障碍、吸收不充分、营养丢失。益生菌作为活性有益微生菌,对胆汁酸和低pH值环境具有耐受能力,可提高肠道细胞外消化能力、增加肠道吸收转运载体的表达及维持肠道黏膜屏障。此外,益生菌能增加绒毛高度、增加隐窝深度、降低上皮电阻,维护肠上皮结构完整性,促进营养物质吸收。本研究结果显示,空白对照组和高剂量复合发酵剂组小鼠结肠长度显著长于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组,结肠厚度显著小于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组,结肠组织的重量显著低于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组;空白对照组与高剂量复合发酵剂组小鼠结肠组织的长度、厚度、重量比较差异无统计学意义;山药对照组和中剂量复合发酵剂组小鼠结肠长度显著长于UC模型组和低剂量复合发酵剂组,结肠厚度、重量显著小于UC模型组和低剂量复合发酵剂组;山药对照组与中剂量复合发酵剂组小鼠结肠组织的长度、厚度、重量比较差异无统计学意义;UC模型组与低剂量复合发酵剂组小鼠结肠组织的长度、厚度、重量比较差异无统计学意义。这一结果说明,干酪乳杆菌-山药发酵复合发酵剂能改善UC模型小鼠结肠组织损伤,且呈一定剂量关系。此外,本研究结果显示,UC模型组小鼠结肠组织出现多发小溃疡、水肿、肠壁粘连及出血;山药对照组和低剂量复合发酵剂组小鼠结肠组织出现部分水肿,中剂量复合发酵剂组小鼠出现轻微水肿,高剂量复合发酵剂组和正常组小鼠结肠组织无水肿、溃疡,无血便、腹泻等肠炎表现。UC模型组小鼠第2天出现腹泻、血便、食欲下降等症状;山药对照组和中剂量复合发酵剂组小鼠的症状在第3天出现好转,且8 d后小鼠体质量无明显变化,毛发光泽度、大便情况、活跃度、饮食、精神状态良好;这说明,干酪乳杆菌-山药复合发酵剂可改善UC模型小鼠的水肿、溃疡、血便、腹泻等肠炎表现;推测,干酪乳杆菌-山药复合发酵剂可能通过干酪乳杆菌自身生理代谢功效,形成酸性微环境、改善肠道黏膜屏障、恢复肠上皮结构完整性,防止肠道内山药营养成分流失,提高山药药理功效,促进UC的改善。
UC主要发病机制为结肠组织的中性粒细胞浸润,引起肠黏膜组织炎症反应。IL-8可在内皮细胞受到炎症刺激时发挥趋化作用,是溃疡性结肠炎早期复发的生物标志。TNF-α可导致肠道细胞凋亡和炎症反应,引起肠道组织损伤[11]。有研究报道,乳酸芽孢杆菌液处理的山药可显著抑制肠炎小鼠肠道组织中促炎因子TNF-α分泌[12]。本研究结果显示,空白对照组和高剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α水平及MPO活性显著低于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组,空白对照组与高剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α水平及MPO活性比较差异无统计学意义;山药对照组和中剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α水平及MPO活性显著低于UC模型组和低剂量复合发酵剂组,山药对照组与中剂量复合发酵剂组及UC模型组与低剂量复合发酵剂组小鼠结肠组织中IL-8、TNF-α水平及MPO活性比较差异无统计学意义;这说明,与单独山药干预比较,干酪乳杆菌-山药复合发酵剂可显著抑制UC模型小鼠结肠组织中炎症因子水平,从而减轻肠道炎症反应,且呈一定量效关系。NF-κB是免疫调控中一个重要的信号传导因子。UC发生时NF-κB被激活,然后通过信号通路促进氧化应激,并诱导应激刺激相关因子如血红素分解代谢过程中限速酶HO-1的分泌。本研究结果显示,高剂量复合发酵剂组小鼠结肠组织中NF-κB和HO-1水平显著低于UC模型组、山药对照组、低剂量复合发酵剂组和中剂量复合发酵剂组,高剂量复合发酵剂组与空白对照组小鼠结肠组织中NF-κB和HO-1水平比较差异无统计学意义,山药对照组和中剂量复合发酵剂组小鼠结肠组织中NF-κB和HO-1水平显著低于UC模型组和低剂量复合发酵剂组,山药对照组与中剂量复合发酵剂组及UC模型组与低剂量复合发酵剂组小鼠结肠组织中NF-κB和HO-1水平比较差异无统计学意义;这说明,与单独山药干预比较,干酪乳杆菌-山药复合发酵剂能显著降低UC模型小鼠的NF-κB和HO-1表达,且呈一定量效关系,说明其抗炎机制与NF-κB/HO-1信号通路有关[13]。此外,本研究结果显示,空白对照组和高剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量显著高于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组,空白对照组与高剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量比较差异无统计学意义,山药对照组和中剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量显著高于UC模型组和低剂量复合发酵剂组,山药对照组与中剂量复合发酵剂组及UC模型组和低剂量复合发酵剂组小鼠结肠组织中claudin 1、ZO-1蛋白相对表达量比较差异无统计学意义,说明,干酪乳杆菌-山药复合发酵剂能显著促进UC模型小鼠肠道组织中ZO-1[14]和claudin 1[15]蛋白的表达,降低肠黏膜通透性、维持肠上皮内环境稳定、有效保护肠黏膜屏障,从而修复肠道组织[16]。
肠道最重要的益生菌是双歧杆菌和乳酸杆菌[17-18]。临床研究发现,UC患者肠道中双歧杆菌和乳酸菌数量显著少于健康人群,说明肠道益生菌群失衡与UC具有重要关系[19]。有研究也证实,补充双歧杆菌可显著降低中度活动期溃疡性肠炎老年患者结肠组织中IL-6、TNF-α表达,说明肠道内有益菌增加可缓解或改善UC的发生和发展。本研究结果显示,空白对照组和高剂量复合发酵剂组小鼠肠道中双歧杆菌、乳酸杆菌数及B/E值显著高于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组,拟杆菌、肠杆菌数显著低于UC模型组、山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组;空白对照组与高剂量复合发酵剂组小鼠肠道中双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌数及B/E 值比较差异无统计学意义;山药对照组和中剂量复合发酵剂组小鼠肠道中乳酸杆菌数及B/E值显著高于UC模型组和低剂量复合发酵剂组,拟杆菌、肠杆菌数显著低于空白对照组和高剂量复合发酵剂组;山药对照组和中剂量复合发酵剂组小鼠肠道中双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌数及B/E值比较差异无统计学意义;这说明,干酪乳杆菌-山药复合发酵剂能显著提高UC小鼠肠道中双歧杆菌和乳酸杆菌,降低拟杆菌、肠杆菌数,使其B/E值恢复到正常水平,从而调节肠道菌群平衡。
益生菌通过代谢能合成多种生物酶和氨基酸等人体必需营养元素,参与肠道中营养物质的消化和吸收[20-21]。本研究结果显示,UC模型组、山药对照组、低剂量复合发酵剂组和中剂量复合发酵剂组小鼠肠道中乙酸、丙酸、丁酸水平显著低于空白对照组和高剂量复合发酵剂组;空白对照组与高剂量复合发酵剂组小鼠肠道中乙酸、丙酸、丁酸水平比较差异无统计学意义;山药对照组、低剂量复合发酵剂组、中剂量复合发酵剂组小鼠肠道中乙酸水平显著高于UC模型组;山药对照组和中剂量复合发酵剂组小鼠肠道中丙酸水平显著高于UC模型组;中剂量复合发酵剂组小鼠肠道中丁酸水平显著高于UC模型组;山药对照组和中剂量复合发酵剂组小鼠肠道中乙酸、丙酸水平显著高于低剂量复合发酵剂组;山药对照组与中剂量复合发酵剂组小鼠肠道中乙酸、丙酸水平比较差异无统计学意义;中剂量复合发酵剂组小鼠肠道中丁酸水平显著高于山药对照组和低剂量复合发酵剂组;这说明,干酪乳杆菌-山药复合发酵剂较单一山药干预能更显著地促进乙酸、丙酸、丁酸等氨基酸分泌,调节肠道菌群。因此认为,干酪乳杆菌SJP6841L2与山药体外发酵,可促进山药的分解并提高营养成分吸收,从而提高山药膳食利用价值,但该作用机制有待进一步深入探讨。
总之,本研究制备的干酪乳杆菌与山药发酵复合发酵剂,能显著抑制肠道组织中IL-8、TNF-α表达及MPO活性,促进肠道上调紧密连接蛋白表达及短链脂肪酸产生,调节UC肠道菌群平衡,从而达到改善UC的目的,这为制定根除治疗UC的山药营养膳食策略提供依据。

