糖皮质激素联合MTX和单纯激素治疗中重度活动期甲状腺相关眼病的比较研究
钟思思 方思捷 孙静 李寅炜 周慧芳
甲状腺相关眼病(thyroid-associated ophthalmopathy,TAO)是弥漫性甲状腺肿伴甲状腺功能亢进症(Graves diseases,GD)最常见的甲状腺外表现,发病率居成人眼眶疾病首位[1]。病变累及眼眶球后组织,可导致眼球突出、眼睑退缩、斜视、复视,甚至暴露性角膜炎和压迫性视神经病变[2]。根据疾病临床症状的严重程度,TAO可以分为轻度、中重度和极重度;根据疾病的进程,TAO可分为活动期和静止期[3]。静脉激素冲击方案是目前中重度活动期TAO的首选治疗,然而只对部分(30%~50%)患者有效,还有超过半数患者对激素治疗不敏感或不耐受[4]。现有研究提示甲氨蝶呤(methotrexate,MTX)对活动期TAO患者有效,但相关研究入组标准不统一,用药方案和评价标准不同,缺乏前瞻性临床随机对照研究,难以系统评价MTX在活动期TAO治疗中的作用。本研究通过前瞻性随机对照研究,比较了静脉激素冲击联合MTX和单纯静脉冲击在治疗中重度活动期TAO中的作用,评价了二者的有效性和安全性,为制定中重度活动期TAO治疗规范提供循证医学证据。
资料与方法
一、一般资料
前瞻性随机对照研究。共纳入53例活动期TAO患者,随机化分组,每组患者在性别比例、年龄,吸烟史、甲状腺疾病史、临床活动性评分(clinical activity score,CAS)、睑裂高度、眼压(intraocular pressure,IOP)、最佳矫正视力(best corrected visual acuity,BCVA)、突眼度方面差异均无统计学意义(P>0.05)。27例患者进入联合治疗组(激素冲击+MTX组),26例患者进入单纯治疗组(激素冲击+口服安慰剂)。在12周的治疗及评估过程中,联合治疗组共5例患者出组,其中1例患者眼部症状加重,进展为极重度,需手术治疗,2例患者不耐受激素治疗,1例患者出现严重的肝毒性,1例患者失访。单纯治疗组共3例患者出组,其中1例患者不耐受激素治疗,1例患者进展为极重度,1例患者失访(见图1)。最终联合治疗组共22例患者,单纯治疗组共23例患者。具体患者一般资料和临床表现见表1。
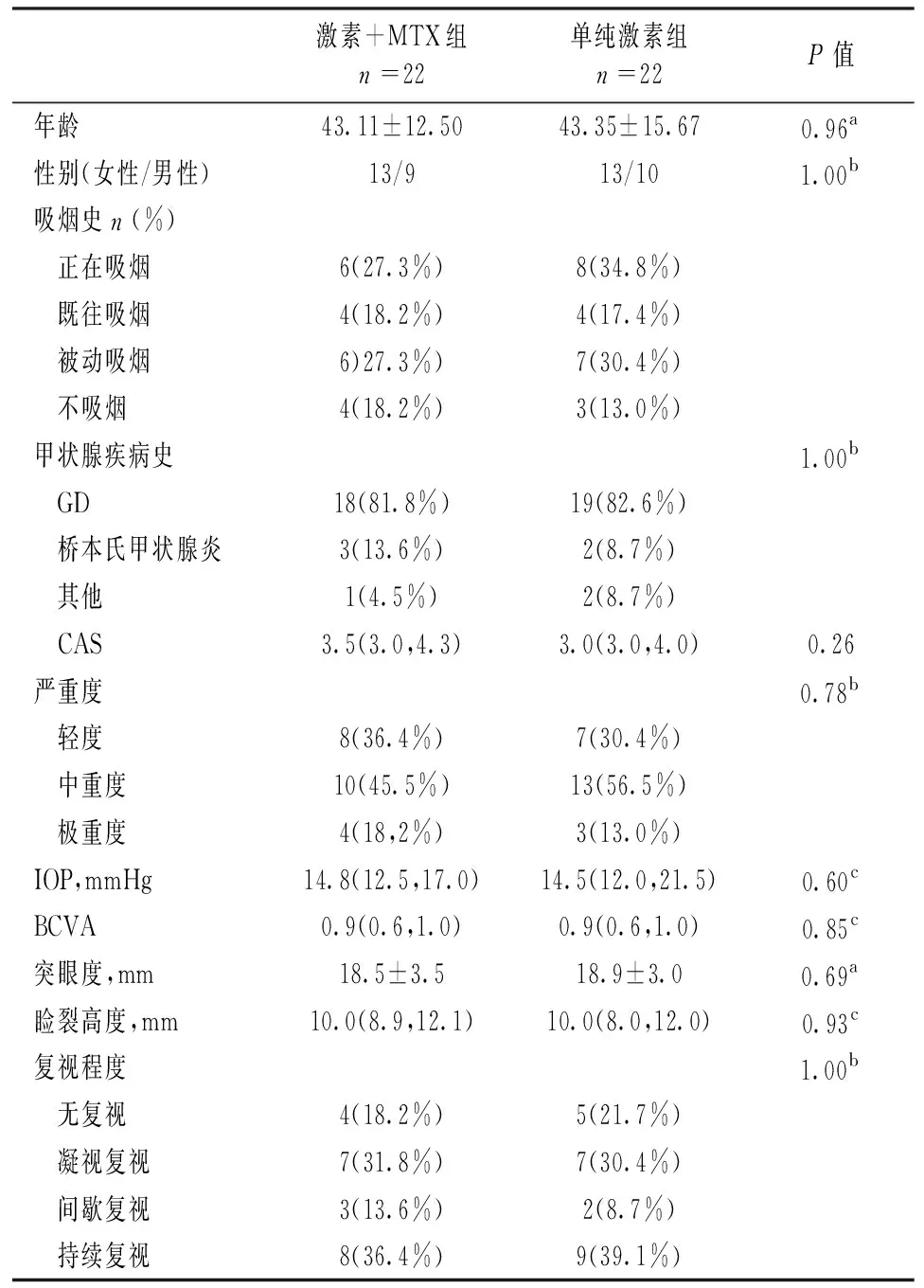
表1 一般资料和临床表现
二、入组标准
选取2020年1月至2021年1月于上海交通大学医学院附属第九人民医院眼科确诊为TAO的患者,经评估后确诊为中重度活动期,年龄18~60岁,体重在40~70 kg之间。入组前1个月内甲状腺功能正常:包括正在服用抗甲亢药物或无需服用药物者;临床活动性和严重性的评估采用EUGOGO指南中的疾病分期分级标准:(1)活动期标准:采用CAS评分,共7项: 眼睑充血、眼睑水肿、结膜充血、结膜水肿、自发性球后疼痛,凝视或眼球活动时疼痛和眼部炎性反应,每项计1分,≥3分评定为活动期;(2)中重度标准:(具备以下至少一项表现)眼睑退缩≥2 mm、突眼度超过正常上线至少3 mm、非持续性或持续性复视、中重度软组织损害、甲状腺功能异常伴视神经病变和(或)伴角膜脱落。
三、分组设计
采用单盲RCT研究方法,对比静脉激素冲击联合MTX和单纯静脉冲击两种治疗方案。研究方案已通过伦理审批(伦理批件号:沪九院伦审查2018~78-T69号)。所有入组患者随机分为两组:联合治疗组进行4.5 g静脉激素冲击方案+口服MTX,单纯治疗组进行4.5 g静脉激素冲击方案+口服安慰剂。具体治疗方案如下:静脉激素冲击治疗:甲基强的松龙500 mg,每周1次×6周后改为250 mg,每周1次×6周(共12周,4.5 g),分别于第6周和第12周进行随访评估,包括眼科检查,临床评估,血液检查,生活质量评分,具体时间见表2。

表2 干预措施及随访时间表
四、眼科评估和结果评价
在治疗前和治疗后第6周,第12周进行眼科检查,包括眼球突出度,睑裂高度,复视程度,IOP, BCVA,CAS评分。眼球突出度采用Hertel突眼计测量仪测量,视力由标准的Snellen视力表测量,复视程度采用同视机检查,眼压由Goldmann压平眼压计测量。
主要指标是总体有效率,有效定义为:总体有效率(符合7项中至少3项则为有效)a.睑裂宽度减小至少3 mm;b. NOSPECS体征分级减少至少2级;c.突眼度减少至少2 mm;d.眼压下降至少2 mmHg;e. CAS评分至少降低至少3分;f.复视和(或)斜视的改善;g.视力的改善至少0.1。加重定义为:a. 睑裂宽度增加至少3 mm; b. NOSPECS体征分级增加至少2级; c. 突眼度增加至少2 mm; d. 眼压增加至少2 mmHg; e.CAS评分增加至少2分; f. 新出现的复视或程度加重; g.视力的下降至少0.1,介于有效和加重之间的定义为不变。记录以下不良反应:主要不良反应包括:(1)库欣综合征;(2)骨髓抑制,白细胞计数下降,诱发或加重感染;(3)精神神经症状;(4)诱发或加重胃溃疡、穿孔、出血;(5)骨质疏松;(6)肝功能异常;(7)激素过敏;于治疗开始后第6周和第12周进行不良反应评估,测量体重、血压、血糖、血脂、肝功能和骨密度,以评估和治疗相关的体重增加、高血压、空腹血糖受损、糖耐量受损、糖尿病、白细胞计数下降、高血脂、肝功能异常、高血钾和高尿酸血症等。
五、统计学分析方法

结 果
一、总体有效率
第6周和第12周评估两组治疗方案的CAS、BCVA,睑裂高度,突眼度、IOP、NOSPECS分级和复视程度的改善/不变/加重,结果见表3。经正态性检验,CAS,BCVA,IOP,睑裂高度值不符合正态分布,突眼度值符合正态分布。
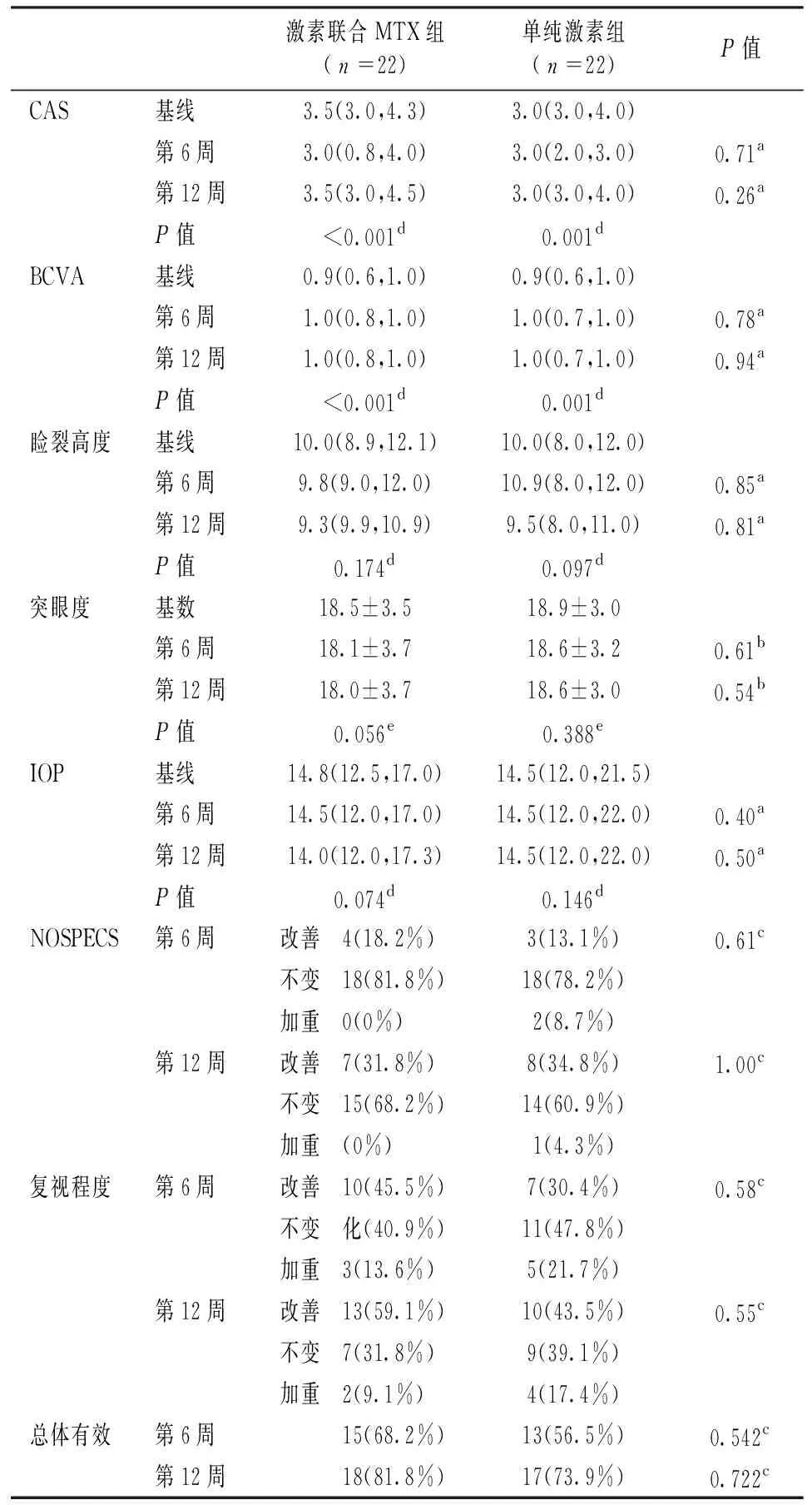
表3 第0周,第6周和第12周眼部评估结果
和第0周水平比较,激素联合MTX组CAS评分在第6周和第12周显著下降(P<0.001),经多重比较,第12周较第0周下降有统计学意义(P=0.039),但第6周较第0周、第6周较第12周差异均无统计学意义(P=0.071,P=1.000)。激素联合MTX组BCVA在第6周和第12周显著提高(P<0.001)。联合组睑裂高度,突眼度和眼压在第6周和第12周无明显改善(P=0.174,P=0.056,P=0.074)。
a示Mann-WhitneyU检验;b示独立样本t检验;c示Fisher精确检验;d示重复测量资料的Friedman检验;e示重复测量资料的方差分析周和第12周无明显改善(P=0.174,P=0.056,P=0.074)。
单纯激素组CAS评分在第6周和第12周均显著下降(P=0.001)。单纯激素组BCVA在第6周和第12周均显著提高(P<0.001),第6周较第0周下降(P=0.045),第12周较第0周下降(P=0.045),但第6周和第12周差异无统计学意义(P=1.00)(图2)。和第0周比较,睑裂高度,突眼度和眼压在第6周和第12周的改善均无统计学意义。经Mann-WhitneyU检验,第6周和第12周结果两组差异无统计学意义。突眼度值满足正态分布,经独立样本t检验,第6周和第12周结果两组差异均无统计学意义。两组NOSPECS改善/不变/加重的比例分布经Fisher精确检验,第6周和第12周结果均无显著差异。总体有效率定义为符合7项中至少3项,激素联合MTX组第6周和第12周的总体有效率分别为68.2%和81.8%;单纯治疗组第6周和第12周的总体有效率分别为56.5%和73.9%,两组的第6周和第12周总体有效率差异均无统计学意义(P=0.542和P=0.722)。
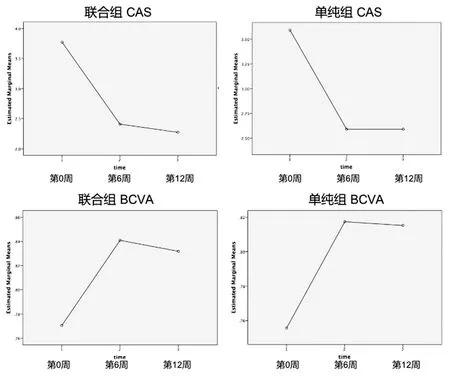
图2 第0周,第6周和第12周联合组和单纯组的CAS和BCVA变化
二、不良反应
主要包括收缩压升高(10~20 mmHg,20~30 mmHg,>30 mmHg),糖代谢异常(空腹血糖受损,口服糖耐量受损和糖尿病),白细胞计数下降(3~4×109/L, 2~3×109/L,<2×109/L),肝功能异常(ALT>40 U/L, ALT>100 U/L, AST>40 U/L, AST>100 U/L,),血脂升高(TC≥6.22 U/L,TG>2.26 U/L,LDL>4.14 U/L, HDL<1 U/L),高血钾和高尿酸血症和高肌酐,结果见表4。在第12周,激素联合MTX组共5例ALT>40 U/L,6例AST>40 U/L,4例AST>100 U/L,单纯激素组仅1例ALT>40U/L,经Fisher精确检验,联合治疗组肝功能异常的比例较单纯激素治疗组高(P<0.001)。
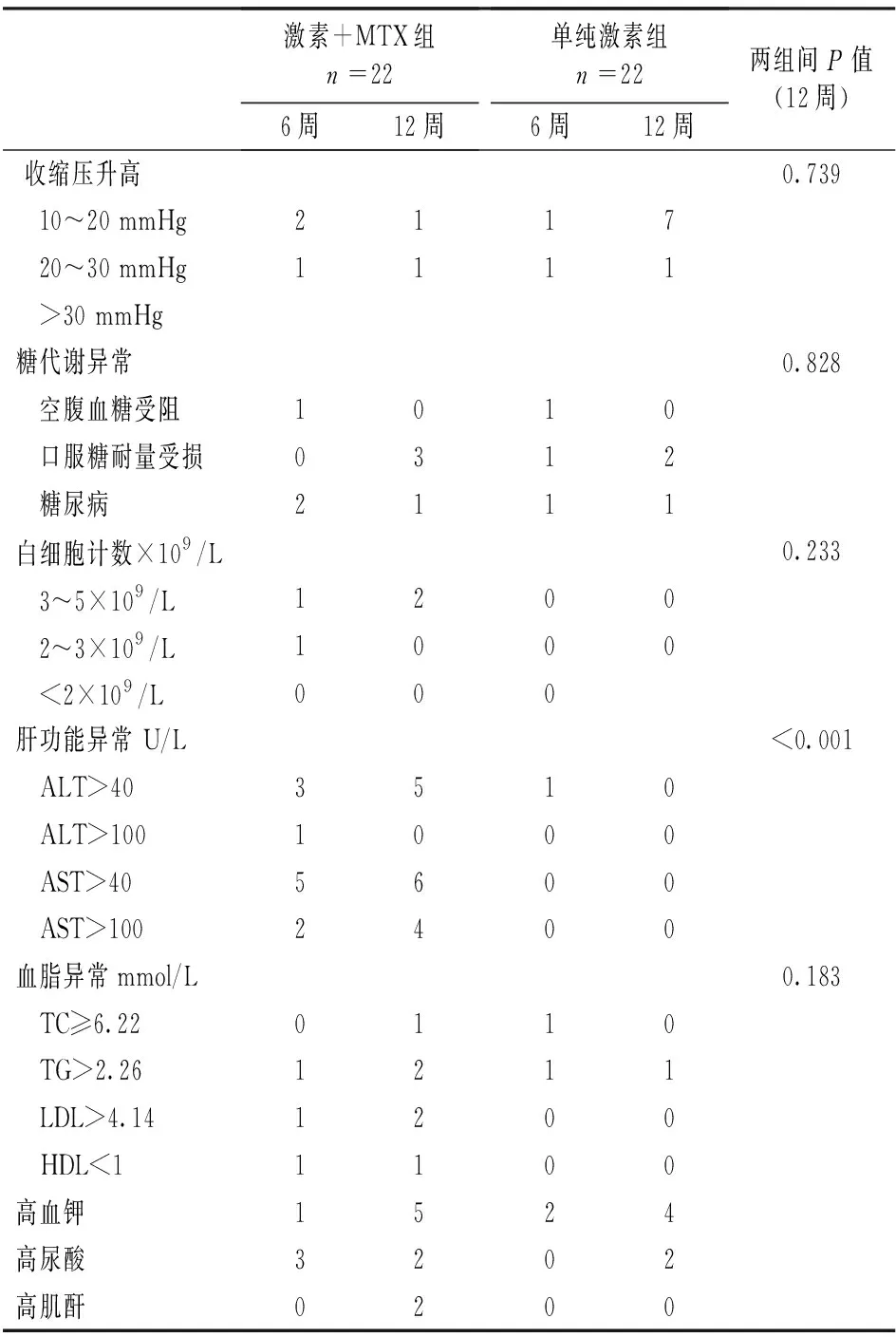
表4 第6周和第12周治疗相关的不良反应
讨 论
TAO是一种以眼外肌水肿,眼眶脂肪增生为特征的自身免疫性眼眶病。目前治疗方案主要包括糖皮质激素和免疫抑制剂治疗。糖皮质激素通过干扰T、B淋巴细胞的功能而抑制免疫功能,减少眼眶成纤维细胞分泌合成糖胺聚糖,主要缓解活动期TAO的炎症反应及缩短活动期病程,使疾病加速进入静止期[5]。激素通常可以通过口服,局部(球后注射和结膜下注射)以及静脉给药。已有随机对照研究证实,激素静脉冲击的效果优于口服激素和球后及结膜下注射激素[6],静脉用药可以更有效的控制局部炎症反应,患者CAS评分下降幅度较口服激素组大,不良反应较口服激素小。激素静脉冲击的剂量也经过了诸多研究:2012年欧洲有多中心RCT表明,总量7.47 g的甲基强的松龙静脉冲击方案较4.98 g和2.25 g有短期优势,有效率分别为52%,35%和28%,但也存在更大的副作用[7];2015年Riedl等对激素治疗TAO的副作用研究发现,总量低于4.5 g的静脉激素方案副作用发生率较低,为38.75%[8]。因此,EUGOGO在2021年发布治疗指南,建议把静脉使用糖皮质激素作为中重度活动期甲状腺相关性眼病的一线治疗方案,并推荐使用总剂量4.5 g的静脉激素方案[4]。
MTX是一种最常用的免疫抑制剂,广泛应用于多种自身免疫疾病的治疗。已有研究提示MTX对活动期TAO患者有效, Bartelena的研究显示,与CTX相比,MTX肝毒性更小,副反应更少[9]。MTX可以抑制二氢叶酸还原酶的活性,低剂量的MTX是一种具有抗炎和免疫调节作用的免疫抑制剂,但在TAO的治疗中仅处于二线用药的地位。2001年一项回顾性研究表明,MTX治疗活动期TAO的有效率为64%[10],但这项研究中MTX的用药时间相对较长,为11~84个月(平均43个月),因此很难判断病情的好转是MTX的作用还是受TAO自然病程的影响。2003年,国内一回顾性观察研究表明,静脉激素联合MTX治疗活动期TAO有效,但样本量较小,也缺乏对照组。2014年意大利一项研究表明,应用MTX 6~12个月之后,TAO患者的CAS评分和眼球活动度有了很大好转,3个月时67%的患者双眼CAS评分降低,6个月80%的患者双眼CAS评分降低,12个月时94%的患者双眼CAS评分降低[11]。2015年美国的另一项研究也得出了类似的结论[12]。不良反应方面,2001年和2015年的研究由于使用MTX的剂量大、疗程长(2001年15~25 mg/w,43个月;2015年15~20 mg/w,6个月),86%的患者产生了肝功能受损、MASA感染、关节痛、消化道症状等副反应。而在2014年的研究中,由于MTX的剂量相对小(7.5~10 mg/w),该研究未报到任何MTX相关的副反应。
本研究发现激素联合MTX和单纯激素在第6周和第12周的总体有效率无显著差异,可能原因:(1)本研究选择的MTX治疗方案为低剂量方案(7.5 mg/周),和500 mg甲基强的松龙比较,其免疫抑制作用较弱,联合组和单纯治疗组的有效率差异并不显著;(2)和糖皮质激素比较,MTX的免疫抑制作用持续时间较长,停药后可能还存在一定的持续效应。本研究疗效观察时间节点为第6周和第12周,治疗结束后未进行随访评估。
MTX最常见的严重副作用是肝毒性。其他严重不良反应包括骨髓抑制等。在本研究中,联合MTX治疗组的肝功能异常发生率显著高于单纯激素治疗组。MTX对肝细胞产生直接毒性作用,严重肝损害的程度和结果是剂量依赖性的。小剂量长期口服比大剂量间歇用药的发生率高,单次用量越大,累积剂量越高,肝损害程度越重,发生肝损害的几率就越高[11]。大剂量的MTX可致急性肝细胞损伤,转氨酶升高,临床症状迅速出现,而小剂量长期应用则主要与肝纤维化有密切关系[13]。
作为一项前瞻性随机对照研究,本研究结果表明激素联合MTX治疗中重度活动期TAO患者有效,可以有效的降低CAS评分,提高视力,改善突眼度,但其短期总体有效率与单纯静脉冲击治疗无统计学差异;同时,联合MTX治疗可能存在更大的肝毒性。

