未经治疗的帕金森病患者全脑静息态功能磁共振成像的分数低频振幅研究
龚 涛, 程卫玲, 陶 娜, 曾 瀛, 罗文明, 王樱花, 周福庆
帕金森病(Parkinson′s disease,PD)是一种较为常见的老年性退行性病,尽管经过多年的不断探索,其病理生理机制仍不是很清楚[1]。黑质(尤其是致密部)及黑质-纹状体通路的病理改变能部分解释患者的典型临床症状,如静止性震颤、肌强直、运动迟缓及异常步态[2-3]。但这些处于生化水平的病理改变并不能对PD患者产生明显的脑形态或结构改变。因此,MRI常规序列不仅无法诊断PD,也不能准确解释患者的临床症状。随着多模态MRI扫描和分析技术的发展,如铁敏感成像、神经黑色素敏感成像、黑质自由水成像和T1加权成像可分别捕获铁沉积、标记多巴胺能神经元、反映神经变性或炎症、标记体积变化/脑萎缩,为PD疾病进展提供较为可靠的生物标志物[4-5]。功能磁共振成像(functional magnetic resonance imaging,fMRI)可通过建立的神经元活动和血流动力学联系,反映疾病在脑结构变化之前的脑功能变化。例如,PD患者存在双侧辅助运动区、左壳核、左前运动皮层和左顶内侧回低频振幅(amplitude of low-frequency fluctuation,ALFF)降低,而右侧顶回的ALFF升高[6-7]。但这种静息功能指标和临床病情分级(如Hoehn-Yahr分级)之间的关系并不十分清楚。为此,本研究采用能够有效抑制生理伪影的分数低频振幅(fractional amplitude of low-frequency fluctuation,fALFF),计算、比较PD患者和健康对照组的典型频段(0.01~0.1 Hz)、Slow-5亚频段(0.01~0.027 Hz)和Slow-4亚频段(0.027~0.073 Hz)fALFF值,探讨PD患者大脑自发性活动特点及其与临床病情分级之间的关系,为理解PD患者大脑内源性功能活动与临床严重程度的关系提供影像学依据。
1 资料与方法
1.1临床资料 本研究为前瞻性研究,研究方案已通过宜春市人民医院伦理委员会审查(2020106号),所有受试者在研究前均签署知情同意书。招募2020年4月至2022年6月在我院神经内科就诊但尚未接受治疗的PD患者33例(PD组),其中男性22例,女性11例,年龄48~81(69.03±8.97)岁。同时招募年龄、性别相匹配的健康志愿者34名作为健康对照组,其中男性15名,女性19名,年龄40~76(67.5±15.5)岁。PD组和健康对照组的年龄、性别比较差异均无统计学意义(P>0.05)。所有PD患者依据《中国帕金森病的诊断标准(2016版)》[8]进行临床诊断,完成PD的Schwab-England量表及Hoehn-Yahr(修正)量表的评定。Hoehn-Yahr(修正)分级量表中位数[PD组:0.60(0.50,0.80)]表明患者平均处于帕金森中期,Schwab-England量表中位数[PD组:2.50(2.00,3.00)]表明患者存在一定的依赖性,但可完成大部分的日常工作。纳入标准:(1)符合PD诊断标准且未经正规治疗者;(2)临床资料完整且能完成MRI检查;(3)年龄<85岁,均为右利手。排除标准:(1)中枢神经系统先天性畸形或血管性疾病;(2)中枢神经系统肿瘤、外伤、感染;(3)癫痫、中风;(4)中枢神经系统手术史等;(5)检查前1周内使用精神类或激素类药物;(6)MRI检查禁忌证、幽闭恐惧和图像质量欠佳者。
1.2数据采集
1.2.1 PD患者临床评估 (1)PD的Schwab-England量表用于患者日常活动分级评分,对PD患者日常活动能力分10级,活动度为0%~100%,其评级越小表明患者症状越重;(2)PD的Hoehn-Yahr(修正)分级用于评价患者运动受损情况,根据患者症状和严重程度分为0~5期[9]。
1.2.2 MRI数据采集及分析 (1)常规MRI用于排除脑部器质性病变:采用GE 3.0T 750W磁共振系统进行扫描,32通道头颅线圈,梯度场强为40 mT/m,扫描序列包括T1加权成像、T2加权成像和T2-液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR),用于排除脑转移瘤及其他脑部疾病。(2)静息态fMRI数据采集及后处理:①静息态fMRI扫描序列采用T2-平面回波成像-梯度回波序列轴面扫描:重复时间(repetition time,TR)/回波时间(echo time,TE)=2 000 ms/30 ms,翻转角90°,30层,视野大小(field of view,FOV)230×230 mm,矩阵64×64,层厚4 mm,层距0 mm,扫描时间8 min。②图像数据格式经MRIcroN软件转化,在MATLAB 7.1平台使用基于统计参数图(SPM12)的脑成像数据处理和分析工具(DPABI;http://rfmri.org/DPABI)进行时间、空间标化,校正头动并映射到标准脑。头动校正可获得受试者的水平头动与旋转头动图,平移<1.5 mm与旋转移动<1.5°的受试者图像进入后续分析。③去线性漂移后,分别计算典型频段(0.01~0.1 Hz)、Slow-5亚频段(0.01~0.027 Hz)和Slow-4亚频段(0.027~0.073 Hz)的全脑fALFF,用于刻画静息状态下局部脑功能活动强度。

2 结果
2.1在典型频段两组fALFF比较 在典型频段(0.01~0.1 Hz),未治疗的PD患者组存在局部的fALFF改变,具体包括右侧颞上回、右侧中央前回、左侧颞上回、左侧扣带回。见图1和表1。PD患者组存在显著差异的脑区(左侧扣带回)的fALFF值与Hoehn-Yahr(修正)分级呈负相关(r=-0.364,P=0.037)。见图2。

暖色调(t值)表明患者组fALFF显著增高,冷色调(t值)表明患者组fALFF显著降低。

表1 在典型频段(0.01~0.1Hz)PD患者组fALFF和对照组组间比较结果(P<0.001,GRF校正)

图2 PD患者左侧扣带fALFF值与Hoehn-Yahr(修正)分级量表评分散点图
2.2在Slow-5和Slow-4亚频段两组fALFF比较 在Slow-5和Slow-4亚频段,PD组较对照组的fALFF改变见图3和表2,3。在Slow-5(0.01~0.027 Hz)亚频段,PD组左侧舌回fALFF值与Hoehn-Yahr(修正)分级呈正相关(r=0.376,P=0.031,见图4ⓐ),左侧扣带回fALFF与Hoehn-Yahr(修正)分级呈负相关(r=-0.359,P=0.040,见图4ⓑ)。在Slow-4(0.027~0.073 Hz)亚频段,PD患者差异脑区和Hoehn-Yahr(修正)分级、Schwab-England量表评分之间并无显著相关性(P>0.05)。

图ⓐⓑ中暖色调(t值)表明患者组fALFF显著增高,冷色调(t值)表明患者组fALFF显著降低。图ⓒ中绿色区表示重叠区。在Slow-5(0.01~0.027 Hz)亚频段(ⓐ)和Slow-4(0.027~0.073 Hz)亚频段(ⓑ),PD患者和对照组fALFF值存在显著差异脑区(P<0.001,GRF校正),两个亚频段重叠的脑区主要位于枕叶(ⓒ)
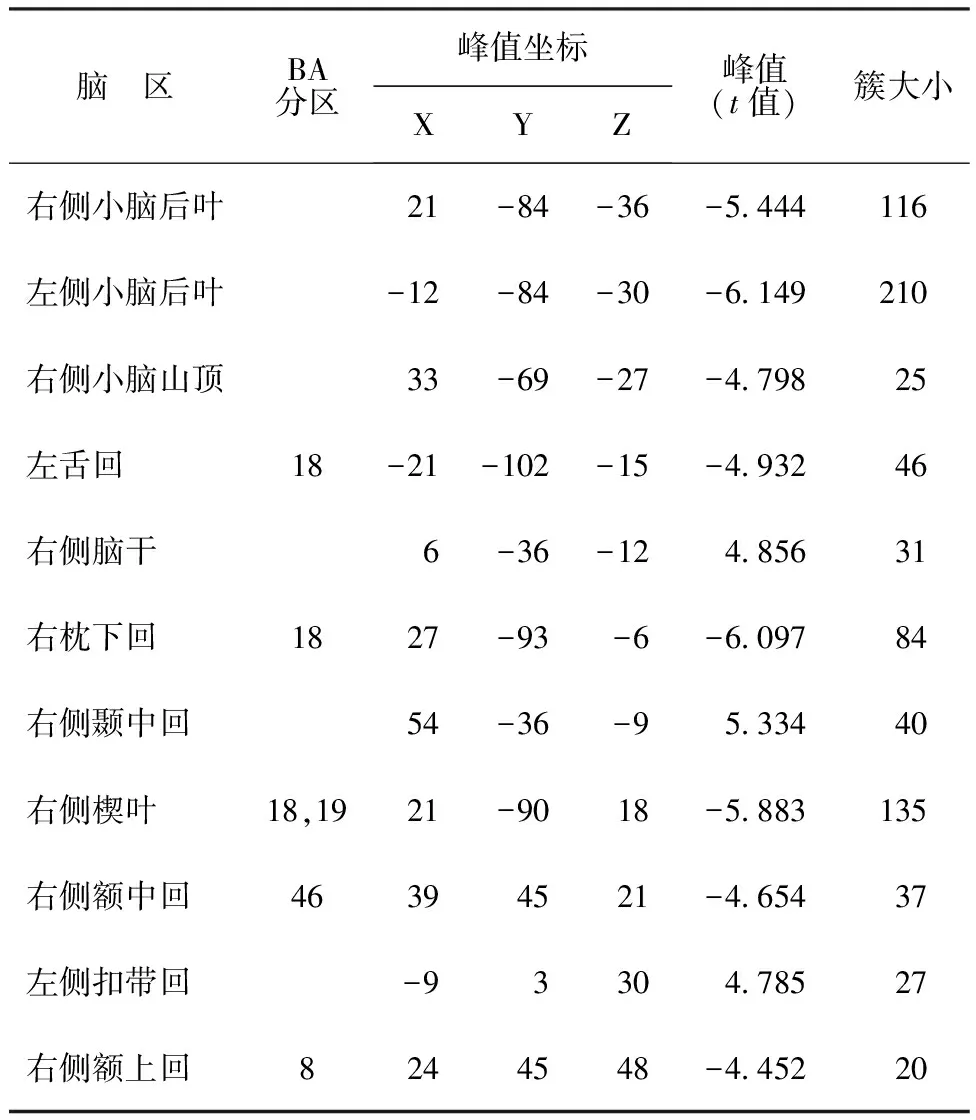
表2 PD患者静息状态Slow-5(0.01~0.027 Hz)亚频段的fALFF和对照组的组间比较结果(P<0.001,GRF校正)

表3 PD患者静息状态Slow-4(0.027~0.073 Hz)亚频段的fALFF和对照组的组间比较结果(P<0.001,GRF校正)
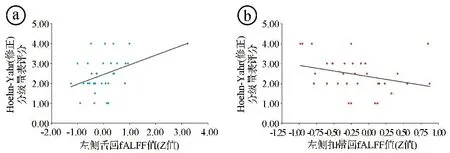
图4 PD患者左侧舌回和左侧扣带fALFF值与Hoehn-Yahr(修正)分级量表评分散点图
3 讨论
3.1新发未治疗PD患者典型频段自发性活动强度分析 在典型频段(0.01~0.1 Hz),新发未治疗的PD患者存在右侧颞上回、右侧中央前回、左侧颞上回、左侧扣带回fALFF值升高,提示这些脑区存在自发性活动代偿。扣带回前部参与复杂的躯体和内脏运动功能和痛反应,后部是监控感觉和立体定位及记忆作用,左侧扣带回fALFF值与Hoehn-Yahr(修正)分级呈负相关,表明PD患者在未治疗时就存在相关认知记忆网络的代偿,且所处时期越早,这种代偿效应越明显。这支持先前PD患者研究中存在内源性功能代偿的发现[10]。先前研究也发现,PD患者可能通过增强其他神经环路神经元的活动,维持相对正常的认知水平,有可能就是这种代偿机制的结果[11]。颞上回是听觉的皮层中枢,传导低频冲动的纤维投射至此脑区的前外部,高频则传导至后内部,颞上回后部是感觉性语言中枢。中央前回是运动中枢,负责计划、开始和执行运动[12-13]。因此,上述脑区fALFF值增高,可能参与患者感知改变、运动障碍代偿,以尽可能维持患者的临床功能。PD组存在双侧小脑后叶、左侧舌回、右侧楔叶、双侧楔前叶、右侧顶上小叶fALFF值减低。小脑在运动控制和认知中起着关键作用,小脑前叶和后叶参与精细运动调控,小脑后叶涉及认知过程。有研究表明,小脑-皮层环路在特发性震颤、PD震颤和肌张力障碍性震颤的病理生理学中均发挥着关键作用[14]。因此,笔者认为,双侧小脑后叶等脑区fALFF值减低,可能与PD患者的小脑-皮层环路出现低活性有关,但其具体作用机制需要进一步深入研究。
3.2未治疗PD患者亚频段自发性活动强度分析
PD组Slow-5和Slow-4两个亚频段中fALFF值改变脑区和典型频段观察到的脑区大致相仿。除双侧枕叶区域外,其改变呈大致互补形式。这说明在不同的脑区,无论是代偿还是受损的脑区,这种fALFF值改变均存在频率敏感性的差异。在Slow-5(0.01~0.027 Hz)亚频段,PD组存在代偿性fALFF值增高的脑区主要位于右侧脑干、右侧颞中回和左侧扣带回。脑干是生命中枢。右侧颞中回和左侧扣带回参与信息的心理操作、记忆和情绪过程,执行功能不仅依赖皮质-纹状体通路,还依赖默认模式网络、额顶网络等[15-16]。其中左侧扣带回fALFF值同样发现与Hoehn-Yahr(修正)分级呈负相关。该增高脑区和相关性分析与典型频段中的发现相一致,进一步说明Slow-5亚频段的代偿性增高是典型频段改变的主要原因,也可能是由于额顶网络和皮质-纹状体通路的代偿效应所致[17-19]。在Slow-5(0.01~0.027 Hz)亚频段还发现,PD组左侧舌回fALFF值与Hoehn-Yahr(修正)分级呈正相关。舌回是重要的视觉功能区,主要参与视觉记忆的加工,舌回功能连接可能与患者视力受损引起的功能重构有关[12]。有研究发现,PD患者初级视觉、内在视觉整合可能与PD视幻觉有关[11]。PD患者局部一致性的研究也发现,视觉网络(左侧舌回)功能受损参与了患者视觉信息整合相关的认知障碍的发生。结合本研究在Slow-4亚频段上发现的fALFF值下降的视觉网络脑区:楔叶、楔前叶、枕下回等,说明在PD疾病的早期阶段,患者存在视觉信息整合能力的显著下降。小脑后叶是PD组在Slow-5、Slow-4两个亚频段和典型频段较为一致的fALFF值下降的脑区。小脑是视空间执行和注意力的关键结构,参与视空间执行相关脑网络和注意力相关脑网络[20],该区域在协调精细运动中起着重要作用,特别是通过抑制性神经递质(如γ-氨基丁酸)抑制不自主运动,小脑后叶fALFF异常对视觉空间具有病理性作用[21]。脑干内的网状结构与大脑皮质、丘脑、下丘脑、边缘系统、小脑有密切联系,参与调节呼吸、注意力、肌肉张力及觉醒与睡眠、储尿等。PD患者小脑后叶fALFF值下降,可能与脑干的激活有关,从而导致PD患者的睡眠、肌张力及排尿障碍等症状[22]。通过相关性分析发现,PD患者在未治疗时就存在相关认知记忆网络的代偿,PD患者通过增强其他神经环路神经元的活动,与相关脑网络一起对已损害的功能进行代偿,随着PD病情进展,fALFF值降低,可能与左侧扣带回功能失代偿有关,也可能是因为扣带回所在的海马边缘环路(海马-穹隆-乳头体-丘脑前核-扣带回-海马旁回-海马)是一种闭环,神经信息传导可以双向传导,延缓了病理状态的出现。Slow-5频段左侧舌回fALFF值的Z值范围-1.267~3.228,Z值越大,Hoehn-Yahr(修正)分期越高,患者病情也越重,说明左侧舌回是PD早期阶段就累及的脑区,这与PD患者早期阶段即可出现视力减退、眼球活动障碍等症状相符合。随着PD进入中晚期阶段,功能连接重构及视觉信息整合能力显著下降,出现视觉处理、空间定位及运动感知等视觉障碍。
3.3本研究的局限性 PD患者的受教育程度、疾病持续时间、不同亚型等因素未纳入研究。因此,在今后的研究中就不同的疾病亚型fALFF改变,及其与其他临床变量之间的关系,需要更深入的研究。
综上所述,本研究未治疗的PD患者存在视觉网络和后部默认网络为主的fALFF减低,以及局部代偿性增高。亚频段的更多发现为进一步探讨PD患者内源性脑活动改变的病理生理机制提供了新的证据。

