静脉溶栓联合复方脑肽节苷脂治疗急性脑梗死临床观察*
曾 林,罗九宝,吉彩云,王 强,丹 娜
(1. 中南大学湘雅医学院附属海口医院,海南 海口 570208; 2. 海南医学院附属海南医院,海南 海口 570311)
急性脑梗死(ACI)的治疗关键在于尽早疏通闭塞血管、修复受损神经组织,临床采用静脉或动脉溶栓、机械取栓等方法[1]。阿替普酶是治疗ACI 的一线药物,通过溶解血栓和开通闭塞血管,改善脑部血流供给,挽救缺血半暗带[2]。静脉溶栓是治疗急性期ACI的有效方法,但受治疗时间窗及个体差异的影响,总体预后不佳。复方脑肽节苷脂是一种保护神经的复方制剂,参与受损脑组织的修复及减轻炎性反应等过程[3]。复方脑肽节苷脂能够改善脑出血、颅脑损伤等所致神经损害症状,但联合静脉溶栓用于ACI 治疗的报道较少[4-5]。本研究中探讨了静脉溶栓联合复方脑肽节苷脂治疗ACI的临床疗效,以及对患者脑血流动力学及脑氧代谢指标的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合急性缺血性脑卒中诊断标准[6];发病时间≤4.5 h;首次发病,入院前未接受任何治疗;有溶栓治疗指征。本研究方案经本院医学伦理委员会批准(批件号为2019-3),患者或其家属签署知情同意书。
排除标准:既往颅脑外伤、颅内感染、脑出血、脑血管畸形等神经系统疾病;心、肝、肾等脏器功能异常;合并血液系统疾病、免疫系统疾病、急慢性感染或恶性肿瘤;精神疾病或认知障碍;临床资料不全、不积极配合治疗或中途退出本研究。
病例选择与分组:选取中南大学湘雅医学院附属海口医院2020年1月至2021年12月收治的ACI 患者114例,按随机数字表法分为联合组和溶栓组,各57例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
表1 两组患者一般资料比较(±s,n=57)Tab.1 Comparison of the patients' general data between the two groups(±s,n=57)

表1 两组患者一般资料比较(±s,n=57)Tab.1 Comparison of the patients' general data between the two groups(±s,n=57)
注:NIHSS为美国国立卫生院卒中量表。Note:NIHSS refers to the National Institutes of Health Stroke Scale.
项目性别(男/女,例)年龄(images/BZ_94_1792_1073_1817_1115.png±s,岁)发病时间(images/BZ_94_1792_1073_1817_1115.png±s,h)入院NIHSS评分(images/BZ_94_1792_1073_1817_1115.png±s,分)梗死面积(images/BZ_94_1792_1073_1817_1115.png±s,cm2)梗死部位(例)合并症(例)小脑丘脑脑干脑室旁基底节高血压高脂血症糖尿病冠心病联合组30/27 61.85±6.95 2.88±0.62 17.25±3.81 16.74±2.93 11 10 17 12 7 34 34 18 5溶栓组33/24 61.03±6.73 2.75±0.64 16.86±3.86 16.35±2.83 13 10 14 11 9 31 38 16 7 χ2/t值0.319 0.593 0.987 0.538 0.912 0.211 0.000 0.399 0.054 0.291 0.322 0.603 0.168 0.373 P值0.572 0.555 0.326 0.592 0.364 0.646 1.000 0.528 0.815 0.590 0.570 0.437 0.682 0.542
1.2 治疗方法
两组患者均予降压、吸氧、营养神经、维持水电解质平衡等基础治疗。溶栓组患者入院后开通静脉通路,予注射用阿替普酶(Boehringer Ingelheim Pharma GmbH &Co.KG,国药准字SJ20160055,规格为每支50 mg)静脉溶栓,按0.9 mg/kg 剂量给药,最大剂量不超过90 mg,1 min 内静脉推注完毕总剂量的10%,60 min 内静脉滴注完成剩余90%;溶栓24 h 后无出血则可口服阿司匹林肠溶片(Bayer Vital GmbH,国药准字J20130339,规格为每片100 mg)100 mg/d,抗血小板治疗。联合组患者在溶栓组基础上静脉滴注复方脑肽节苷脂注射液(吉林天成制药有限公司,国药准字H22026472,规格为每支2 mL)12 mL,加入250 mL 0.9%氯化钠注射液稀释,每日1次。两组均治疗14 d。
1.3 观察指标与疗效判定标准
观察指标:1)应用经IE33 型颅多普勒超声仪(荷兰Philips 公司)检查脑血流动力学指标,包括脑中动脉峰流速(Vp)、平均血流速(Vm)及阻力指数(RI)。2)使用DH - 50/ PSD - 10 型血气分析仪(南京攀事达电子公司)检测脑氧代谢指标,包括脑动脉氧含量(CaO2)、脑动静脉氧含量差[D(a-jv)O2]、脑氧摄取率(ERO2)。3)采集患者治疗前后的静脉血各3 mL,离心(转速为2 500 r/min)15 min,分离血清,采用酶联免疫吸附法测定血清神经生长因子(NGF)、血管内皮生长因子(VEGF)水平,试剂盒购于美国DSL公司。
疗效判定[7]:显效,NIHSS评分下降超过45%;进步,NIHSS评分下降18%~45%;无变化,NIHSS评分下降不足18%;恶化,NIHSS评分升高。总有效=显效+进步。
安全性:记录患者头晕、皮疹、乏力、出血等不良反应发生情况。
1.4 统计学处理
采用SPSS19.0 统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表6。

表2 两组患者临床疗效比较[例(%),n=57]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=57]
表3 两组患者脑血流动力学指标比较(±s,n=57)Tab.3 Comparison of cerebral hemodynamic indexes between the two groups(±s,n=57)

表3 两组患者脑血流动力学指标比较(±s,n=57)Tab.3 Comparison of cerebral hemodynamic indexes between the two groups(±s,n=57)
注:与本组治疗前相比,*P <0.05。表4和表5同Note:Compared with those before the treatment,*P < 0.05 (for Tab.3 - 5).
组别联合组溶栓组t值P值Vp(cm/s)治疗前55.38±4.36 55.65±4.42 0.418 0.677治疗后71.32±5.73*64.58±5.29*6.383 0.000 Vm(cm/s)治疗前30.58±2.53 30.62±2.61 0.379 0.705治疗后39.54±3.46*36.68±3.29*4.716 0.000 RI治疗前0.72±0.11 0.71±0.12 0.262 0.794治疗后0.56±0.09*0.61±0.09*3.206 0.002
表4 两组患者脑氧代谢指标比较(±s,n=57)Tab.4 Comparison of cerebral oxygen metabolism indexes between the two groups(±s,n=57)
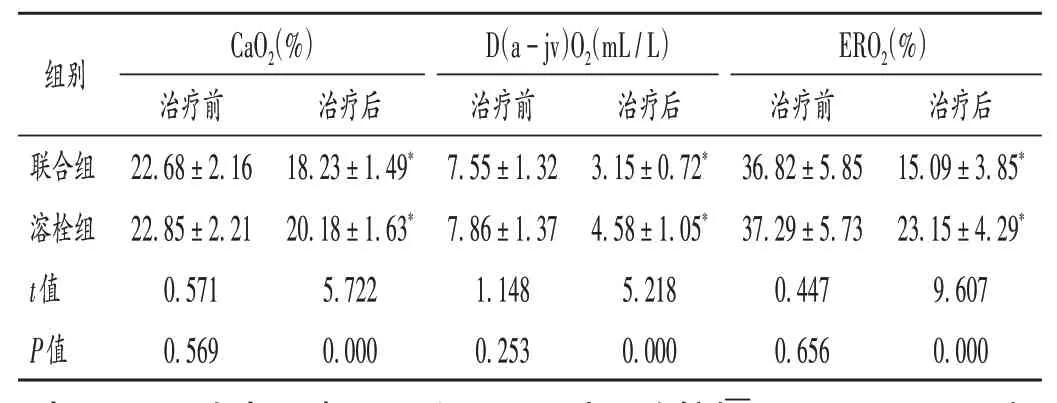
表4 两组患者脑氧代谢指标比较(±s,n=57)Tab.4 Comparison of cerebral oxygen metabolism indexes between the two groups(±s,n=57)
组别联合组溶栓组t值P值CaO2(%)治疗前22.68±2.16 22.85±2.21 0.571 0.569治疗后18.23±1.49*20.18±1.63*5.722 0.000 D(a-jv)O2(mL/L)治疗前7.55±1.32 7.86±1.37 1.148 0.253治疗后3.15±0.72*4.58±1.05*5.218 0.000 ERO2(%)治疗前36.82±5.85 37.29±5.73 0.447 0.656治疗后15.09±3.85*23.15±4.29*9.607 0.000
表5 两组患者血清NGF和VEGF水平比较(±s,ng/L,n=57)Tab.5 Comparison of serum NGF and VEGF levels between the two groups(±s,ng/L,n=57)

表5 两组患者血清NGF和VEGF水平比较(±s,ng/L,n=57)Tab.5 Comparison of serum NGF and VEGF levels between the two groups(±s,ng/L,n=57)
组别联合组溶栓组t值P值NGF治疗前72.18±7.86 72.75±8.57 0.366 0.715治疗后99.28±10.33*88.65±9.35*5.476 0.000 VEGF治疗前180.81±36.96 176.89±35.11 0.789 0.432治疗后265.79±43.89*228.06±41.02*4.389 0.000

表6 两组患者不良反应发生情况比较[例(%),n=57]Tab.6 Comparison of the incidence of adverse drug reactions between the two groups[case(%),n=57]
3 讨论
静脉溶栓是治疗ACI的重要方式,通过静脉输注药物,促进血栓溶解,疏通闭塞血管,从而恢复梗阻部位血流灌注,保护神经功能[8]。阿替普酶总体溶栓效果欠佳,尤其是对于大血管梗死患者,难以实现血管完全再通[9]。神经保护是ACI 治疗过程中的特殊治疗手段,对改善患者预后极其重要。复方脑肽节苷脂可作用于中枢神经的多个靶向位点,抑制细胞凋亡,促进神经组织分化、再生和修复,发挥神经保护作用[10]。复方脑肽节苷脂能抑制炎性反应和氧化应激,减少神经元凋亡,从而改善神经功能和认知功能[11]。
ACI患者局部脑血管闭塞或狭窄,导致脑组织处于低血流状态。经颅超声检查能帮助评估脑血流情况,脑血管血流速度越低,说明脑血循环功能越差,神经缺血越严重[12]。脑氧代谢状况是评估脑部血流灌注的重要手段,ACI患者脑组织血流量降低,脑氧代谢失衡,氧代谢率增加[13]。CaO2,D(a-jv)O2,ERO2是评价脑氧代谢的常规指标,与神经损害程度相关。本研究结果显示,联合组总有效率明显高于溶栓组,说明复方脑肽节苷脂能促进神经修复,提高临床疗效。联合组患者治疗后的脑血流动力学状况及脑氧代谢指标均明显优于溶栓组,说明静脉溶栓基础上联用复方脑肽节苷脂有助于提高脑部血流速度,改善脑组织氧代谢,抑制神经凋亡,为逆转和修复受损神经组织奠定基础。
NGF 能改善神经细胞物质、能量代谢,促进神经组织生长及修复,保护缺血脑细胞;帮助建立侧支循环,诱导缺血区域周围新血管生成,提高脑组织血流状况,进一步改善神经功能[14-15]。VEGF 是血管生长的关键因子,参与和诱导新血管生成,修复受损血管内皮,维持血管正常内皮功能[16]。ACI 发病后,VEGF 大量表达,通过刺激血管内皮增殖,建立良好的侧支循环,以保障缺血区域血流供给,减轻脑部缺血性损伤,避免神经退化和萎缩[17]。本研究结果显示,联合组治疗后血清NGF和VEGF 水平均明显高于溶栓组,提示复方脑肽节苷脂能促进血管及神经功能重建。
综上所述,静脉溶栓联合复方脑肽节苷脂治疗ACI的临床疗效良好,可有效提高患者的脑组织血流灌注,改善脑氧代谢状况,促进神经功能恢复。但本研究中病例较少,且调查时间较短,后期研究需扩大样本量并延长观察时间至半年及以上以观察远期疗效。

