载体介导噬菌体入胞及抗胞内寄生菌研究进展
宋 军 苑庆欣 杨书博 周志新 孙东波
(黑龙江八一农垦大学 动物科技学院/农业农村部东北寒区牛病防治重点实验室/黑龙江省牛病防制重点实验室,黑龙江 大庆 163319)
胞内寄生菌可通过调节宿主细胞内环境、逃逸宿主细胞免疫系统等机制,在宿主细胞内创造适合其生存的生态位,从而可在宿主细胞内长时间生存。对人类以及动物的健康有着巨大威胁的单核细胞增生李斯特菌、布氏杆菌、金黄色葡萄球菌等均为胞内寄生菌[1]。目前临床治疗胞内寄生菌引起的感染性疾病,面临很多困难亟待解决。临床批准使用的抗生素,大部分不能穿透哺乳动物细胞膜,从而无法进入细胞内治疗胞内寄生菌。少数能够穿透哺乳动物细胞膜的抗生素,无法在哺乳动物细胞内停留、积累发挥抗菌作用。当抗生素治疗难以达到有效杀灭胞内寄生菌时,还会导致胞内寄生菌产生耐药,甚至引发慢性持续性感染或感染反复发作[2],对人类健康造成严重威胁。
噬菌体是一类能够感染和裂解特定宿主细菌的病毒。在100多年的应用过程中,噬菌体在国内外均已被证明能够用于各种细菌性感染疾病的治疗,特别是对耐药细菌同样具有良好的治疗效果[3]。通常认为噬菌体无法穿透哺乳动物细胞膜,很难进入细胞发挥胞内抗菌作用,但现在国外越来越多的研究证明,噬菌体可以直接与哺乳动物细胞相互作用[4],进入细胞,发挥胞内杀菌作用。因此,噬菌体有潜力应用于治疗胞内寄生菌引起的细菌性疾病。
近年来,噬菌体治疗胞内寄生菌感染的相关研究表明,游离噬菌体对胞内寄生菌的抗菌效果仍受到诸多限制。而载体介导噬菌体入胞可提高噬菌体入胞效率,防止噬菌体被宿主免疫系统清除,并保护噬菌体免受细胞内环境影响。综合以上分析可以看出,国外针对噬菌体抗胞内寄生菌及载体介导噬菌体入胞的研究已非常丰富,而国内噬菌体疗法起步相对较晚,且胞内寄生菌感染的临床病例较少,导致噬菌体抗胞内寄生菌的研究较之国外相对滞后。
因此,本研究将近年来国外关于载体介导噬菌体入胞及抗胞内寄生菌研究进展进行总结,详细阐述不同介导噬菌体入胞的载体特性、入胞机制,以及如何提高入胞效率等方面的最新进展,以期为国内噬菌体抗胞内寄生菌的相关基础研究提供依据,并为更有效地利用载体投递系统高效投递噬菌体解决细胞内细菌感染的实际问题提供参考与理论支撑。
1 胞内寄生菌
胞内寄生菌可分兼性胞内寄生菌和专性胞内寄生菌。前者可以在宿主细胞内和细胞外生长繁殖,后者仅能在宿主细胞内生长繁殖[1]。胞内寄生菌可采用多种途径通过哺乳动物细胞膜,从而寄生于吞噬细胞(如巨噬细胞)或非吞噬细胞(如内皮细胞/上皮细胞)内,使其成为自己的宿主细胞[5]。例如分枝杆菌等可利用巨噬细胞的天然吞噬能力,通过受体介导的内吞作用入侵并驻留在巨噬细胞内[6]。沙眼衣原体、金黄色葡萄球菌和志贺菌等通过特殊机制来诱导细胞骨架重排,从而使非吞噬细胞出现吞噬活性[7-9]。某些胞内寄生菌如沙门菌,同时具有感染吞噬细胞和非吞噬细胞的能力[10]。胞内寄生菌进入非吞噬性细胞主要有2种机制:拉链模式和触发模式。前者是细菌蛋白与宿主细胞黏附受体呈连续拉链状结合,从而逐渐被宿主细胞吞噬,例如李斯特菌和耶尔森菌等[11-12],而后者则依赖于Ⅲ型分泌系统(T3SS)和细菌效应蛋白的分泌,例如沙门菌和志贺菌等[10,13]。这2种机制对胞内寄生菌进入非吞噬细胞都至关重要。
细菌被宿主细胞内化后,定居在被称为吞噬体或内体的特殊内隔室中。在吞噬细胞中,吞噬体与溶酶体融合时,过低的pH和降解酶会破坏病原体[14]。然而,大多数胞内寄生菌已经进化出阻止吞噬体与溶酶体融合或改变溶酶体杀灭细菌环境的能力。一些胞内寄生菌甚至能够逃离吞噬溶酶体,在细胞质中存活[15]。例如,结核分枝杆菌能够阻止吞噬体与溶酶体融合[16],并能在细胞质和溶酶体中存活[17],从而为其在巨噬细胞内存活创造一个合适的生态位;金黄色葡萄球菌则是能够在pH较低的环境中生存,以至于其可在吞噬体与溶酶体融合后的环境中继续生长繁殖[18]。胞内寄生菌在细胞内生长繁殖的机制不同,给当前胞内寄生菌感染的治疗带来很多困难与挑战。另外临床批准使用的抗生素,大多无法穿过哺乳动物细胞膜,或细胞内抗生素浓度难以达到杀死细菌的浓度,导致治疗胞内寄生菌感染有效药物的选择十分有限,加之细菌耐药性的不断增强,传统的抗菌药物很难对胞内寄生菌产生作用。因此,寻找治疗胞内寄生菌引起感染的新药物迫在眉睫。
2 游离噬菌体治疗胞内寄生菌
噬菌体是感染细菌、真菌等微生物的病毒总称。它们是地球上最富多样性的生命体,广泛存在于自然界中的水、土壤、空气等环境中。地球生物圈中的噬菌体数量可达1031~1032个[19]。可以说,只要有细菌存在的地方,就一定会有噬菌体的存在。噬菌体对于维持地球生物圈中的微生物菌群及其生态系统的平衡有着重要的作用[20]。
噬菌体抗菌的天然特性,使其在对抗多重耐药细菌感染方面具有重要应用价值。但由于细胞膜可以保护细胞内部的细菌不受胞外大部分效应分子的影响,而噬菌体分子量较高(>10 Mu)[14],无法被动扩散到哺乳动物细胞内,因此传统研究认为噬菌体无法进入细胞内部,进而发挥胞内抗菌作用。
近年来有研究证明,噬菌体可以通过多种机制与哺乳动物细胞相互作用,从而被细胞内化[21]。Nguyen等[22]在多种细胞中证明,T4噬菌体可从顶端膜快速转运至基底外侧膜,如MDCK细胞(犬肾细胞)、肠T84细胞、Caco-2细胞、A549细胞(肺上皮细胞)、Huh7细胞(肝细胞上皮细胞样细胞)和hBMec细胞(脑内皮细胞)。上述研究表明,使用噬菌体杀灭胞内寄生菌具有可行性。与抗生素疗法相比,噬菌体治疗具有更多优势。首先,噬菌体具有高度特异性,治疗细菌感染时,不会对宿主体内的正常微生物菌群造成损伤[23];其次,噬菌体会在感染部位特异性繁殖,具有持续杀菌的作用;噬菌体在失去宿主细菌之后,无法继续复制,不会出现蓄积中毒的情况;目前的研究中尚未发现噬菌体对哺乳动物细胞存在致突变能力以及遗传毒性等。
虽然噬菌体治疗细菌性疾病有很多优点,许多研究试图将游离噬菌体应用于胞内寄生菌的治疗,但还有很多困难亟待解决。例如Guang-Han等[24]应用噬菌体在体内和体外治疗类鼻疽伯克霍尔德菌感染中发现。在类鼻疽伯克霍尔德菌感染A549细胞系(肺上皮细胞)前加入噬菌体C34,类鼻疽伯克霍尔德菌感染的肺上皮细胞在体外的存活率增加了2倍。在类鼻疽伯克霍尔德菌感染肺上皮细胞后加入C34噬菌体时,抗菌效果不明显。并且小鼠在经鼻感染类鼻疽伯克霍尔德菌2 h后,未经治疗的小鼠存活率为0,而治疗后小鼠存活率提升至33%。突出了噬菌体的预防和治疗潜力。上述研究表明,游离噬菌体可直接被细胞内化,并靶向胞内寄生菌,但却无法证明胞内寄生菌的数量会在治疗后减少。目前限制游离噬菌体清除胞内寄生菌的主要原因是入胞效率较低,并且无法在细胞内环境中长期保持活性[25]。为使噬菌体能够有效对抗胞内寄生菌,需要载体投递噬菌体来提高噬菌体的入胞效率,使其精准到达细菌所在的细胞内部位,并保持活性。
3 载体介导的噬菌体递送
前期关于游离噬菌体清除胞内寄生菌的研究并未取得理想结果,噬菌体疗法曾被认为不适合靶向治疗胞内寄生菌。为提高噬菌体的入胞效率、更加精准的靶向胞内寄生菌,研究者们采用不同载体包封噬菌体递送入细胞内的方式,提高噬菌体抗胞内寄生菌感染的治疗效果(图1)。
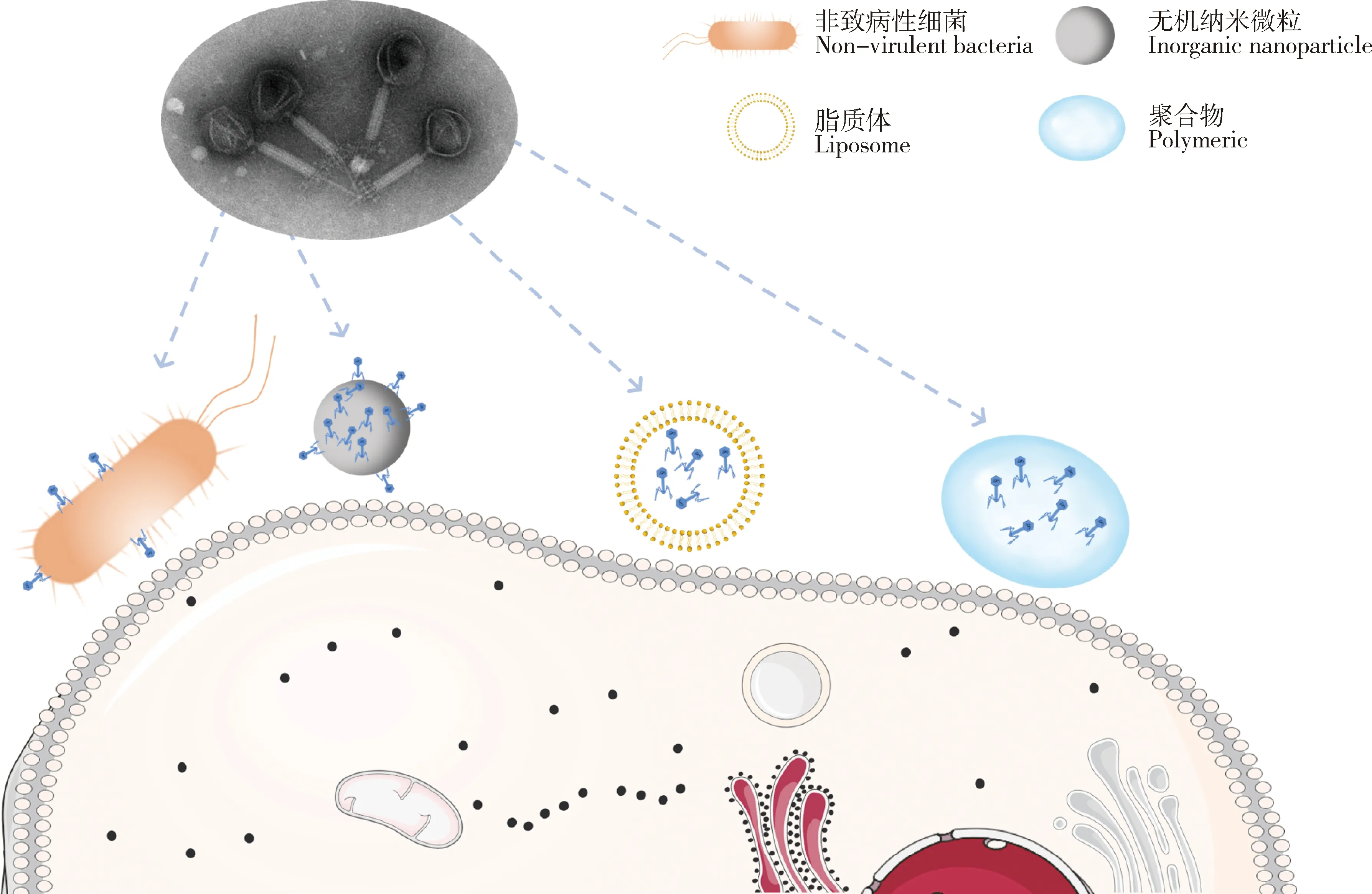
图1 用于介导噬菌体入胞的载体Fig.1 Carriers for mediating phage entry into the cell
3.1 非致病性细菌作为载体
上世纪60年代,有人提出噬菌体可以借助一种被称为“特洛伊木马”的方法进入细胞内部,从而清除胞内寄生菌[26]。即在被噬菌体感染的胞内寄生菌发生裂解前,附着在细菌表面或在细菌内繁殖的噬菌体一同被哺乳动物细胞内化,从而使噬菌体进入细胞内部。
基于该假设,Broxmeyer等[27]提出使用非致病性且生长繁殖相对较快的耻垢分枝杆菌作为 TM4 噬菌体载体,靶向治疗细胞内鸟分枝杆菌以及结核分枝杆菌。研究表明,TM4噬菌体瞬时感染的耻垢分枝杆菌能以时间和剂量依赖方式有效清除RAW 264.7巨噬细胞内鸟分枝杆菌和结核分枝杆菌。其后续研究表明,使用TM4噬菌体瞬时感染的耻垢分枝杆菌治疗的小鼠与单独使用游离噬菌体治疗相比,小鼠脾脏中的鸟分枝杆菌数量显著减少[28]。
上述研究表明,耻垢分枝杆菌有潜力作为载体介导噬菌体入胞,从而清除胞内寄生菌,但后续研究发现该细菌在特殊情况下可引起软组织感染[29],因此耻垢分枝杆菌等非致病性细菌可能存在的致病性会在临床应用中造成安全隐患,致使目前非致病性细菌作为载体仅停留在动物试验阶段。
3.2 无机纳米微粒作为载体
不同种类的无机纳米微粒可单独应用或与抗生素混合应用治疗细菌感染[30]。无机纳米微粒可同时以氧化应激诱导、释放金属离子以及非氧化机制等多种方式作用于病原体,因此病原体很难对无机纳米微粒产生耐药性[31]。并且无机纳米微粒可与特定组织靶向因子结合,使无机纳米微粒表面功能化,从而使药物与其结合后能够靶向胞内寄生菌[32]。近年来,基于上述无机纳米微粒的特性,许多研究将噬菌体与各种无机纳米微粒结合,从而提高噬菌体抗菌效率,并将噬菌体应用范围扩展至抗胞内寄生菌[33-37]。
噬菌体可通过其衣壳上的酰胺键来修饰磁性氧化铁纳米微粒(MNPs),被噬菌体修饰后的MNPs能利用噬菌体特异性,快速、灵敏地从环境或生物样品中检测和分离细菌。不仅如此,Li等[33]研究表明MNPs与噬菌体结合后还具有清除细菌生物被膜的能力。带有氨基的MNPs比带有羧基的MNPs更易与噬菌体结合,并且较小的MNPs更易与噬菌体结合,且结合后去除生物被膜效率更高[34]。不过目前并没有研究证明,MNPs与噬菌体结合后可被哺乳细胞内化,从而清除胞内寄生菌。
银纳米微粒(AgNPs)现已成为治疗一系列多重耐药细菌的新选择。AgNPs可通过内吞作用进入细胞,并在细胞内环境中释放,从而清除胞内寄生菌[35]。并且有研究证明,M13噬菌体能够通过基于静电相互作用的自组装方法附着在AgNPs上[36],并且M13噬菌体与AgNPs复合物能够以剂量依赖的方式有效地杀灭革兰阳性菌(金黄色葡萄球菌和枯草杆菌)和革兰阴性菌(铜绿假单胞菌和大肠杆菌)。噬菌体与AgNPs偶联后可能会促进噬菌体被细胞内化,并协同清除胞内寄生菌。
Fulgione等[37]将纳米级仿生羟基磷灰石(HA)晶体作为噬菌体载体用于清除哺乳动物细胞内的沙门菌。在人肝细胞癌细胞(HepG2)中测定噬菌体SR φ1与HA复合物清除胞内寄生菌效率,并与单独使用噬菌体SR φ1或HA形成相互对照。结果显示,经噬菌体SR φ1与HA复合物处理24 h后,其能够成功内化到HepG2细胞的细胞质内,但HepG2细胞无法单独内化噬菌体SR φ1。并且经噬菌体SR φ1与HA复合物处理后,感染沙门氏菌的鸡肉样品细菌载量减少3 log CFU/g。研究结果表明,使用噬菌体SR φ1与HA复合物的治疗效果明显优于单独使用SR φ1噬菌体或HA,并且噬菌体与HA复合物在低pH条件下,仍可稳定储存。
综上所述,AgNPs、纳米级HA晶体等无机纳米微粒有潜力作为载体介导噬菌体入胞,清除胞内寄生菌,但无机纳米微粒的应用目前还存在着诸多限制。例如金属纳米微粒应用前,需对其与噬菌体的复合物进行毒性评估,来解决应用其治疗胞内寄生菌的相关安全问题。不仅如此,目前大多无机纳米微粒与噬菌体结合后难以保证噬菌体长期储存的稳定性,并且无机纳米微粒入胞机制研究尚不明确,入胞效率亟需提高。
3.3 脂质体作为载体
脂质体一般是由磷脂和胆固醇构成的双分子层闭合囊泡,其具有良好的生物相容性,能够封装各种类型的药物,并保护其封装的药物不被降解或清除,这使得脂质体成为研究最多,且最成熟的传递药物的纳米载体[38]。1995年,负载抗肿瘤药物阿霉素的聚乙二醇化脂质体(Doxil)经FDA批准,成为第一个上市的纳米药物。Doxil可以延长阿霉素在体内的循环时间,明显降低阿霉素对心脏的毒性,提高患者的生存率[39]。此后,FDA批准了多个脂质体药物的临床研究。我国也批准了多种脂质体药物制剂的生产,比如注射用紫杉醇脂质体、盐酸多柔比星脂质体、注射用两性霉素B脂质体等[40]。并且已有研究表明,阿米卡星脂质体吸入悬浮液可用于治疗非结核分枝杆菌引起的肺部感染。脂质体作为载体介导噬菌体入胞时,可通过膜融合将噬菌体投递入胞,从而提高噬菌体的入胞效率和杀菌效率[41]。目前关于脂质体作为噬菌体载体的研究主要集中在使噬菌体获得更好的入胞效率[42-45],防止噬菌体被宿主免疫系统清除以及使噬菌体免受较低pH影响[43,46-47],提高噬菌体的杀菌效率[48-50]等方面。
Colom等[42]使用阳离子脂质体包封噬菌体鸡尾酒(UAB_Phi20、UAB_Phi78和UAB_Phi87),通过口服的方式治疗肉鸡肠道沙门菌感染。研究结果表明,与游离噬菌体相比,封装于阳离子脂质体内的噬菌体在酸性环境中降解速率明显降低,并且在肠道存留时间更长。该研究中,脂质体包封噬菌体和游离噬菌体对沙门菌定植的预防作用几乎一致,但使用游离噬菌体治疗后,沙门菌感染几乎都会在72 h内复发,而使用脂质体包封噬菌体治疗后,其保护作用可持续7 d以上。Otero等[43]发现,口服脂质体包封的噬菌体有向机体不同器官扩散的能力。并且在后续构建的Caco-2细胞、HT29肠细胞与Raji-B淋巴细胞的体外共培养模型中,脂质体以聚集体形式粘附在细胞表面,嵌入细胞膜,甚至内化到细胞内[42]。
Nieth等[48]使用共聚焦荧光显微镜计数THP-1巨噬细胞摄取的游离大肠杆菌λeyfp噬菌体与脂质体包封的大肠杆菌λeyfp噬菌体数量。每个THP-1细胞中脂质体包封的噬菌体数量显著高于游离噬菌体。Lapenkova等[49]也发现RAW264.7巨噬细胞内化脂质体包封的D29噬菌体速率比游离噬菌体提高了6~8倍,同时脂质体包封的D29噬菌体对人外周血单个核细胞形成的结核性肉芽肿模型抗菌效果更强。Singla等[46]证明脂质体噬菌体有进入小鼠腹腔巨噬细胞的能力,并且对小鼠腹腔巨噬细胞内肺炎克雷伯菌的杀菌效率为94.6%。此外,游离噬菌体会在与中和抗体接触后3 h内被中和,而使用脂质体包封噬菌体可以有效保护噬菌体免受中和抗体影响。Singla等[50]的后续研究证明,脂质体包封的噬菌体在腹腔内注射后的生物分布和生物滞留与游离噬菌体相比显著提高。因此,脂质体包封的噬菌体具有更高的生物利用度,并且在腹腔滞留时间更长,这使得应用脂质体包封的噬菌体预防和治疗肺炎克雷伯菌引起的呼吸道感染可能会更具优势[47]。Chhibber等[51]的研究同样证明局部应用脂质体包封的葡萄球菌噬菌体(MR-5和MR-10)可治疗耐甲氧西林金黄色葡萄球菌(MRSA)引起的皮肤和软组织感染。上述研究证明,脂质体包封的噬菌体与游离噬菌体相比,在感染部位的滞留时间更长,具有更高的生物利用度,杀灭细菌的速度更快,具有更好的治疗效果。
虽然脂质体包封噬菌体的治疗效果已得到诸多证明,但有研究表明,有尾噬菌体会与脂质体双分子层产生强烈相互作用,导致其包封效率极低[44]。Cinquerrui等[44]在杀死脂质体外所有噬菌体后,对脂质体内的噬菌体进行了量化,发现大多数噬菌体并不是包封在脂质体水核内,而是吸附在表面。这一发现与Nieth等[48]采用传统薄膜水合方法封装噬菌体时低温透射电镜以及荧光成像结果一致。吸附在脂质体表面的噬菌体并不会受益于脂质体的保护作用,但那些在体内恶劣环境中存活并转运到感染部位的噬菌体仍可能与脂质体一同被细胞内化,从而靶向胞内寄生菌。
上述体内外研究表明,脂质体作为噬菌体载体具有明确的入胞机制,能够有效提高噬菌体的入胞效率,从而靶向清除胞内寄生菌,并可保护噬菌体免受机体内环境影响,防止噬菌体被机体免疫系统清除,具有良好的应用前景。但想要获得更好的临床治疗效果,仍需进一步提高脂质体对噬菌体的包封效率以及储存稳定性,从而更有利于噬菌体脂质体清除(杀灭)胞内寄生菌。
3.4 聚合物作为载体
目前多数关于使用聚合物微粒包封噬菌体的研究,都是为避免噬菌体制剂在口服后受胃中蛋白水解环境或胃酸影响而失活。同时,实现噬菌体缓慢释放,增加噬菌体在感染部位的停留时间,达到提高噬菌体治疗效果的目的。尽管使用聚合物(如海藻酸盐、壳聚糖、果胶、聚乳酸-羟基乙酸共聚物、丙烯酸树脂等)包封噬菌体用于杀灭专性胞内寄生菌的相关研究较少,但其应用于杀灭兼性胞内寄生菌(肠球菌和金黄色葡萄球菌)的研究非常多,并且效果较好[25]。由于海藻酸盐基微粒及聚乳酸-羟基乙酸共聚物已被用于细胞内药物传递,因此本文后续重点介绍了这两种聚合物作为载体介导噬菌体入胞的研究进展。
3.4.1聚乳酸-羟基乙酸共聚物
聚乳酸-羟基乙酸共聚物(PLGA)是一种经美国食品药品监督管理局(FDA)批准的生物可降解聚合物,由于其良好的生物相容性、可调节的降解特性和长期的临床应用,目前已作为传递载体广泛应用于小分子药物和生物制剂(如肽、蛋白质、DNA和RNA)等药物。截至目前,已有数十种以PLGA为基础的长效药物获得FDA批准上市。如2018年上市的皮下利培酮长效注射剂(PerserisTM)[52],2020年上市的醋酸亮丙瑞林混悬液(Fensolvi®)[53]等。
Agarwal等[54]通过吸附法将铜绿假单胞菌噬菌体加入PLGA微粒中,并冻干成粉剂。该噬菌体粉剂在室温下储存14 d后,滴度下降约为0.5个数量级。此方法使用的PLGA微粒,可以使噬菌体在前5 min爆发释放约15%,并且剩余噬菌体可持续释放。使用干粉喷粉器将掺有乳糖的噬菌体PLGA微粒输送给小鼠后,发现这些微粒分散于小鼠肺部各个位置,并可成功治疗小鼠由铜绿假单胞菌引起的肺炎。
Jamaledin等[55]发现PLGA微粒包封携带表达卵清蛋白(OVA)抗原决定簇的工程噬菌体,能够诱导机体先天性和适应性免疫反应。并且PLGA纳米微粒(≤1 μm)可进入哺乳动物细胞(如巨噬细胞、内皮细胞、上皮细胞以及平滑肌细胞),以及长时间向细胞内输送其包封的药物[56]。同时,包封噬菌体的PLGA微粒大小决定着噬菌体被巨噬细胞内化程度[55]。较大的PLGA微粒(直径8.0 μm)包封的噬菌体被巨噬细胞内化程度低于较小的PLGA微粒(直径1 μm)包封的噬菌体;并且PLGA多孔微粒包封的噬菌体被巨噬细胞的内化程度低于PLGA无孔微粒。
综上所述,使用大小合适的PLGA纳米微粒包封噬菌体,可将噬菌体递送至哺乳动物细胞内,从而靶向胞内寄生菌。但目前噬菌体在被PLGA纳米微粒包封后,存活时间仍受到限制,因此应用该方法治疗胞内寄生菌,仍需提高噬菌体在PLGA聚合物内长期储存的稳定性。
3.4.2海藻酸盐基微粒
海藻酸盐是一种聚阴离子聚合物,是用于包装噬菌体,使其可口服给药最常用的聚合物[57]。海藻酸盐基微粒可保护其包封的噬菌体免受酶降解,并且海藻酸盐的膨胀与收缩具有pH依赖性,其在低pH环境(胃)内呈收缩状态,但在高pH环境(肠)中会出现膨胀或进一步溶解的现象[58]。该特性使其作为对pH敏感噬菌体入胞的载体具有一定优势。不仅如此,使用壳聚糖[59]、果胶[60]、乳清蛋白[61]和丙烯酸树脂[62]等包被海藻酸盐或与海藻酸盐混合使用,可提高海藻酸盐的酸稳定性和/或调节肠道内海藻酸盐基微粒的膨胀现象,进而延长海藻酸盐包封噬菌体的活性。
Wall等[63]研究表明,使用海藻酸盐基微粒包封噬菌体可有效减少沙门菌在猪扁桃体、回肠和盲肠中的定植。Ma等[64]测定海藻酸盐/乳清蛋白包封的噬菌体在雏鸡体内时间分布,表明包封后的噬菌体在体内停留的时间更长。Colom等[65]使用海藻酸盐基微粒包封的噬菌体鸡尾酒(UAB_Phi20、UAB_Phi78和UAB_Phi87)对肉鸡进行口服给药,得到与Ma等相似的结果。该研究进一步表明,每日使用包封后的噬菌体治疗,可有效控制沙门菌感染。并且包封后的噬菌体与游离噬菌体相比,保护作用可持续更长时间,这与脂质体包封噬菌体的研究结果相符合。Vinner等[62]研究证明,海藻酸盐包封的大肠杆菌噬菌体K1F能够被哺乳动物细胞内化,并清除寄生于细胞内的大肠杆菌[66],从而有效保护人膀胱上皮细胞(ATCC®HTB-4TM)免受大肠杆菌株EV36-RFP的侵袭。
上述结果表明噬菌体可在海藻酸盐微粒中长期保持活性,并且海藻酸盐包封的噬菌体在体内能够成功治疗细胞内细菌感染。这是由于海藻酸盐微粒释放的噬菌体能靶向目标细胞,无论噬菌体是在细胞外释放,还是被细胞内化后释放,都可能清除胞内寄生菌。但将海藻酸盐基微粒应用于临床,还需明确海藻酸盐微粒包封噬菌体后的入胞机制,以及提高其入胞效率,从而提高噬菌体对胞内寄生菌的杀菌效率。
4 挑战与展望
目前许多研究已证明,噬菌体具有替代或补充抗生素成为新型抗菌药物的潜力,特别是针对耐药细菌感染和胞内寄生菌感染,但将噬菌体应用于临床仍面临诸多挑战。
噬菌体疗法难以大范围应用于临床的主要原因是噬菌体只有在细菌达到一定密度时才开始增殖,致使噬菌体疗法使用过早或噬菌体剂量不合适,都可能导致噬菌体在开始增殖之前被机体清除掉[67]。目前对噬菌体的药代动力学特性仍缺乏了解,包括给药后噬菌体稳定性、哺乳动物宿主内噬菌体和细菌之间的相互作用,以及噬菌体对机体免疫应答的影响[68-70]。因此,仍需更多基础研究和临床试验来验证噬菌体疗法的疗效,并评估噬菌体的理想剂量、给药频率以及噬菌体治疗的持续时间。
一些用于治疗的噬菌体产品已在一些东欧国家上市,并越来越多地应用于感染性疾病的治疗,但目前还未有载体介导噬菌体入胞用于清除胞内寄生菌的临床试验。噬菌体疗法与传统抗生素疗法存在的差异使其在应用于临床前需进行临床随机试验来确认其疗效,这导致噬菌体疗法难以大规模应用于临床,目前仅限于对个别患者进行实验性治疗。
由于噬菌体具有高度特异性,为最大限度地发挥噬菌体疗法的治疗潜力,最好是挑选多价噬菌体制作噬菌体鸡尾酒,使其具有广谱抗菌作用。但制备含有多种噬菌体且滴度稳定的噬菌体制剂,需解决诸多相关的技术挑战。例如,噬菌体制剂面对生产过程中产生的机械应力是否具有鲁棒性等。最近完成的噬菌体治疗人类细菌感染的跨国临床研究计划中[71],单个噬菌体表现出优异储存稳定性,但该研究中噬菌体鸡尾酒PP1131(由12个天然裂解性假单胞菌噬菌体组成)的总效价在制备后15 d内却下降了3个数量级。因此,扩大噬菌体制剂宿主谱更可行的方法是鉴定天然多价噬菌体或具有宽宿主谱的基因工程噬菌体,从而最大限度地减少鸡尾酒配方所需的噬菌体种类。
胞内寄生菌引起的感染性疾病,难以通过常规方法治疗,且治疗失败风险极大。虽然一些噬菌体已被证明具有穿透哺乳动物细胞膜、靶向胞内寄生菌并发挥其裂解活性的能力,但上述研究表明,无机纳米颗粒、脂质体、PLGA微粒等载体介导噬菌体投递入胞,可使噬菌体在机体内环境保持活性,提高噬菌体入胞效率,更好地靶向胞内寄生菌。上述载体中,脂质体作为载体,具有明确的入胞机制,可有效提高噬菌体入胞效率,并防止噬菌体被宿主免疫系统清除和免受细胞内环境影响,这使得脂质体也成为研究最广泛且最成熟的介导噬菌体入胞的载体。目前载体介导噬菌体入胞的相关研究主要集中于研究噬菌体、胞内寄生菌以及哺乳动物细胞之间的相互作用,以及明确各种载体的入胞机制,提高载体包封噬菌体的效率及包封后的入胞效率,从而开发适用于介导噬菌体入胞的载体的试验/技术平台。这些新的试验/技术平台,对载体介导噬菌体入胞、控制或治疗胞内寄生菌感染至关重要。
综上可以看出,应用载体介导噬菌体入胞,清除胞内寄生菌的治疗方法前景十分广阔。但国内开展噬菌体治疗的起步时间较之国外相对较晚,针对胞内寄生菌感染的相关临床病例较少,导致国内噬菌体在胞内寄生菌研究方面相对滞后。随着胞内寄生菌感染的病例逐渐增多,未来国内关于噬菌体抗胞内寄生菌的治疗基础和临床研究同样会逐渐增加。相信载体介导噬菌体入胞,在未来可能会成为理想的控制、治疗胞内寄生菌感染的疗法,在生命科学领域发挥重要作用。