KIRREL 表达对胃癌的预后作用及与肿瘤免疫细胞浸润的相关性
王 接,李启信,杨侃侃
(安徽医科大学附属巢湖医院胃肠外科,安徽 巢湖 238000)
胃癌(gastric cancer)是消化系统常见的恶性肿瘤之一。据统计[1],2020 年全球人口中胃癌在所有恶性肿瘤中发病率排名第5,占5.6%,新发病例致死率排名第4,占7.7%,具有较高的发病率及死亡率,且我国胃癌发病情况相对于其他国家更为严重,对人类的健康及生活质量产生巨大影响。胃癌的发生与发展与诸多因素相关,如不良生活习惯、幽门螺杆菌感染、遗传、基因突变等[2,3]。目前,早期胃癌的治疗仍以手术为主[4],进展期胃癌的治疗主要是手术治疗联合化学治疗、内分泌治疗、免疫治疗等辅助治疗的综合治疗手段[5-7]。KIRREL 又称Nehp1,是由人类KIRREL 基因转录翻译的一种免疫球蛋白超家族类细胞黏附分子[8],属于NEHP 蛋白家族。研究显示[9-11],KIRREL 主要表达于肾脏足细胞、神经突触和胎盘中,参与足细胞修复、神经发育和炎症反应。随着临床研究的进展,发现KIRREL 在许多恶性肿瘤中过表达,对肿瘤的发生、发展产生影响[12,13],并可能成为肿瘤治疗的新靶点基因[14]。但KIRREL在胃癌中的表达等级和预后作用以及是否可以作为免疫治疗的新靶点仍尚未可知。因此,本研究中通过使用肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)和各种公共数据库对KIRREL 在胃癌中的表达、预后及其与肿瘤免疫浸润的相关性进行分析,现报道如下。
1 材料与方法
1.1 KIRREL 基因表达分析 通过TIMER(https://cistrome.shinyapps.io/timer/)数据库来分析KIRREL在泛癌及其癌旁组织中的差异表达,检索条件:①Diff Exp;②Gene symbol:KIRREL;③Submit。接着,通过UALCAN(http://ualcan.path.uab.edu/index.html)数据库对TCGA 数据进行分析,进一步验证KIRREL 在胃癌组织及其癌旁组织中的表达差异以及与临床特征之间的关系,检索条件:①Gene symbol:KIRREL;②Select cancer:stomach adenocarcinomana;③Gene expression;④KIRREL expression based on sample types,individual cancer stages,tumor grade,nodal metastasis status,H.pylori infection status。
1.2 预后价值分析 通过使用Kaplan-Meier(https://kmplot.com/analysis/)网站和GEPIA(http://gepia.cancer-pku.cn/index.html)数据库绘制生存曲线,评估KIRREL 基因表达水平在胃癌患者预后中的价值,检索条件为:①Gene symbol:KIRREL;②Cancer:gastric cancer;③Survival:OS。
1.3 免疫细胞浸润分析 采用TIMER 数据库分析KIRREL 基因表达与免疫细胞浸润等级的相关性,检索条件:①Gene;②Gene symbol:KIRREL;③Cancer type:STAD;④Immune Infiltrates:Purity、B cell、CD8+T cell、CD4+T cell、macrophage、neutrophil、dendritic cell。
1.4 KIRREL 的表达与免疫细胞浸润的关系分析 通过SangerBox 分析KIRREL 相关的免疫检查点基因,通过ESTIMATE 评估其在肿瘤微环境中的肿瘤纯度,其中包括基质分数(stromal score),免疫分数(immune score)和评估分数(estimate score)。另通过SangerBox 网站分析二者之间的相关性,检索条件:①泛癌分析;②免疫检查点基因分析;③Gene symbol:KIRREL;④Cancer type:STAD。
1.5 统计学方法 采用Wilcoxon 检验分析KIRREL在泛癌中的表达水平差异,Kaplan-Meier 生存曲线和Log-rank 检验分析KIRREL 表达水平的生存差异。另采用Spearman 相关系数分析KIRREL 与胃癌肿瘤微环境中的免疫细胞浸润及免疫检查点基因表达的相关性,采用Pearson 相关系数分析KIRREL与基质分数、免疫分数和评估分数的相关性,以P<0.05 表示差异有统计学意义,P<0.01 表示统计学意义显著,P<0.001 表示统计学意义极显著。
2 结果
2.1 KIRREL 在泛癌中的表达 KIRREL 在胆管癌、食管癌、头颈鳞状细胞癌、胃癌中的表达水平高于相对应的癌旁组织(P<0.05),且在膀胱尿路上皮癌、乳腺浸润癌、肾嫌色细胞癌、肾乳头状细胞癌、肺腺癌、肺鳞癌、前列腺癌、甲状腺癌、子宫内膜癌中表达下调(P<0.05),见图1。通过UALCAN 数据库分析TCGA 数据,发现KIRREL 在胃癌组织中表达具有显著差异(P=1.18E-06),见图2。
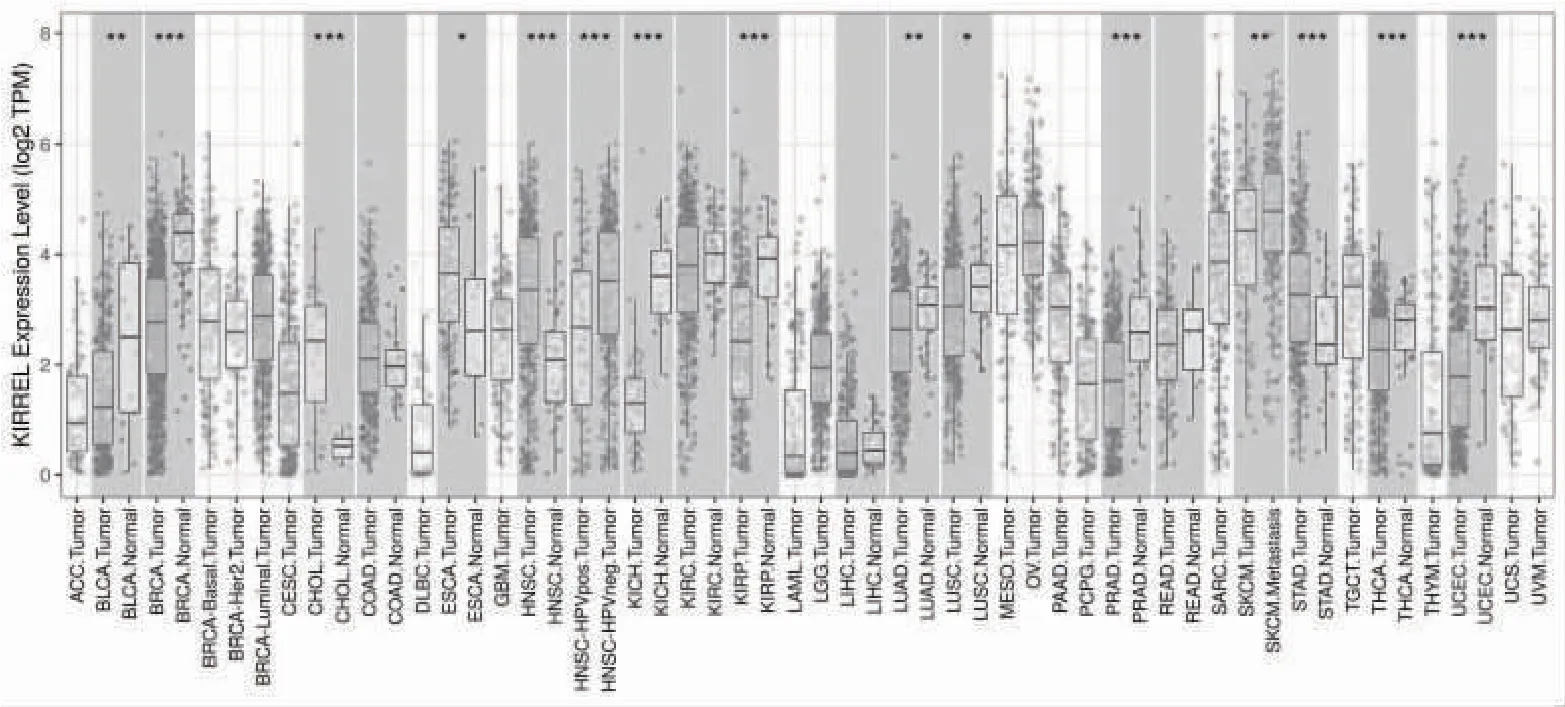
图1 KIRREL 在泛癌中的表达

图2 KIRREL 在胃癌组织及癌旁组织中的表达差异
2.2 KIRREL 表达与临床特征的关系 UALCAN 数据库分析显示,肿瘤分期为2~4 期的患者中KIRREL 表达高于癌旁组织及肿瘤分期为1 期的患者,见图3A;肿瘤分级为3 级的患者中KIRREL 表达高于癌旁组织和肿瘤分级为1、2 级的患者,且肿瘤分级为2 级的患者中KIRREL 表达高于癌旁组织,见图3B;随着淋巴结转移分期的增加,KIRREL 表达也呈上升趋势,见图3C。

图3 KIRREL 表达与临床特征的关系
2.3 KIRREL 表达对胃癌患者预后的价值 GEPIA数据库分析显示,高表达的KIRREL 对胃癌患者OS有显著影响(HR=1.5,P=0.02;n=383),见图4A。Kaplan-Meier 数据库分析发现,更高表达的KIRREL 预示着胃癌患者具有较差的OS(HR=1.5,P=2.7E-06;n=875),见图4B。

图4 KIRREL 表达对胃癌患者预后的价值
2.4 KIRREL 表达与免疫检查点基因和ESTIMATE分数的关系 通过Sangerbox 数据库分析与KIRREL密切相关的免疫检查点,发现在胃癌患者中有60 个免疫检查点途径基因(Inhibitory=24,Stimulatory=36)与KIRREL 的表达有显著相关性(图5A)。然后,根据KIRREL 表达再次计算了胃癌中每例患者的基质分数、免疫分数和评估分数,结果显示KIRREL的表达与基质分数、免疫分数和评估分数均呈正相关(基质分数:r=0.70,P=3.5E-59;免疫分数:r=0.25,P=4.4E-7;评估分数:r=0.52,P=3.8E-28),见图5B~5D。

图5 KIRREL 表达与免疫检查点基因和ESTIMATE 分数的关系
2.5 KIRREL 表达与免疫细胞浸润的关系 TIMER数据库分析显示,KIRREL 表达与CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞、树突状细胞的浸润等级呈正相关(P<0.05),与肿瘤纯度、B 细胞无相关性(P>0.05),见表1。

表1 KIRREL 表达与免疫细胞浸润的关系
3 讨论
胃癌是常见的消化道恶性肿瘤,其发生、发展、转移受到多种因素影响,目前仍以手术为主要治疗手段。但由于其进展较快,很多患者失去手术机会,严重威胁患者生命健康。近年来随着分子生物学和肿瘤免疫学的快速发展,出现了一系列新的肿瘤治疗方法,包括放射治疗、化学治疗、免疫治疗等,逐渐成为治疗恶性肿瘤的新选择。其中,免疫治疗在临床上得到了广泛应用,并取得了显著的疗效,以PD-1/PD-L1 抑制剂、HER2 具有代表性[15,16]。既往研究表明[17],KIRREL 在肿瘤发生、炎症反应、足细胞细胞修复和神经元发育等过程中起到重要作用。但KIRREL 在胃癌的发生、发展中是否发挥重要作用,并能够作为免疫治疗的潜在靶点尚未可知。因此,本研究通过数据挖掘对TCGA、GEO 等常见的生物医学信息数据库进行分析,以期为胃癌的免疫治疗提供新的选择。
本研究首先通过TIMER 和UALCAN 数据库分析了KIRREL 在恶性肿瘤组织和癌旁组织中的差异表达,发现KIRREL 在胆管癌、食管癌、头颈鳞状细胞癌、胃癌的肿瘤组织中的表达水平高于相对应的癌旁组织,差异有统计学意义(P<0.05);而KIRREL在膀胱尿路上皮癌、乳腺浸润癌、肾嫌色细胞癌、肾乳头状细胞癌、肺腺癌、肺鳞癌、前列腺癌、甲状腺癌、子宫内膜癌中表达下调(P<0.05);通过UALCAN数据库分析TCGA 数据,发现KIRREL 在胃癌组织中表达具有显著差异(P=1.18E-06),提示KIRREL在胃癌的发生过程中起到重要作用。然后,经UALCAN 数据库进一步分析KIRREL 在胃癌患者不同临床特征中的表达,发现KIRREL 的表达与胃癌患者肿瘤分期、分级、淋巴转移密切相关,表明KIRREL 表达对胃癌的发展和侵袭起到促进作用。接着,通过GEPIA 和Kaplan-Meier 数据库分析KIRREL 与胃癌患者预后关系得出,高表达的KIRREL 患者具有更低的生存率。上述分析结果提示,KIRREL 的高表达在胃癌的发生、发展、侵袭、不良预后中起重要作用,是潜在的预后生物标志物。此外,通过TIMER 数据库探究发现,KIRREL 表达与CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞、树突状细胞的浸润等级有显著相关性,与B 细胞无相关性。另一方面,通过Sangerbox 数据库分析与KIRREL 密切相关的免疫检查点,发现在胃癌患者中有60 个免疫检查点途径基因(Inhibitory=24,Stimulatory=36)与KIRREL 的表达有显著相关性。然后,根据KIRREL 表达再次计算了胃癌中每例患者的基质分数、免疫分数和评估分数,结果显示KIRREL 的表达与基质分数、免疫分数和评估分数均呈正相关。上述结果表明,KIRREL 调控了胃癌肿瘤微环境中的免疫细胞浸润及免疫检查点基因,参与肿瘤的免疫逃避和抑制,为胃癌的免疫治疗提供了理论基础[18-20],提示KIRREL 可能成为肿瘤免疫治疗的潜在靶点。
但本研究仍有很多局限性:首先,所有数据的来源是各个数据库对TCGA 数据的加工、处理,各数据库之间的统计方法可能存在误差,缺乏特异性;其次,缺乏更多的实验数据来进一步证明KIRREL 的高表达在胃癌肿瘤生成、发展和侵袭以及调控免疫细胞浸润等级和免疫检查点基因中的具体机制,需要更多的体内和体外实验设计来验证研究结果。
综上所述,KIRREL 在胃癌的发生、发展及免疫浸润中发挥了关键作用,可以作为评估患者临床预后的生物学标记物和指导免疫治疗的潜在靶点。

