多b值DWI序列ADC值在脊柱骨质疏松性压缩骨折与椎体转移瘤病理性压缩骨折鉴别诊断中的价值研究
王振兴,薛伟,魏萌,康少英,张英民
(邯郸市中心医院西区骨三科,河北邯郸 056001)
MRI具有多参数、多系列成像及独特的软组织分辨率,且MRI的弥散加权成像(diffusion weighted imaging,DWI)是目前唯一无创检测体内水分子扩散运动的方法,根据组织中水分子扩散速度不同而成像,通过测量表观扩散系数(apparent diffusion coefficient, ADC)实现,反映机体组织结构的生理和病理状态[1]。DWI信号的衰减值主要由ADC值和弥散敏感系数值(b值)决定, b值增加时,ADC图像敏感度增加、稳定性增加,同时其信噪比下降;当b值较小时,ADC值则容易受生理运动影响,导致测量值稳定性不佳,不能真实反映组织中水分子弥散运动情况[2-3]。因此,如何选择合适的b值在DWI成像方面显得尤为重要。本研究旨在探讨多b值(0、100、200、400、600、800 s/mm2)DWI序列ADC值对于鉴别诊断脊柱骨质疏松性压缩骨折与椎体转移瘤病理性压缩骨折的价值。
1 资料与方法
1.1 一般资料
回顾性分析2009年1月~2019年12月经骨密度(T值≤-2.5)、X线、CT等影像学证实为脊柱骨质疏松性压缩骨折的68例患者(A组),以及经PET-CT、病理诊断为椎体转移瘤病理性压缩骨折的74例患者(B组)作为研究对象。A组中,男36例,女32例;年龄52~87岁,平均(62.4±7.5)岁。B组中,男39例,女35例;年龄31~85岁,平均(54.1±6.8)岁。所有患者均具有完整的临床资料和完整的多b值(0、100、200、400、600、800 s/mm2)DWI的MRI影像资料,且均未行椎体压缩性骨折的相关治疗。
1.2 MRI检查方法
采用飞利浦公司的Achieva 3.0T扫描仪,先行常规MRI扫描,主要扫描序列包括T1加权像(T1 weighted image, T1WI)、T2加权像(T2 weighted image,T2WI)和脂肪抑制T2WI(short tauinversion recovery T2,STIR T2)。再行多b值(0、100、200、400、600、800 s/mm2)下DWI扫描,TR:2800 ms,TE:57 ms,层厚3 mm,层间距1 mm,NEX 2次,FOV:320 mm。
1.3 影像分析
首先分析各患者常规MRI影像学表现特点,包括患者椎体形态改变、椎体内有无正常骨髓信号残存、有无附件受累或软组织肿块形成、病变区域T1WI、T2WI、DWI信号。将图像传输至后处理工作站,工作站自动生成ADC图,观察椎体病变显示的最大层面区域并测量3次ADC值,取平均值,测量时尽量避开血管、脑脊液、囊变、坏死区域;分别测量其多b值DWI下的ADC值并记录。
1.4 统计学方法
2 结果
2.1 常规MRI及DWI信号表现
A组骨质疏松性压缩骨折的椎体形态多表现为楔形或凹陷形,T1WI以低信号常见,T2WI以高信号常见,DWI以等或低信号为主、部分为稍高信号,椎体后缘成角及椎体内可见正常骨髓信号残留。B组转移瘤病理性压缩骨折的椎体形态多表现为倒楔形或扁平形,T1WI以低信号为主,T2WI以高信号为主,DWI以高信号为主,可见附件受累及椎旁软组织肿块形成。A、B两组的常规MRI及DWI信号表现比较,差异有统计学意义(P<0.05),见表1、图1。
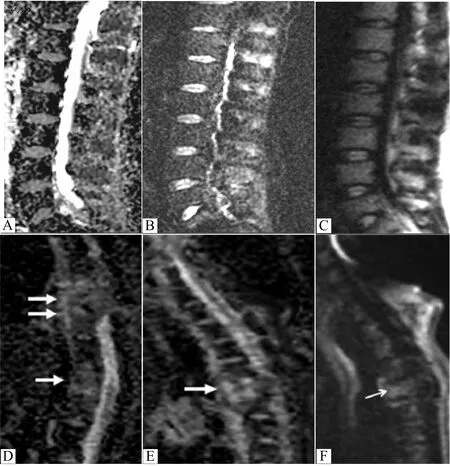
图1 A-C图所示为b值=100、400、800 s/mm2时,骨质疏松性压缩骨折DWI为等或低信号。D-F图示b值=100、200、400 s/mm2时,转移瘤病理性骨折DWI为高信号。
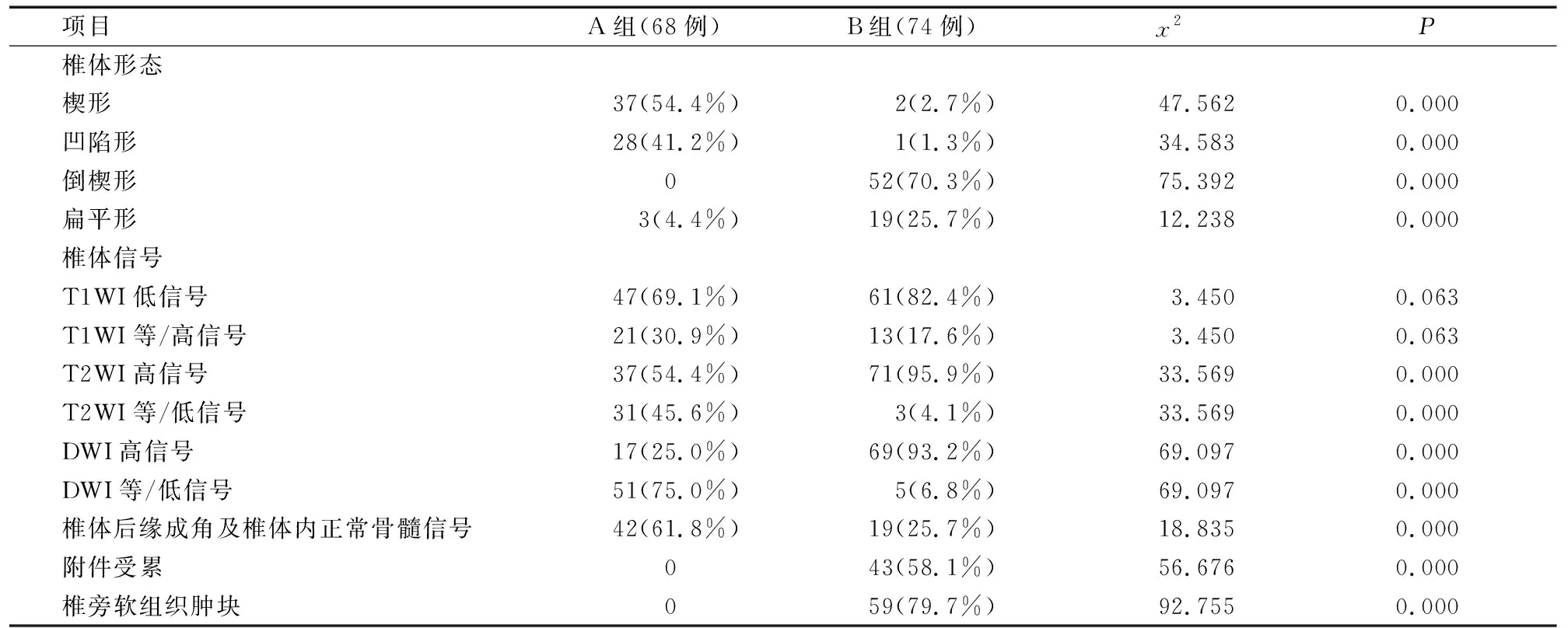
表1 常规MRI及DWI信号表现情况(%)
2.2 两组ADC值比较
当b值分别为0、100、200、400、600、800 s/mm2时,A组的ADC值均显著高于B组,差异均具统计学意义(P<0.05),见表2。
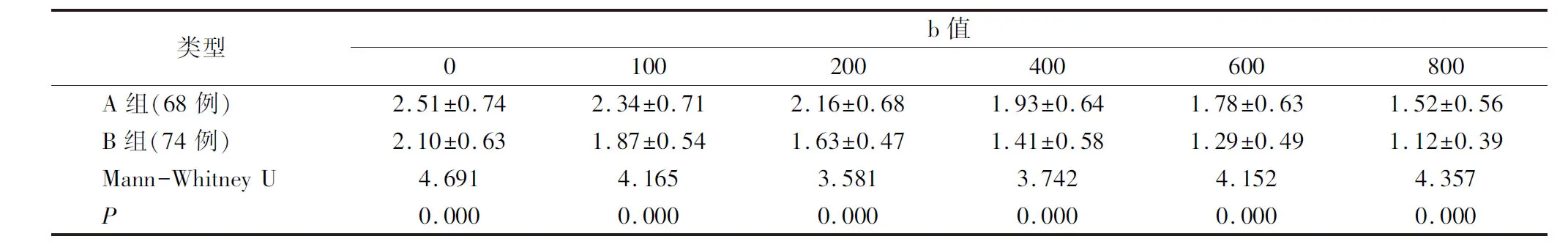
表2 骨质疏松性压缩骨折与转移瘤病理性骨折ADC值比较
2.3 不同b值的诊断效能
当b值分别取0、100、200、400、600、800 s/mm2时,对应曲线下面积AUC值分别为0.671、0.706、0.897、0.918、0.743、0.712,b值为400 s/mm2时的诊断效能最佳,见表3。

表3 不同b值在骨质疏松性压缩骨折与转移瘤病理性压缩骨折中的诊断效能(%)
3 讨论
MRI对于诊断和鉴别诊断椎体压缩性骨折原因具有一定的临床价值,较X线平片及CT敏感,且利用脊柱DWI成像技术可反映组织体内结构和功能,具有无创、无辐射、无需对比剂等优势[4]。但DWI信号受b值影响,b值越大,对扩散的敏感性越高,测得ADC值越准确,但b值过大易导致图像变形而影响ADC值测量。
骨质疏松的特点是骨小梁稀疏、减少,骨量丢失、降低,有机成分减少,骨脆性增加,但骨髓信号正常,椎体骨折主要由骨髓水肿、出血等使自由活动的水分子增加,因此,骨质疏松患者的椎体信号改变多为线样、条片状改变,出血成分导致T1WI、T2WI信号多变,但T1WI以低信号常见,T2WI以高信号常见,椎体后缘成角及椎体内可见正常骨髓信号残留[5]。转移瘤的椎体压缩性骨折主要为肿瘤细胞浸润正常骨髓,并可伴有邻近软组织肿胀,往往表现为单发或跳跃性发作,因此,其椎体信号多为结节、圆形或团块状改变,呈弥漫分布,与正常骨髓信号分界不清,T1WI以低信号为主,T2WI以高信号为主[6]。骨质疏松性压缩骨折的椎体形态多表现为楔形或凹陷形,转移瘤病理性压缩骨折椎体形态多表现为倒楔形或扁平形,这可能与椎体内供血动脉有关。
DWI通过ADC值进行量化分析,骨质疏松患者因骨髓充血水肿,细胞外间歇水分子增加,扩散速率加快,其ADC值升高,DWI多表现为等或低信号;转移瘤患者肿瘤细胞浸润骨髓及间质,细胞外间隙减小,水分子运动受限,扩散速率降低,ADC值下降,因此DWI以高信号为主[7-9]。本研究中,两组患者的常规MRI及DWI信号表现相比,差异均有统计学意义(P<0.05),提示常规MRI及DWI信号表现对两者压缩性骨折的鉴别诊断具有一定帮助。但部分患者诊断效能不佳,可能与DWI信号高低存在一定的视觉评估误差有关;此外,DWI对骨性转移、骨质增生硬化等不敏感。
为进一步提高其诊断效能,本研究结合ADC值进行研究,结果显示,在不同b值情况下,骨质疏松性压缩骨折的ADC值均显著高于转移瘤病理性骨折,提示ADC值可以区分两种压缩性骨折。新鲜压缩性骨折因水肿、出血使间质腔扩大,水分子运动增加,DWI呈稍高信号,而其他情况下则以等或稍低信号为主,测得ADC值较大。转移瘤由于肿瘤细胞浸润、堆积使水分子运动受限,DWI呈高信号,测得ADC值则较小。大量研究结果[10-11]与本研究结果一致。本研究显示,b值取400 s/mm2时,对应曲线下面积AUC值最高,准确度、特异度、敏感度、阳性预测值、阴性预测值及约登指数也最高,诊断效能最佳。但也有部分研究显示,b值取300 s/mm2或600 s/mm2时诊断效能最佳[12-13]。

